文章信息
- 孙瑞芬, 张艳芳, 郭树春, 于海峰, 李素萍, 乔慧蕾, 聂惠, 安玉麟
- SUN Rui-fen, ZHANG Yan-fang, GUO Shu-chun, YU Hai-feng, LI Su-ping, QIAO Hui-lei, NIE Hui, AN Yu-lin
- 向日葵盐胁迫相关基因的cDNA-AFLP差异表达
- Differentially Expressed Analysis on the Responsive Genes to Salt Stress in Sunflower by cDNA-AFLP
- 中国生物工程杂志, 2015, 35(1): 34-40
- China Biotechnology, 2015, 35(1): 34-40
- http://dx.doi.org/10.13523/j.cb.20150105
-
文章历史
- 收稿日期:2014-09-09
- 修回日期:2014-11-14
土壤盐渍化严重影响植物的生长,并给农业生产造成巨大损失,用耐盐植物基因资源改良作物耐盐性对提高作物产量具有非常重要的意义。向日葵(Helianthus annuus L.)被誉为盐渍地上的先锋作物,具有可为植物抗逆性改良利用的抗性基因。目前关于植物抗逆境基因的研究已经取得了很大进展,但有关向日葵在干旱、盐害等逆境条件下基因表达的研究报道较少,其耐盐机制有待深入研究。
cDNA-AFLP(cDNA-amplified fragment length polymorphism)技术,是Bachem等[1]以AFLP为基础发明的用于研究基因表达差异的技术。该技术结合了AFLP和RT-PCR技术,具有可靠性、灵敏性和可重复性、无需了解序列信息等优点,已在研究植物逆境基因表达上得到了广泛应用[2,3,4]。本研究利用cDNA-AFLP技术,研究向日葵盐胁迫前后基因表达的变化,并对差异表达基因进行筛选,结合生物信息学方法分离、鉴定盐胁迫相关基因,为进一步克隆耐盐相关基因全长,并从分子水平解析向日葵耐盐分子机制奠定基础。 1 材料与方法 1.1 材 料 1.1.1 植物材料
向日葵耐盐品种内葵杂4号种子由内蒙古农牧业科学院作物研究所提供。 1.1.2 主要试剂
植物总RNA提取试剂盒、pGM-T Cloning Kit、E.coli TOP10购自天根生化试剂(北京)有限公司;M-MLV RTase cDNA Synthesis Kit试剂盒、内切酶EcoRⅠ、MseⅠ购自TaKaRa公司;High Pure PCR Product Purification Kit、DIG High Prime DNA Labeling and Detection Starter Kit为Roche公司产品;尼龙膜为PALL公司产品,2×Taq PCR Mix购自南京博尔迪生化试剂有限公司,其它试剂均为进口或国产分析纯试剂。 1.1.3 接头及引物
EcoRⅠ、MseⅠ接头序列及引物序列由生工生物工程(上海)有限公司合成。EcoR I接头序列:E-ad1 5′-CTCGTAGACTGCGTACC-3′,E-ad2 5′-PAATTGGTACGCAGTC-3′;Mse I接头序列:M-ad1 5′-GACGATGAGTCCTGAG-3′,M-ad2 5′-PTACTCAGGACTCAT -3′,其中P为磷酸化碱基。预扩增引物采用EcoR I+0 / Mse I+0组合。EcoR I引物序列(E-0):5′-GACTGCGTACCAATTC-3′,Mse I引物序列(M-0):5′-GATGAGTCCTGAGTAA-3′。选择性扩增引物采用EcoRⅠ+NN / MseⅠ+NN组合,其中N为A、T、C、G任一碱基。 1.2 方 法 1.2.1 材料种植与盐处理
选取健康、饱满、大小一致的内葵杂4号种子用水浸种24h,播于装有蛭石的营养钵中,在24±2℃条件下培养。待种子萌发长出1对真叶时,将幼苗从蛭石中取出,小心洗去根部蛭石,转移到1/2MS营养液中培养4~5d。待幼苗适应生长环境后,将其转入到含有200mmol/L NaCl的1/2MS营养液中胁迫处理,对照用1/2MS营养液。待叶片萎蔫下垂后取植株幼根,于液氮中速冻,-70℃冰箱保存备用。 1.2.2 cDNA-AFLP差异显示
(1)总RNA提取及双链cDNA合成与酶切 按照植物总RNA提取试剂盒说明书分别提取对照和处理植株幼根总RNA。用Oligo-dT将mRNA反转录成双链cDNA,方法按照M-MLV RTase cDNA Synthesis Kit说明书进行。合成的双链cDNA用限制性内切酶EcoRI和MseI进行双酶切。
(2)接头的制备及与酶切产物的连接 EcoRⅠ和MseⅠ连接接头分别由2条寡核苷酸序列组成。EcoR I连接接头制备过程为分别取100μmol/L的E-ad1和E-ad2 1μl于PCR管中混匀,用ddH2O补至20μl。反应条件为65℃ 10min,37℃ 10min,25℃ 10min,4℃ 25min。Mse I连接接头制备过程为分别取100μmol/L 的M-ad1和M-ad2 10μl于PCR管中混匀,反应条件同上。然后取EcoRI和MseI连接接头各1μl加入到10μl酶切后的cDNA中,并加入10×Ligation Buffer 2μl 和T4 DNA Ligase(400U/μl)0.5μl,用ddH2O补至20μl,16℃连接过夜。
(3)连接产物的预扩增和选择性扩增的差异显示 以连接接头的cDNA为模板,用E-0/M-0预扩增引物进行扩增,PCR反应程序为94℃ 5min,94℃ 30s,56℃ 1min,72℃ 1min,30个循环,最后72℃保温5min。将预扩增产物用ddH2O稀释40倍作为选择性扩增模板。选择性扩增引物组合为EcoR I+NN/Mse I+NN,其中N为A、T、C、G任一碱基。用256对引物组合对预扩增产物进行选择性扩增,反应程序为94℃ 2min,94℃ 30s,65℃ 30s(每循环1次降低0.7℃),72℃ 1min,12个循环;94℃ 30s,56℃ 30s,72℃ 1min,23个循环,最后72℃ 保温5min。选择性扩增产物用6%PAGE进行差异显示并用数码相机拍照以便分析。 1.2.3 上调TDFs的回收及二次PCR扩增
采用煮沸的方法回收表达量较高的差异片段。用干净的刀片将上调差异条带切下放入1.5ml的离心管中,用400μl ddH2O清洗凝胶一次,弃掉水,再加入30μl ddH2O,室温放置20min,沸水浴中煮20min,10 000r/min离心5min,取3μl上清液进行PCR扩增,反应体系及条件同选择性PCR扩增,1.2%琼脂糖凝胶电泳检测。 1.2.4 TDFs的反向Northern blot验证
为验证TDFs的真实性,选择二次扩增条带清晰的条带回收,分别取5μl回收产物与向日葵18S rDNA(作阳性对照,CK+)变性后分别点在相同2张膜(A,B)的同一位置(每次点1μl,重复点5次),分别以对照(未经盐处理)和盐处理样品的cDNA为探针与之杂交。探针标记和杂交过程按照DIG High Prime DNA Labeling and Detection Starter Kit 产品说明书进行。 1.2.5 阳性TDFs序列测定与分析
电泳回收阳性TDFs片段与T载体连接,转化E.coli TOP10,将检测合格的阳性克隆送南京金斯瑞生物科技有限公司测序,测得序列利用NCBI的BLAST分析软件进行比对分析。 2 结 果 2.1 cDNA-AFLP分析及与差异表达片段的筛选
采用256对选择性扩增引物研究了向日葵盐胁迫前、后基因表达的变化并进行差异表达片段的筛选。发现232对引物组合可扩增出DNA条带,而且每对引物组合扩增的条带数不等,差异条带数也不等。扩增的差异条带可分为保守的、组成性表达的片段,上调片段和下调片段(如图 1,箭头A、B、D所示),其中上调片段和下调片段可能是一些与应答盐胁迫相关的片段。232对引物组合共筛选到上调TDFs 845个,下调TDFs 430个,大小分布在100~1 500bp范围内,但分离较好的条带主要在100~500bp之间。
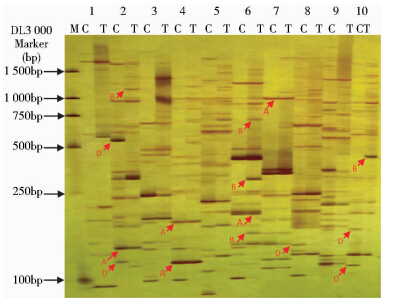
|
| 图 1 部分引物组合选择性扩增产物的PAGE电泳 Fig. 1 PAGE gel electrophoresis of selectively amplified products of several primer pairs M: 100bp Marker; C: The amplified products under no salt stress treatment; T: The amplified products under the salt stress treatment; 1~10: Amplified products of different primer pairs |
挑取表达量较高的上调TDFs 635个,采用煮沸的方法进行回收,并以其为模板进行二次PCR扩增,1.2%琼脂糖凝胶电泳检测,得到条带清晰的片段367个,大小在100~500bp之间,部分扩增结果如图 2所示。
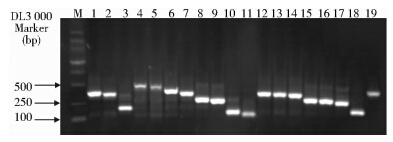
|
| 图 2 部分上调TDFs二次PCR扩增产物的琼脂糖凝胶电泳 Fig. 2 Agarose gel electrophoresis of the second amplification products of up-regulated TDFs |
电泳回收367个二次PCR扩增的上调TDFs并进行Northern blot检测。结果显示,A、B膜上的CK+杂交信号强度一致,说明A、B膜上的杂交结果可靠。367个差异表达片段中,只有42个片段与盐处理cDNA探针有杂交信号,而与对照cDNA探针无杂交信号,表明这42个差异表达片段为盐诱导的特异表达基因(图 3,箭头所示);在A、B膜上均有或强或若的杂交信号,但差异不显著,说明回收的差异表达片段可能是假阳性;在A、B膜上均没有杂交信号的片段,可能与这些片段代表低丰度表达的基因有关,或者与Northern blot产生的杂交信号很弱有关。该结果不仅进一步验证了cDNA-AFLP的分析结果,而且推测42个基因可能为向日葵耐盐相关的特异基因。

|
| 图 3 反向Northern杂交验证差异表达片段(部分) Fig. 3 Confirmation of differential expressed fragments using the method of reverse northern (a) Hybridized with cDNA from no-treatment(control) (b)Hybridized with cDNA from salt treatment; CK: 18S rRNA from sunflower |
从42个Northern blot阳性差异片段中,选取12个TDFs进行克隆并送南京金斯瑞生物科技有限公司测序,获得10条TDFs序列,另外2个片段由于出现杂峰,导致测序失败,可能是多个片段混合在一起所致。所得序列经NCBI的Blastx比对,结果表明10个TDFs序列均与已知胁迫相关基因在蛋白水平上有一定的相似性 (表 1),包括了一些已经报道的与胁迫相关基因编码的蛋白,如GRAS家族转录因子(GRAS family transcription factor)、热休克蛋白60(heat shock protein 60)、水通道蛋白NIP6-1(aquaporin NIP6-1)、抗冻蛋白(antifreeze protein)等。
| 编号 | 大小 (bp) | 编码可能的蛋白 | 物种 | 一致性 | 序列 ID | e 值 |
| 1-2-11TDF | 365 | GRAS family transcr-iption factor | Medicago truncatula | 29/69(42%) | XP_003598857.1 | 7e-08 |
| 3-3-8TDF | 262 | LysR family transcriptional regulator | Pseudomonas Putida ND6 | 78/83(94%) | YP_006386446.1 | 3e-44 |
| 2-4-12TDF | 355 | Kinase interacting family protein,putative | Theobroma cacao | 50/144(44%) | XP_007034834.1 | 1e-15 |
| 1-5-16TDF | 257 | Heat shock protein 60 | Schistocerca gregaria | 47/78(60%) | AEV89752.1 | 7e-25 |
| 2-6-25TDF | 276 | Aquaporin NIP6-1 | Medicago truncatula | 29/46(63%) | XP_003604211.1 | 2e-09 |
| 1-9-7TDF | 276 | Antifreeze protein | Saussurea involucrata | 31/58(53%) | ABJ97672.1 | 3e-08 |
| 2-12-6TDF | 330 | Putative oxidoreductase | mobilicoccus pelagius | 29/91(32%) | WP009482274.1 | 1.9 |
| 2-6-26TDF | 310 | Ubiquitin-specific protease 26 family protein | Populus trichocarpa | 64/93(69%) | XP_002306642.1 | 9e-37 |
| 1-12-12TDF | 141 | E3 ubiquitin-protein ligase HERC2-like | distachyon | 23/35(66%) | XP_003569713.1 | 5e-06 |
| 4-4-7TDF | 288 | 1-aminocyclopropane-1-car Boxylic acid oxidase,partial | Helianthus annuus | 92/101(91%) | AAC49824.1 | 6e-60 |
| ACC synthase | Orobanche minor | 88/101(87%) | BAF33504.1 | 2e-56 |
盐胁迫通过渗透胁迫、离子毒害、活性氧等多个机制影响植物的生长,是严重影响农业生产的一个非生物胁迫因素[5],但高等植物对盐胁迫的耐受性在一定程度上具有相似的分子机理,很多基因的表达受干旱、盐、低温等非生物逆境胁迫的诱导并在植物抵抗非生物胁迫中发挥作用。cDNA-AFLP技术结合了RT-PCR和AFLP的优点,可用于转录水平上进行胁迫诱导基因表达及其表达规律的研究,并进行大量TDFs的筛选,进而分离特异表达的基因。秘彩莉等[3]利用cDNA-AFLP技术筛选出18个与小麦耐盐性密切相关的片段,并克隆了小麦液泡膜ATPaseC亚基(TaVHA-C)的全长cDNA;陈银华等[4]利用cDNA-AFLP技术筛选了红树植物盐应答基因。本研究利用该技术分析了向日葵在盐胁迫条件下的基因差异表达,回收了600多条 上调差异条带,通过二次PCR扩增及反向Northern blot验证后,最终获得42个阳性片段,多数片段没有获得,可能是由于目的片段在回收过程中的丢失、PCR体系及反应条件的影响、或者是大小相近的几个片段在同一位置重叠或相距很近,电泳未能将其分离及目的片段的假阳性等造成的。从42个阳性片段中选取12个TDFs进行克隆及序列测定与分析,获得10条TDFs序列,长度在100~500bp之间,证实了二次PCR扩增及反向Northern blot验证差异片段的可靠性,所得TDFs序列均与盐胁迫应答蛋白相关。这些TDFs大体分为4类:第1类是在基因表达和信号转导过程中起调节作用的蛋白基因,如GRAS家族转录因子(1-2-11TDF)、LysR家族转录调控因子(3-3-8TDF)和蛋白激酶(2-4-12TDF)。GRAS转录因子是一类植物特有的转录因子,这些转录因子可调控植物体感受干旱、高盐、低温、激素和病原等信号相关基因的表达,在植物抗逆反应中起着重要作用[6]。Czikkel等[7]在烟草中发现了核定位的GRAS基因家族成员NtGRAS1,研究表明该基因可能作为一个重要的转录调节因子参与植物的胁迫反应。马洪双等[8]研究证实了木本植物胡杨GRAS/SCL家族基因PeSCL7在脱水、高盐、低温等逆境胁迫中的抗逆作用。LysR家族转录因子常常受到来自于环境或代谢产生的小分子诱导或阻遏,从而激活或抑制目标基因表达。蛋白激酶在感受外界刺激、参与信号传递及调控转录等不同方面起重要作用。第2类是胁迫相关的功能蛋白基因,如热激蛋白(1-5-16TDF)、抗冻蛋白(1-9-7TDF)、水通道蛋白(2-6-25TDF)和氧化还原酶(2-12-6TDF)。热激蛋白(heat shock protein,Hsp)是指生物体在遭受高温、干旱、渗透、盐害等胁迫刺激后,大量表达或者新合成的一系列蛋白质。根据分子量大小,Hsps分为Hsp100家族、Hsp90家族、Hsp70家族和Hsp60家族[9]。小热激蛋白常作为分子伴侣,在不同的非生物胁迫中,担负协助蛋白折叠、蛋白集装、蛋白转导和降解的功能,维护细胞的动态平衡,保护植物细胞抵御各类胁迫[10]。Coca等[11]研究表明从储存的向日葵种子mRNA中获得的低分子量的热激蛋白Hahsp17.9参与水分胁迫调控,而且可在水分胁迫的向日葵的茎和根中积累,表现出组织特异性[12]。刘大丽等[13]利用差异显示法从碳酸盐逆境胁迫的水稻根中克隆的热激蛋白90基因(rHsp90),过表达明显提高了转基因烟草在盐胁迫下的生长势。抗冻蛋白(antifreeze protein,AFP)最早发现于生活在极地海洋鱼类的血清中[14],该蛋白可以通过吸附至冰晶表面、抑制冰晶生长及冰晶重结晶,从而有效地控制冰晶对细胞的损伤[15]。Worrall 等[16]将从胡萝卜分离到的植物AFP基因导入烟草,检测到36 kDa的多肽表达,其提取物可抑制冰晶的生长。水通道蛋白(aquaporin)是一类广泛存在的功能性跨膜蛋白,通过多种调控方式全程参与植物的盐胁迫应答。在水分运输、维持水分平衡和逆境胁迫下胞内的渗透调控中发挥重要作用。李嵘等[17]通过分析水稻OsPIP2;6在逆境胁迫条件下的表型差异,证实了水通道蛋白在水稻的抗旱、抗水淹和抗盐中发挥了重要作用。还有大量的研究表明水通道蛋白参与非生物胁迫应答[18,19]。氧化还原酶在植物初生代谢与次生代谢中起着重要作用。植物在生长发育代谢过程中会产生活性氧,如超氧负离子、单线态的氧、过氧化氢及羟基自由基。活性氧水平很低不会伤及细胞,活性氧含量过高会对植物造成毒害。正常情况下,植物细胞内活性氧的产生与清除是处于动态平衡的,当植物受到胁迫时,这种动态平衡遭到破坏,导致活性氧大量累积,就会造成细胞多种严重性氧化损伤,如膜脂过氧化、蛋白质损伤、碱基突变和DNA断裂等。研究表明,在环境胁迫条件下,抗氧化酶基因的表达产物能够清除过量的活性氧,保护和稳定蛋白复合体和膜结构,从而提高细胞耐脱水能力,如超氧歧化酶(SOD)、过氧化物酶 (POD)和过氧化氢酶(CAT)等。汤莉等[20]对转入Cu/ZnSOD和APX基因的马铃薯进行耐氧化、耐盐性研究表明转基因马铃薯清除活性氧的能力增强,抗逆性得到提高。第3类是衰老相关蛋白,如ACC氧化酶/ACC合成酶(4-4-7TDF)。ACC氧化酶(ACO)和ACC合成酶(ACS)是乙烯生物合成途径中的两个关键酶。ACO催化ACC转化为乙烯;ACS是催化SAM向ACC转化的限速酶[21]。乙烯作为一种重要的植物激素,参与调控植物生长、发育、成熟、衰老整个生命周期[22,23],并在植物逆境(热害、冷害、旱害、涝害、盐害、紫外线和重金属离子等)胁迫方面发挥着重要的作用[24,25]。ACO和ACS基因的表达是乙烯形成和应答的主要标志,植物ACO和ACS基因对机械损伤、渍水、干旱等逆境胁迫有应答[21]。薛丽君等[26]克隆了苎麻ACC氧化酶基因(BnACO1),研究表明该基因参与ABA、干旱和NaCl胁迫应答。大量研究表明ACC氧化酶基因参与植物的逆境胁迫应答[27,28]。第4类是与蛋白相互作用的蛋白,如泛素特异性蛋白酶26蛋白家族(2-6-26TDF)和E3泛素连接酶(1-12-12TDF),这2个蛋白与泛素降解途径密切相关,研究表明环境条件的剧烈改变会影响泛素体系,干旱、盐、冷和重金属等胁迫均可诱导一些特殊的蛋白酶和泛素的合成[29],Park等[30]从水稻中鉴定出来的RING-finger类型的E3泛素连接酶OsDSG1可依赖于ABA信号途径来调控水稻响应干旱和高盐等逆境胁迫过程。
这些结果将为进一步研究这些TDFs在根、茎、叶等不同器官组织中时间和空间的表达规律及阐明向日葵抗逆分子机制奠定基础。
| [1] | Bachem C W B, Van der Hoeven R S, de Bruijn S M, et al. Visualization of differential gene expression using a novel method of RNA fingerprinting based on AFLP: analysis of gene expression during potato tuber development. The Plant Journal, 1996, 9 (5): 7452-7531. |
| [2] | Yang L, Zheng B S, Mao C Z, et al. cDNA-AFLP analysis of inducible gene expression in rice seminal root tips under a water deficit. Gene, 2003, 314: 141-148. |
| [3] | 秘彩莉, 张学勇, 温小杰, 等. 利用cDNA-AFLP技术获得小麦耐盐性相关基因TaVHA-C. 中国农业科学, 2006, 39(9): 1736-1742. Bei C L, Zhang X Y, Wen X J, et al. Isolation of TaVHA-C, a gene in wheat related to salt-tolerence via cDNA-AFLP. Scientia Agricultura Sinica, 2006, 39(9): 1736-1742. |
| [4] | 陈银华, 韩树梅, 沙爱华, 等. cDNA-AFLP法筛选红树植物盐应答基因.中国农业科学, 2008, 41(12): 4257-4263. Chen Y H, Han S M, Sha A H, et al. Differental analysis of salt response genes by cDNA-AFLP in Mangrove. Scientia Agricultura Sinica, 2008, 41(12): 4257-4263. |
| [5] | 师恭曜,王玉美,华金平.水通道蛋白与高等植物的耐盐性. 中国农业科技导报, 2012, 14(4):31-38. Shi G Y, Wang Y M, Hua J P. Aquaporins and salt tolerance of higher plants. Journal of Agricultural Science and Technology, 2012, 14(4):31-38. |
| [6] | 李桂英,田玉富,杨成君.植物GRAS家族转录因子的研究现状.安徽农业科学, 2014, 42(14): 4207-4210. Li G Y, Tian Y F, Yang C J. Research situation of GRAS family transcription factor in plants. Journal of Anhui Agri Sci, 2014, 42(14): 4207-4210. |
| [7] | Czikkel B E, Maxwell D P. NtGRAS1, a novel stress-induced member of the GRAS family in tobacco, localizes to the nucleus. Journal of Plant Physiology, 2007, 164(9):1220-1230. |
| [8] | 马洪双, 夏新莉, 尹伟龙. 胡杨 SCL7 基因及其启动子片段的克隆与分析. 北京林业大学学报, 2011, 33(1): 1-10. Ma H S, Xia X L, Yin W L. Cloning and analysis of SCL7 gene from Populus euphratica. Journal of Beijing Forestry University. 2011, 33(1): 1-10. |
| [9] | 郭虹霞,王创云,赵丽, 等.小分子热激蛋白的研究进展.山西农业科学, 2013, 41(12): 1421-1423. Guo H X, Wang C Y, Zhao L, et al. Research progress of small heat shock protein. Journal of Agricultural Sciences. 2013, 41(12): 1421-1423. |
| [10] | Wang W, Vinocur B, Shoseyov O, et al. Role of plant heat-shock proteins and molecular chaperones in the abiotic stress response. Trends in Plant Science, 2004, 9: 244-252. |
| [11] | Coca M A, Almoguera C, Jordano J. Expression of sunflower lower-molecular-weight heat-shock proteins during embryogenesis and persistence after germination: localization and possible functional implications. Plant Molecular Biology,1994, 25(3): 479-492. |
| [12] | Almoguera C, Coca M A, Jordano J. Tissue-specific expression of sunflower heat shock proteins in response to water stress. Plant Journal, 1993,4(6): 947-958. |
| [13] | 刘大丽, 张欣欣, 程玉祥, 等. 逆境下水稻(Dryza sative L.) rHSP90 基因的克隆及功能分析. 分子植物育种, 2006, 4(3): 317-322. Liu D L, Zhang X X, Cheng Y X, et al. Cloning and characterization of the Rhsp90 genes in rice(Dryza sative L.)under environment stress. Molecular Breeding, 2006, 4(3): 317-322. |
| [14] | DeVries A L,Wohlschlag D E. Freeze resistance in some Antarctic fishes. Science, 1969, 163:1073-1075. |
| [15] | 李文柯, 马春森. 抗冻蛋白特征、作用机理与预测新进展. 生命科学, 2012, 24(10):1089-1097. LI W K, MA C S. Present properties,mechanise and prediction of antifreeze proteins. Chinese Bulletin of Life Sciences. 2012, 24(10): 1089-1097. |
| [16] | Worrall D, Elias L, Ashford D, et al. A carrot leucine-rich-repeat protein that inhibits ice recrystallization. Science, 1998, 282 (5386):115-117. |
| [17] | 李荣, 牛向丽, 苗雁文,等. 水通道蛋白基因 OsPIP2;6 的功能分析.中国农业科学, 2013, 46(15): 3079-3086. Li Y, Niu X L, Miao Y W, et al. Functional characterization of the plasma intrinsic protein gene OsPIP2;6 in rice. Scientia Agricultura Sinica, 2013, 46(15): 3079-3086. |
| [18] | Przedpelska-Wasowicz E M, Wierzbicka M. Gating of aquaporins by heavy metals in Allium cepa L. epidermal cells. Protoplasma, 2010, 248(4): 663-671. |
| [19] | Vera-Estrella R, Barkla B J, Bohnert H J, et al. Novel regulation of aquaporins during osmotic stress. Plant Physiology, 2004, 135(4): 2318-2329. |
| [20] | 汤莉, 汤晖, Sang-Soo K, 等. 转铜/锌超氧化物歧化酶和抗坏血酸过氧化物酶基因马铃薯的耐氧化和耐盐性研究. 中国生物工程杂志, 2008, 28(3): 25-31. Tang L, Tang H, Sang-Soo K, et al. Improving potato plants oxidative stress and salt tolerance by gene transfer both of Cu/Zn superoxide dismutase and ascorbate peroxidase. China Biotechnology, 2008, 28(3): 25-31. |
| [21] | 王爱勤,王自章,杨丽涛,等.乙烯生物合成途径中的两个关键酶基因的研究进展.广西农业生物科学, 2004,23(2):164-169. Wang A Q, Wang Z Z, Yang L T, et al. Research progress of two key enzyme genes on the ethylene biosynthesis. Journal of Guangxi Agric and Biol Science, 2004,23(2):164-169. |
| [22] | 陈银华, 黄伟, 王海. ACC氧化酶基因研究进展. 海南大学学报:自然科学版, 2006, 24(2): 194-200. Cheng Y H, Huang W, Wang H. Review on researching advance in ACC oxidase genes. Natural Science Journal of Hainan University, 2006, 24(2): 194-200. |
| [23] | 刘进平. 乙烯生物合成关键酶基因研究进展. 热带农业科学, 2013, 33(1): 51-57. Liu J P. Advances in research on key enzyme gengs of ethylene biosynthesis. Chinese Journal of Tropical Agriculture, 2013, 33(1): 51-57. |
| [24] | Choudhury S R, Roy S, Sengupta D N. Characterization of transcriptional profiles of MA-ACS1 and MA-ACO1 genes in response to ethylene, auxin, wounding,cold and different photoperiods during ripening in banana fruit. Journal of Plant Physiology, 2008, 165(18): 1865-1878. |
| [25] | 李明亮, 韩一凡. 乙烯在植物生长发育和抗病反应中的作用及其生物合成的反义抑制. 林业科学, 2000, 36(4): 77-84. Li M L, Han Y F. Efeect of ethylene on the growth and development of plants and inhibition of its biosynthesis by antisense RNA. Scientia Silvae Sinicae, 2000,36(4): 77-84. |
| [26] | 薛丽君, 周精华, 邢虎成. 苎麻ACC氧化酶基因( BnACO1 )的克隆及表达研究. 中国农业科学, 2013, 46(11): 2377-2385. Xue L J, Zhou J H, Xing H C. Cloning and characterization of ACC oxidase gene( BnACO1 ) from rame (Boehmeria nivea). Scientia Agricultura Scienca, 2013, 46(11): 2377-2385. |
| [27] | Jiang Y Q, Deyholos M K. Comprehensive transcriptional profiling of NaCl-stressed arabidopsis roots reveals classes of responsive genes. BMC Plant Biology, 2006, 6(25):1-20. |
| [28] | CaoW H, Liu J, Zhou Q Y, et al. Expression of tobacco ethylene receptor NTHK1 alters plantresponses to salt stress. Plant, Cell and Environment, 2006, (29): 1210-1219. |
| [29] | 董发才, 宋纯鹏. 植物细胞中的泛素及其生理功能. 植物生理学通讯, 35(1):54-59. Dong F C, Song C P. The ubiquitin and its physiological functions in plants. Plant Physiology Communications, 35(1): 54-59. |
| [30] | Park G G, Park J J, Yoon J M, et al. A RING finger E3 ligase gene, Oryza sative delayed seed germination 1( OsDSG1 ), controls seed germination and stress responses in rice. Plant Mol Biol, 2010, 74(4-5): 467-478. |
 2015, Vol. 35
2015, Vol. 35




