文章信息
- 艾君, 姜潮, 刘敏, 王晓艳, 田海山, 李校堃
- AI Jun, JIANG Chao, LIU Min, WANG Xiao-yan, TIAN Hai-shan, LI Xiao-kun
- 拟南芥双油体蛋白融合表达KGF-2及其生物学活性研究
- Two Oleosins Flanking the KGF-2 Improve the Expression Level of KGF-2 in Arabidopsis thaliana and Its Activity Analysis
- 中国生物工程杂志, 2015, 35(1): 21-26
- China Biotechnology, 2015, 35(1): 21-26
- http://dx.doi.org/10.13523/j.cb.20150103
-
文章历史
- 收稿日期:2014-10-19
- 修回日期:2014-10-31
2. 吉林农业大学生物反应器与药物开发教育部工程研究中心 长春 130118
2. Engineering Research Center of Bioreactor and Pharmaceutical Development, Ministry of Education, Changchun 130118, China
角质形成细胞生长因子-2 (keratinoeyte growth factor-2,KGF-2),又称为成纤维细胞生长因子-10 (fibroblast growth factors-10,FGF-10),是FGFs家族的一员,由208个氨基酸组成,分子质量约为24kDa,其N端有约40个氨基酸残基的信号肽序列,氨基酸序列有57%与KGF-1同源[1],KGF-2能与表达于上皮细胞表面的两种酪氨酸激酶受体相结合,分别以高亲和力和低亲和力与上皮细胞表面酪氨酸激酶受体FGFR2Ⅲb和FGFR1Ⅲb相结合,通过间质-上皮相互作用的旁分泌方式发挥作用,刺激损伤组织周围上皮细胞的再生、分化和迁移,可以减轻伤口愈合反应[2,3,4]。对角膜修复,以及辐射对正常组织和胃肠道黏膜造成的损伤也具有一定作用[5]。 Human Genome Sciences公司 (HGS) 开发研究的KGF-2静脉注射制剂用于治疗慢性静脉溃疡以及癌症引起的黏膜炎溃疡性大肠炎已经完成了Ⅱ期临床试验。另外,KGF-2及其受体在毗邻外根鞘角质细胞的真皮乳头成纤维细胞中表达,MTS细胞实验证明,KGF-2能显著刺激人的毛囊增殖,显示对治疗脱发也有良好的效果[6,7]。
油体作为植物种子的储油细胞器,通常在子叶、胚乳或盾片中积累,为种子的萌发和植株的早期生长提供能量[8]。将外源蛋白编码基因插入油体蛋白oleosin基因的5′端或3′端,构建 “oleosin-目的蛋白”表达载体,转化拟南芥、红花、油菜等油料作物,可使外源蛋白以融合蛋白的形式在植物种子中表达,有利于目的蛋白的稳定与富集[9]。该表达体系中,重组蛋白的累积水平以及重组蛋白在油体中的稳定性是决定最终产量的因素,也是该表达技术进一步发展的关键问题。Scott等[10]的研究表明,多油体蛋白可以增加吸胀后种子的耐冻性及乳化稳定性和油体结构的完整性,Banilas等[11]在2011年也发现2个或3个oleosin分子连接GFP分子(oleosin-oleosin-GFP,oleosin-oleosin-oleosin-GFP),尤其是GFP位于两个oleosin分子之间(oleosin-GFP-oleosin)优于单油体(single-oleosin)可以提高GFP的表达量,而且这种结构不会影响植物活力和生理学或油体稳定,有利于植物生物技术更好的商业化。
本实验欲运用拟南芥双油体融合表达技术表达成熟的KGF-2蛋白,希望能够获得较高表达量的具有生物学活性的KGF-2融合蛋白,为植物表达药用重组蛋白提供新的思路。 1 材料与方法 1.1 材 料
单油体表达载体p1301-YO-K2及转基因植株T2代line 1、line 3、line 7种子,E. coli DH5α菌种,农杆菌EH105菌种BaF3细胞均为本实验室保存。 CTAB法植物基因组提取试剂盒购自百泰克公司,Ex-Taq酶、限制性内切核酸酶、DNA Marker、DNA连接试剂盒均购自TaKaRa宝生物工程(大连)有限公司,高纯质粒小量制备试剂盒琼脂糖凝胶、DNA回收试剂盒购自Omega公司,DNA连接试剂盒购自Promega公司,PVDF膜购自Bio-Rad,KGF-2多克隆抗体、辣根过氧化物酶标记的羊抗兔抗体购自Santa Cruz 公司,细胞培养基均购自Gibco公司,ECL显色试剂盒、苏木素伊红染色液购自碧云天生物技术研究所,引物由Invitrogen公司合成。 1.2 方 法 1.2.1 目的基因的扩增
以单油体表达载体P1301-YO-K2为模板,首先以引物OleF和OleR扩增出拟南芥油体蛋白oleosin基因,以引物K2F和K2R扩增出KGF-2核心区目的基因,其中K2R和OleF包含两个目的基因的部分碱基(表 1)。PCR反应程序为:94℃预变性5min;94℃变性30s,55℃退火30s,72℃延伸1min,30个循环;72℃延伸10min。然后以引物K2F和OleR扩增出KGF-2-oleosin融合基因,引物K2F和OleR分别包含酶切位点NcoI和HindIII。反应总体系为:ExTaq 0.25μl,引物K2F和OleR各0.5μl,模板1(oleosin扩增产物)1μl,模板2(KGF-2扩增产物)1μl,10 × Buffer 5μl,dNTP Mix 4μl,ddH2O 38. 25μl。反应程序为: 94℃预变性5min;94℃变性30s,55℃退火30s,72℃延伸90s,30个循环;72℃延伸10min。进行TA克隆,将融合基因连接T载体,并转化E. coli DH5α。
| 目的基因 | 引物名称 | 引物序列 |
| 角质细胞生长因子-2(KGF-2) | K2F | CATGCCATGGCACTTGGACAAGACATGGTATCGCC |
| K2R | CCTCTAGCTGTATCCGCAGAATGTACTACCATTG | |
| 拟南芥油体蛋白(A-oleosin) | OleF | CCATGGCACTTGGACAAGACATGGTATCGCC |
| OleR | CCCAAGCTTAAGTAGTGTGCTGGCCACCACGAGTACGGT | |
| Note: Underlined are restriction enzyme cutting site | ||
将质粒p1301-YO-K2及融合基因的T载体分别用NcoI和HindIII酶切,经1% 琼脂糖凝胶电泳及DNA回收试剂盒回收纯化后,得到p1301-YO大片段和KGF-2-oleosin小片段,用T4 DNA Ligase 16℃过夜连接,连接产物采用热激法转化E. coli DH5α。提取质粒后对重组表达质粒进行酶切鉴定和序列分析,获得阳性克隆,将质粒命名为p1301-YO-K2-YO (图 1)。
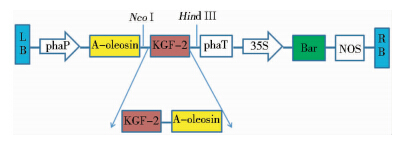
|
| 图 1 植物表达载体p1301-YO-K2-YO的构建-1抗体效价 Fig. 1 Construction of plant binary expression vector p1301-YO-K2-YO |
将得到的植物双元质粒采用冻融法转化农杆菌EHA105,对农杆菌进行PCR鉴定,阳性菌液通过花浸染法转化拟南芥。首先选择长势良好的花苞期拟南芥,在加有表面活性剂silwet-77的农杆菌5% 蔗糖[12]混悬液中浸染30~60s后保湿24h,取下保鲜袋室温放置1个月,植株成熟后在样品收集袋中干燥收集T1种子后播种,待其长出4片真叶时喷洒0.1% 的草甘膦溶液(BASTA),每隔2天喷洒一次,共喷洒4次进行筛选 [13],将阳性植株移栽到新的土中,使其正常生长。 1.2.4 PCR鉴定
取抗性植株新鲜叶片100mg,用新型快速植物基因组DNA提取试剂盒提取总DNA,以未转基因的新鲜叶片作为阴性对照。PCR扩增目的基因,反应总体系如下: 2×rTaq PCR MasterMix 10μl,引物K2F和OleR各0.5μl,模板1μl,ddH2O 8μl。PCR反应程序为: 94℃预变性5min;94℃变性30s,55℃退火30s,72℃延伸90s,30个循环;72℃延伸10min。PCR扩增产物经1%核酸琼脂糖凝胶电泳检测。 1.2.5 SDS-PAGE,Western blot分析
取100 颗T2代转基因拟南芥种子加入100μl 50mmol/L Tris-HCl (pH=8.0) 缓冲液研磨粉碎,加入25μl蛋白质样品缓冲液(5×),沸水浴处理样品 10min,12 000r/min离心10min,吸取中间清液进行 SDS-PAGE 检测。SDS-PAGE 电泳结束后,分别进行考马斯亮蓝染色和转膜。将胶上的蛋白质转移到PVDF膜上,在封闭液中封闭2h,将膜放入KGF-2多克隆抗体稀释液(1∶750),4℃摇床孵育过夜,用TBST在室温洗3次,每次10min ;二抗(1∶8 000稀释)室温孵育1h,洗膜3次,曝光。 1.2.6 KGF-2融合蛋白生物学活性测定
T2代种子经扩大种植及进一步筛选获得纯合子的T3代种子,作为动物实验用材料,取15只近交系C57BL/6小鼠编号,采用随机排列法分为野生型油体给药组、单油体给药组(YO-K2组)、双油体给药组(YO-K2-YO组),每组5只。小鼠经水合氯醛麻醉后剃毛,将脱毛膏涂于背部去毛,以小鼠背部光滑、无伤、无毛根为净,诱导毛发由休止期进入生长期[14]。每日提取20mg种子的总蛋白质涂抹于脱毛部位,观察小鼠毛发生长情况,记录小鼠脱毛区皮肤变黑色灰色的时间,数据采用SPSS15.0系统软件进行独立样本t检验。第12天观察小鼠毛发生长情况,并处死小鼠,取相同位置背部皮肤多聚甲醛固定,石蜡包埋切片后苏木素伊红染色,观察毛囊生长情况。 2 结 果 2.1 融合目的基因的获得
PCR扩增产物进行琼脂糖凝胶电泳,可见油体蛋白oleosin基因在762bp左右出现明显条带,KGF-2基因在513bp左右可见明显条带,将其融合后可得KGF-2-oleosin融合目的基因,大小约为1 272bp(图 2),与预计条带大小一致。
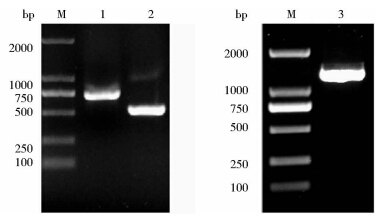
|
| 图 2 PCR扩增A-oleisin、KGF-2、KGF-2-oleosin基因 Fig. 2 PCR product of A-oleisin、KGF-2、KGF-2-oleosin gene M: DL2000 marker; 1: A-oleisin gene; 2: KGF-2 gene; 3: KGF-2-oleosin fused gene |
将融合基因KGF-2-oleosin与表达载体p1301-YO连接后,获得p1301-YO-K2-YO质粒,用NcoI和HindIII进行双酶切鉴定(图 3),证明载体构建成功,转入农杆菌后进行PCR证明目的基因已经成功转入农杆菌。
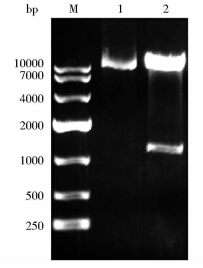
|
| 图 3 p1301-YO-K2-YO双酶切鉴定 Fig. 3 Identification of recombinant Plasmid p1301-YO-K2-YO M: DL 10000 DNA Marker; 1: p1301-YO-K2-YO plasmid; 2: p1301-YO-K2-YO digested by NcoI / HindIII |
根据载体上所带的BAR基因,将浸染后收获的种子播种后对其幼苗进行草甘膦筛选,在间隔喷洒4次0.1%的BASTA后,部分阳性植株仍然正常生长,非转基因植株逐渐枯萎变黄。选取阳性植株叶片提取基因组进行PCR检测,结果显示,PCR扩增获得了大小约为1 272bp的KGF-2-oleosin片段(图 4),与预期结果一致。说明目的基因已经整合到拟南芥基因组中,而阴性植株未扩增出目的基因片段。有些阳性植株未扩出的原因可能是植株转基因过程中筛选不充分,出现了假阳性。
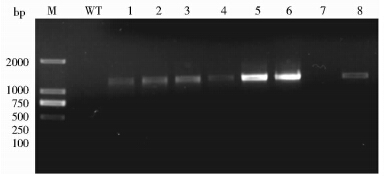
|
| 图 4 转基因植株的 PCR 检测图 Fig. 4 PCR detection of the gene in transformed plants M: DL2000 marker; WT: Non-transgenic plant; 1~8:T2 transgenic plant line 1~8 |
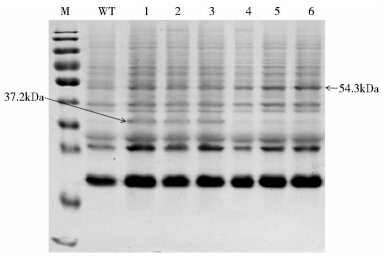
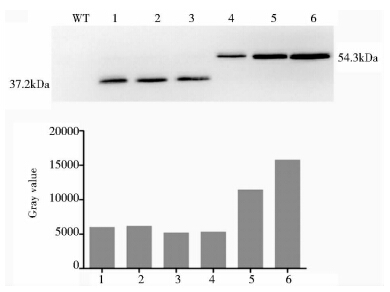
PCR鉴定为阳性的T1代拟南芥种子总蛋白质SDS-PAGE结果(图 5)显示,oleosin-KGF-2-oleosin转基因拟南芥相比于野生型拟南芥在 53.9kDa左右有1条很明显的目的条带,oleosin-KGF-2转基因拟南芥相比于野生型拟南芥在32.7kDa左右出现明显条带,与预计的融合蛋白条带大小一致。Western blot结果显示,oleosin-KGF-2-oleosin转基因拟南芥和oleosin-KGF-2转基因拟南芥分别在53.9kDa左右和32.7kDa左右出现特异性条带,而野生型拟南芥种子没有特异性条带出现,说明KGF-2蛋白已在转基因拟南芥中实现表达。用quantity one 软件对Western blot结果进行灰度分析,结果显示,KGF-2蛋白在双油体载体中的表达量明显高于单油体表达载体,其中双油体表达载体的line 6株系明显高于单油体的所有株系,其KGF-2表达量约为单油体表达载体的2.5倍(图 6)。
|
| 图 5 转基因拟南芥种子总蛋白质SDS-PAGE 检测 Fig. 5 SDS-PAGE analysis of total protein extracted from transgenic Arabidopsis seeds M: Protein molecμlar weight marker (15~170kDa); WT: Non-transgenic plant; 1~3: p1301-YO-K2 transgenic plant line1,3,7; 4~6:P1301-YO-K2-YO transgenic plant line3,5,6 |
|
| 图 6 转基因拟南芥种子总蛋白质Western blot分析及灰度分析 Fig. 6 Western blot analysis of total protein extracted from transformed Arabidopsis seeds and the gray value analysis WT: Non-transgenic plant; 1~3: p1301-YO-K2 transgenic plant line1,3,7; 4~6:P1301-YO-K2-YO transgenic plant line3,5,6 |
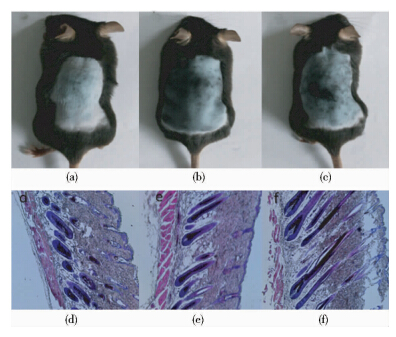
C57BL/6小鼠皮肤的黑素细胞只存在于毛囊中,而且仅在生长期合成黑色素,使皮肤变成黑色,退行期皮肤变成灰色,休止期皮肤变成粉红色,可根据皮肤颜色大致判断毛发生长周期情况[15]。由表 2 可知,油体融合KGF-2使皮肤毛囊从休止期进入生长期的时间缩短,并且在第19天左右进入退行期,延长了小鼠毛囊生长期,双油体给药组与单油体给药组、野生油体组相比具有显著性差异。给药第12天,在200倍光学显微镜下观察HE染色,结果显示单油体给药组(图 7b)和双油体给药组(图 7c)背部皮肤已经长出毛发,野生型油体组(图 7a)皮肤颜色发黑但是无毛发长出,背部皮肤切片染色结果显示,野生油体对照组毛囊处于新生状态(图 7a),单油体融合蛋白组(图 7e)和双油体融合蛋白组(图 7f)小鼠毛囊已经趋于成熟。
| 组别 | 背部皮肤 变黑时间 | 背部皮肤 变灰时间 | 背部皮肤黑色 持续时间 |
| 野生油体组 | 9.95 | 17.29 | 7.34 |
| YO-K2组 | 8.84 * | 18.64 * | 9.57 * |
| YO-K2-YO组 | 8.36 * | 19.71 *# | 11.35 *# |
| * Compared with the Non-transgenic plant group,P<0.05; # Compared with the YO-K2 group,P<0.05 | |||
|
| 图 7 脱毛后第12天小鼠毛囊生长状态比较 Fig. 7 Comparison of hair follicles in mice on the twentieth day after hair removal (a) Mice in non-transgenic plant group (b) Mice in P1301-YO-K2 group (c) Mice in P1301-YO-K2-YO group (d) Hair follicles (non-transgenic plant group),200XH&E staining (e) Hair follicles(P1301-YO-K2 group),200XH&E staining (f) Hair follicles(p1301-YO-K2 -YO group),200XH&E staining |
本研究将oleosin-KGF2-oleosin融合基因整合到拟南芥基因组中并实现表达,Western blot结果证明双油体表达系统可以使双油体转基因拟南芥中KGF-2的表达量达到单油体转基因拟南芥的2.5倍。促小鼠毛囊生长实验证明,该途径表达的融合蛋白具有良好的生物学活性,油体融合KGF-2蛋白组小鼠毛发生长期明显比非转基因组延长,双油体蛋白组由于在相同质量种子中表达的KGF-2含量更高,生长期持续时间较单油体蛋白组延长;小鼠背部皮肤HE染色结果显示,单油体和双油体转基因拟南芥组小鼠毛囊数目及毛囊状态均优于野生拟南芥组,且双油体KGF-2组小鼠毛囊生长状态明显优于单油体KGF-2组。
外源蛋白在转基因植物中的表达量低,是一个普遍存在而又亟待解决的问题,提高外源蛋白表达量是提高植物生物反应器生产重组蛋白竞争力的重要途径。本研究中表达载体采用的菜豆启动子(PhaP)属于种子特异型启动子,采用合适的种子特异型启动子在基因转录水平提高了表达效率,而设计双油体表达载体是在利用融合方式实现种子定位表达的基础上,使外源蛋白稳定性提高,得到更大程度的富集,两者相结合可使油体系统中的外源蛋白表达量进一步提高。将KGF-2基因插入两个油体蛋白基因之间转化拟南芥,获得高表达且具有生物学活性的拟南芥植株,为植物油体表达系统生产药用蛋白质提出新的思路,商业化前景优于单一油体蛋白基因与目的基因融合的表达策略,是转基因技术的一次大的改进和提升。油体本身作为天然磷脂,可以携带大分子蛋白质药物通过角质屏障,增加透皮吸收的效率,不影响成药性及安全性;油体表达系统的转基因种子只需经过简单的粉碎-抽提-离心,即可将融合蛋白与种子其他组分分开,简化了纯化步骤,使下游纯化成本大大降低,种子易于储藏和运输,避免了蛋白质药物储藏和运输过程中的低温要求。如果将这种双油体蛋白表达策略推广,可以提高更多药用蛋白质的表达量,对实现整体植株生产重组蛋白具有重大意义。
| [1] | Emoto H,Tagashira S,Mattei M G,et al. Structure and expression of human fibroblast growth factor-10.J Biol Chem,1997,272(37):23191-23194. |
| [2] | Igarashi M,Finch P W,Aaronson S A. Characterization of recombinant human fibroblast growth factor (FGF)-10 reveals functional similarities with keratinocyte growth factor (FGF-7). Biol Chem, 1998, 273(21):13230-13235. |
| [3] | Lu W,Luo Y, Kan M,et al. Fibroblast growth factor-10 a second candidate stromal to epithelial cell andromedin in prostate. Biol Chem, 1999, 274(18):12827-12834. |
| [4] | Smith P D, Polo M,Soler P M,et al. Efficacy of growth factors in the accelerated closure of interstices in explanted meshed human skin grafts. J Burn Care Rehabil,2000,21(1):5-9. |
| [5] | Alderson R,Gohari-Fritsch S,Olsen H,et al. In vitro and in vivo effects of repifermin (keratinocyte growth factor-2,KGF-2) on human carcinoma cells. Cancer Chemother Pharmacol,2000,50(3):202. |
| [6] | Jang J H. Stimulation of human hair growth by the recombinant human keratinocyte growth factor-2 (KGF-2). Biotechnology Letters,2005,27(11):749-752. |
| [7] | Jang H J,Kim S. Therapeutic uses of keratinocyte growth factor-2: WO,PCT/KR2001/001787,2002. |
| [8] | Huang A H. Oleosin and oil bodies in seeds and other organs. Plant Physiology,1996,110(4):1055-1061. |
| [9] | 刘昱辉,贾士荣. 植物油体表达体系的研究进展. 农业生物技术学报,2003,11(5):531-537. Liu Y H,Jia S R. Progress in the establishment of a plant seed oil body expression system. Journal of Agricultural Biotechnology,2003,11 (5):531-537. |
| [10] | Scott R W,Winichayakul S,Roldan M,et al. Elevation of oil body integrity and emulsion stability by polyoleosins,multiple oleosin units joined in tandem head-to-tail fusions. Plant Biotechnology Journal,2010,8(8):912-927. |
| [11] | Banilas G,Daras G,Rigas S,et al. Oleosin di-or tri-meric fusions with GFP undergo correct targeting and provide advantages for recombinant protein production. Plant Physiology and Biochemistry,2011,49(2):216-222. |
| [12] | Zhang X,Henriques R,et al. Agrobacterium-mediated transformation of Arabidopsis thaliana using the floral dip method. Nat Protoc, 2006,1(2):641-646. |
| [13] | Logemann E,Birkenbihl R P,Ulker B,et al. An improved method for preparing agrobacterium cells that simplifies the Arabidopsis transformation protocol. Plant Methods,2006,2(1):16. |
| [14] | 朱小静,姜潮,薛萍,等. 重组角质细胞生长因子-1在杆状病毒表达系统中的表达及其生物活性研究.中国生物工程杂志,2013,33(3):47-53. Zhu X J,Jiang C,Xue P,et al. Expression and purification of biological-active recombinant human keratinocyte growth factor-1 base on baculovirus expression vector system. China Biotechnology,2013,33(3):47-53. |
| [15] | McElwee K J,Sinclair R. Hair physiology and its disorders.Drug Dis Today: Dis Mechan,2008,5(2):163-171.. |
 2015, Vol. 35
2015, Vol. 35




