扩展功能
文章信息
- 岳锡宏, 史深, 袁江玲, 安冉, 徐佳丽, 赵国玉, 艾山·艾比布勒, 艾山江·哈得尔, 杨洪彩, 夏连续, 张渝疆
- YUE Xi-hong, SHI Shen, YUAN Jiang-ling, AN Ran, XU Jia-li, ZHAO Guo-yu, AI Shan-aibibule, AISHAN Jiang-hadeer, YANG Hong-cai, XIA Lian-xu, ZHANG Yu-jiang
- 基于不同媒介效能模型的簇鬃客蚤鼠疫媒介效能评价研究
- Plague transmission efficiency of Xenopsylla skrjabini based on the vector efficiency evaluation models
- 中国媒介生物学及控制杂志, 2021, 32(5): 564-569
- Chin J Vector Biol & Control, 2021, 32(5): 564-569
- 10.11853/j.issn.1003.8280.2021.05.011
-
文章历史
- 收稿日期: 2021-04-26
2 中国疾病预防控制中心传染病预防控制所, 北京 102206
2 National Institute of Communicable Disease Control and Prevention, Chinese Center for Disease Control and Prevention, Beijing 102206, China
鼠疫是一种自然疫源性疾病,广泛存在于特定的自然环境中。鼠疫耶尔森菌(鼠疫菌)与能够携带和传播鼠疫菌的宿主动物(主要是啮齿动物)、能够传播鼠疫菌的媒介昆虫(主要是寄生在啮齿动物体表的蚤类)和与其赖以生存的自然环境构成鼠疫自然疫源地。世界各地的鼠疫自然疫源地因其地理环境的差异,及其宿主动物、媒介昆虫和鼠疫菌的不同而呈现丰富的多样性[1],中国目前发现存在12类不同类型的鼠疫自然疫源地[2]。其中,准噶尔盆地大沙鼠(Rhombomys opimus)鼠疫自然疫源地是2005年在中国新疆维吾尔自治区(新疆)准噶尔盆地发现的新型鼠疫自然疫源地,并已确定大沙鼠是主要宿主动物[3-4],簇鬃客蚤(Xenopsylla skrjabini)是主要鼠疫媒介蚤类,并可高效传播鼠疫[5-6]。但从鼠疫流行病学角度来看,簇鬃客蚤的鼠疫媒介效能相对于其他类型鼠疫疫源地主要媒介蚤的表现尚缺乏相应的实验研究数据,无从比较。为此,作者通过开展生物学实验研究揭示簇鬃客蚤传播鼠疫的动态过程,尤其是在自然生态模式[7]下表现出更高效传播鼠疫的能力[6]。本文以国内和国际较为流行的Wheeler(1954)和Kartman(1956)模型[8]及Macdonald修正的媒介传播疾病动力学标准流行病学模型为切入点[9-10],研究簇鬃客蚤的鼠疫媒介效能,并深入探讨媒介效能实验方法与动物实验模型的适用性,为完善和建立相对合理的媒介效能实验技术体系[11-12]、为制定适宜的鼠疫防控措施提供基础理论和技术支撑。
1 材料与方法 1.1 实验方法簇鬃客蚤为本实验室捕获于准噶尔盆地大沙鼠鼠疫自然疫源地,并在实验室繁殖饲养10代以上新羽化48 h的蚤。实验动物BALC小鼠和豚鼠购自新疆实验动物研究中心。
簇鬃客蚤感染血源为无菌脱纤维大沙鼠血液,人工饲血装置为作者等发明的人工饲血装置(专利号:ZL201210207401.5)。
单传实验采用蚤饱血后,每24 h单只用套筒固定于1只BLAC小鼠(体质量20 g)腹部吸血4 h,每日更换小鼠1只,直至蚤死亡终止实验;集传实验使用蚤数量以准噶尔鼠疫现场调查获取的大沙鼠簇鬃客蚤体蚤指数为参考[3],确定为每组5只感染蚤。具体实验方法参照文献[6]。
1.2 媒介效能计算(1)根据Wheeler(1954)和Kartman(1956)模型[8]计算簇鬃客蚤的媒介效能。

|
(2)根据Macdonald修正的媒介传播疾病动力学标准流行病学模型[10]计算簇鬃客蚤的媒介效能。

|
式中,m为宿主体外寄生蚤指数,a为未感染蚤日叮咬频率,b为蚤栓塞概率,pn为栓塞蚤存活概率;1/r为宿主达到菌血症浓度的存活天数。
1.3 数据分析数据处理和统计采用SPSS 13.0软件,线性回归分析用SAS 9.3软件。
2 结果 2.1 不同感染浓度和频次下簇鬃客蚤对鼠疫菌的感染力和感染蚤存活力1.0×108、1.0×109、2.0×109、5.0×109、8.0×109和1.0×1010 cfu/ml 6个菌血浓度饲喂簇鬃客蚤2 h后的饱血蚤鼠疫菌培养阳性率分别为16.7%、40.6%、43.3%、51.0%、64.3%和75.0%,结果呈线性正相关(R2=0.89,P < 0.01)。
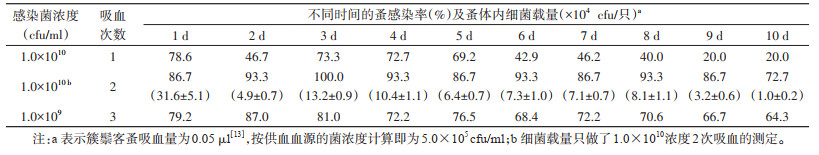
分别以菌血浓度1.0×109 cfu/ml饲血3次、1.0×1010 cfu/ml饲血1和2次的方式饲喂簇鬃客蚤,不同时间段的蚤感染率和蚤体内鼠疫菌载量见表 1。
|
由表 1可见,簇鬃客蚤感染率在较高菌血浓度(1.0×1010 cfu/ml)下,初始感染率2次吸血与1次吸血分别为86.7%和78.6%,差异无统计学意义(Fisher检验,P=0.465),但感染率衰减前者显著慢于后者,感染后24 h未出现如1次吸血的显著下降,二者分别为93.3%和46.7%;在较低菌血浓度(1.0×109 cfu/ml)条件下,3次吸血增加可显著升高初始感染率,由40.6%升高至79.2%,且其后的感染率衰减趋势基本与高菌血浓度(1.0×1010 cfu/ml)2次吸血一致;在1.0×1010 cfu/ml浓度下,簇鬃客蚤感染后的细菌代谢第1天为3.16×105 cfu/只,该菌量与簇鬃客蚤吸入菌量相当,其后呈下降-上升-再缓慢下降趋势。
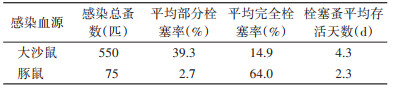
2.2 不同血源簇鬃客蚤菌栓形成力与菌栓蚤存活力以大沙鼠血液为供血血源,用1.0×1010 cfu/ml菌血浓度感染簇鬃客蚤后,簇鬃客蚤菌栓形成经历无菌栓-部分菌栓-完全菌栓3个阶段,最长存活天数为14 d;部分菌栓形成于感染后的第2天,高峰期为第4天,最大部分栓塞率为81.6%。完全栓塞发生滞后于部分栓塞,最早在感染后的第3天形成,高峰期为第5天,最大完全栓塞率为38.0%。栓塞形成平均天数在感染后的第7.4天。以豚鼠血液为血源的感染簇鬃客蚤菌栓形成和存活力不同于大沙鼠血源。簇鬃客蚤吸食豚鼠菌血后,在第1天即可形成完全菌栓,第2天则可全部形成完全栓塞,形成率达100%。部分栓塞情况则在感染后的第3天由部分完全栓塞蚤消化血液后形成,仅为7.7%,显著低于以大沙鼠血液为供血血源,且以豚鼠血液为供血血源的栓塞蚤存活时间仅为大沙鼠血源的53.5%,为2.3 d。见表 2。
|
以大沙鼠血液为供血血源,菌血浓度为1.0×109 cfu/ml,采用人工饲血装置2次饲血方式感染簇鬃客蚤,测试感染蚤对BLAC小鼠单传和集传鼠疫菌传播能力。
单传感染蚤21匹(组)共计传染小鼠262只,传染阳性小鼠7只,传染阳性小鼠时间分布为7~18 d,其中7~13 d传染阳性小鼠6只。见表 3。

|
集传实验以准噶尔鼠疫调查获得的大沙鼠体蚤指数为参考[3],按5匹感染蚤为一组测定传播效能,共计60匹感染蚤分12个实验组,每组5匹,共计传染小鼠73只,传染阳性小鼠4只,总阳性率为5.5%。12个实验组中3组传染阳性,共计传染小鼠19只,传鼠阳性率为21.1%。蚤传染阳性小鼠时间分布为2~6 d。
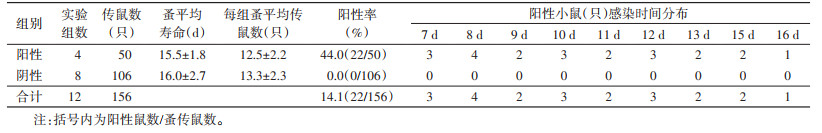
2.3.2 自然宿主感染模式用2.0×1010cfu/ml菌液感染大沙鼠,获17只感染阳性鼠。17只感染鼠共感染簇鬃客蚤17组,其中15组感染蚤培养阳性。15组阳性组共计检验蚤390匹,其中检验阳性蚤325匹,阳性组平均阳性率为(83.3±11.3)%。感染蚤单匹叮咬BLAC小鼠,共计12组(蚤)传染小鼠156只,阳性22只,总阳性率为14.1%。其中4组传染小鼠阳性,组阳性率为33.3%。感染阳性小鼠的时间分布为感染蚤吸血后的第7~16天。见表 4。
|
根据Wheeler(1954)和Kartman(1956)的媒介效能计算公式,簇鬃客蚤的感染潜能、栓塞潜能和传播潜能分别为0.8、0.5和0.1,媒介效能为0.02(其中,感染潜能按照本文媒介感染实验菌浓度1.0×1010 cfu/ml蚤感染阳性率计算;栓塞潜能为部分栓塞率与完全栓塞率之和;传播潜能按照本文5匹集传实验传染阳性率5.5%计算)。
以Macdonald修正的媒介传播流行病学模型公式计算,该蚤的媒介效能为3.2(其中,宿主体外寄生蚤密度按照参考文献[3]中大沙鼠簇鬃客蚤指数4.3计算;未感染蚤日叮咬频率根据参考文献[13]中簇鬃客蚤血液消化周期计算,为1.9;菌血症宿主存活天数依据参考文献[14]中鼠疫菌对小鼠毒力测定数据,为1.0)。
3 讨论 3.1 关于鼠疫媒介效能实验方法的问题1894年人类首次发现鼠疫病原体不久,蚤在传播鼠疫中的作用就得到充分的肯定,提出菌栓蚤传播鼠疫菌的机制模型[15]。然而,许多学者在大量实验研究过程中发现这一学说仍然存在许多不足之处:(1)有些菌栓形成能力非常弱的蚤能够传播鼠疫并引起动物间的鼠疫流行[16-19],如北美鼠疫疫源地的主要媒介蒙大拿山蚤(Oropsylla montana)。(2)菌栓蚤的寿命非常有限,有些往往仅能存活数天[6, 15],同时菌栓蚤在吸食宿主血液过程中返吐至宿主的鼠疫菌也非常少,二者极大削弱了蚤在动物鼠疫流行中的传播效能[19-21]。(3)某些蚤具备在菌栓形成之前的早期鼠疫菌传播能力,并可引发动物间鼠疫流行[16-19]。(4)蚤菌栓的形成机制非常复杂,诸如感染方式、供血血源、实验温度等都对菌栓形成有影响[6, 22-23]。这些因素促使我们在簇鬃客蚤的研究过程中,更多地专注于不同实验方法,尤其是簇鬃客蚤在自然宿主条件下的媒介效能问题。第一,蚤感染方式的问题。在人工感染装置模式下,簇鬃客蚤半数感染率(ID50)所需菌血浓度为4.1×109 cfu/ml[6];但大沙鼠的感染实验表明,感染大沙鼠的菌血浓度为1.0×107 cfu/g[4]。可以推测在自然感染中,簇鬃客蚤从自然宿主获得的感染菌量要低于人工装置。第二,感染浓度对簇鬃客蚤寿命有显著影响。1.0×109 cfu/ml浓度感染蚤的寿命是对照组的49.9%〔对照组为(20.5±8.3)d〕,为(10.2±3.3)d,而1.0×1010 cfu/ml感染蚤的寿命仅为(7.1±2.5)d。第三,低浓度重复吸血感染可显著提高感染率。用1.0×109 cfu/ml菌血浓度感染簇鬃客蚤,初感染率可由1次吸血的40.6%提高至二次重复吸血的79.2%,超过用1.0×1010 cfu/ml菌血浓度1次供血水平(78.6%),且感染率衰减趋势显著慢于后者,说明低浓度重复吸血感染有利于簇鬃客蚤保持较长时间的高感染效率。Zhang等[6]、Eisen等[23]分别对簇鬃客蚤和Oropsylla montana的研究表明,2次吸血感染可有效延长蚤的传染效率[6, 23-24]。同时,簇鬃客蚤生活史和吸血习性实验研究也表明该蚤是一种高吸血频次、短生活周期、高繁殖力蚤类[25]。第四,簇鬃客蚤的自然宿主大沙鼠对鼠疫菌具有较高的抗性,可为簇鬃客蚤提供较长时间的感染窗口期[4]。这些都说明簇鬃客蚤完全可从携带有鼠疫菌的大沙鼠经低菌量长期重复吸血而获得感染。本实验中,感染鼠疫菌的大沙鼠对蚤的感染率为88.2%,高于采用人工饲血装置高剂量浓度(1.0×1010 cfu/ml)的感染效率(78.6%),且感染蚤的寿命较人工饲血装置感染蚤长。说明自然感染鼠疫的宿主动物-大沙鼠对簇鬃客蚤有高效感染性。
同样,在人工饲血感染装置和自然宿主吸血感染模式下,簇鬃客蚤的媒介传播效能是有所不同的。Zhang等[4]报道了大沙鼠经皮下与经簇鬃客蚤叮咬获得感染的表现存在极大差异,前者用7.4×105 cfu/ml浓度仅能造成20.0%的大沙鼠被感染,而后者10匹感染的簇鬃客蚤可使44.4%的实验大沙鼠被感染[6]。本研究中亦发现感染大沙鼠对簇鬃客蚤具有高效感染效能,而用此方式获得的感染蚤亦对小鼠具有高效传播效能,传染率为14.1%,高于以人工饲血装置的传播效能(单只蚤为2.7%,5只蚤为5.6%),其原因尚不清楚。
在既往的媒介效能实验中,感染血源多种多样,包括豚鼠、鸡、兔、羊等多种蚤感染血源,由此得到的媒介蚤媒介效能结果不可避免地会产生重复性、可比性差的问题[22, 26]。本文实验结果显示,用簇鬃客蚤自然宿主大沙鼠血液与以豚鼠血液为感染血源,簇鬃客蚤在感染率、存活率、寿命以及菌栓形成过程等方面都有极大的不同。
3.2 簇鬃客蚤的媒介效能蚤类传播鼠疫的媒介效能评价,国内多采用Wheeler(1954)和Kartman(1956)的媒介效能评价体系[8],而国际上目前多采用Macdonald修正的媒介传播疾病动力学标准流行病学模型[21, 26-27]。前者注重的是媒介蚤在传播鼠疫菌过程中的几个重要环节,进行实验室体系下指标评价,后者考虑到了鼠疫生态系统中宿主和媒介在鼠疫循环过程中相互影响的重要生态因素,如媒介在宿主体寄生密度水平以及宿主传染窗口期。
依据上述2个评价体系,Wheeler(1954)和Kartman(1956)模型得到的簇鬃客蚤媒介效能为0.02,低于家鼠疫源地印鼠客蚤(Xenopsylla cheopis)、人蚤(Pulex irritans)以及黄鼠疫源地方形黄鼠蚤(Citellophilus tesquorum)[28],但这些文献报道的蚤感染方式多种多样,感染方式有人工感染装置感染、自然宿主或实验小鼠人工感染发病后感染,感染血源有人、自然宿主〔黄胸鼠(Rattus tanezumi)〕、实验动物如小鼠等,使用的感染蚤有单只的,也有多只集传的。目前集传实验也没有统一的蚤数量使用标准和依据[29-30]。因此,此类媒介效能实验得到结果参考意义需要商榷。对此,国际上对使用较为统一的媒介传播疾病效能研究方法给予了高度关注,强调在实验蚤种的目的性选择、温度控制、作用机制、血源选择、感染方式,以及最低传染实验蚤数量等几个方面,建立标准媒介效能研究体系[11]。本文采用Macdonald修正的媒介效能模型测定的簇鬃客蚤媒介传播效能为3.2,与新疆准噶尔区域鼠疫自然疫源地调查期间该区域动物鼠疫流行形势相符[3],与准噶尔盆地大沙鼠体蚤群落结构与流行病学关系的分析结果相一致[5]。较Wheeler(1954)和Kartman(1956)模型更有说服力。
3.3 簇鬃客蚤鼠疫媒介效能实验模型参考指标依据本文簇鬃客蚤媒介效能实验中各个环节不同方法取得的实验结果,以及由此计算出的簇鬃客蚤媒介效能,并结合前期作者等对准噶尔鼠疫现场调查、大沙鼠宿主作用,以及簇鬃客蚤生活史、侵袭力和媒介传播效能等研究结果[3-5, 13-14, 25],总结提出如下簇鬃客蚤媒介效能实验模型参考指标:(1)实验中选用的实验蚤均应为同批次新羽化未吸血蚤。(2)实验温度和湿度环境条件应与蚤的自然生存条件一致,簇鬃客蚤实验环境条件:温度(26.0±0.5)℃、湿度(70.0±5.0)%。(3)血源应根据实验目的选择相应的动物或人血血源,饲喂方式选择人工装置或宿主感染发病窗口期饲血方式。(4)菌血浓度不低于致目标蚤感染的半数感染率,在此浓度之上宜采用较低浓度2~3次饲血方式感染。(5)菌血浓度及蚤细菌载量计算,均应以活菌培养计数法获得数据为最终标准。(6)媒介效能集传实验使用媒介蚤数量应以自然条件下宿主的媒介蚤指数为基准根据实验目的进行调整。(7)在鼠疫疫源地自然条件下的媒介效能评价,供血血源宜选用自然宿主血源〔大沙鼠或子午沙鼠(Meriones meridianus)〕,评价模型选用Macdonald修正的媒介效能模型更为适宜。
利益冲突 无
| [1] |
Yang RF. Plague: recognition, treatment, and prevention[J]. J Clin Microbiol, 2018, 56(1): e01519-17. DOI:10.1128/JCM.01519-17 |
| [2] |
丛显斌, 刘振才. 中国鼠疫及其防治(2001-2010)[M]. 长春: 吉林科学技术出版社, 2014: 2-4. Cong XB, Liu ZC. Chinese plague and control[M]. Changchun: Jilin Science and Technology Press, 2014: 2-4. |
| [3] |
张渝疆, 戴翔, 阿不力米提, 等. 准噶尔盆地鼠疫调查[J]. 中华流行病学杂志, 2008, 29(2): 136-144. Zhang YJ, Dai X, Abulimiti, et al. Study on the situation of plague in Junggar basin of China[J]. Chin J Epidemiol, 2008, 29(2): 136-144. DOI:10.3321/j.issn:0254-6450.2008.02.008 |
| [4] |
Zhang YJ, Dai X, Wang XH, et al. Dynamics of Yersinia pestis and its antibody response in great gerbils (Rhombomys opimus) by subcutaneous infection[J]. PLoS One, 2012, 7(10): e46820. DOI:10.1371/journal.pone.0046820 |
| [5] |
张渝疆, 阿扎提, 雒涛, 等. 准噶尔盆地鼠疫自然疫源地大沙鼠寄生蚤群落结构及其鼠疫流行病学分析[J]. 中华流行病学杂志, 2013, 34(11): 1096-1100. Zhang YJ, Azati, Luo T, et al. Community structure of great gerbils(Rhombomys opimus) parasitic fleas in Junggar basin focus and related epizootiological characteristics on plague[J]. Chin J Epidemiol, 2013, 34(11): 1096-1100. DOI:10.3760/cma.j.issn.0254-6450.2013.011.012 |
| [6] |
Zhang YJ, Dai X, Wang QG, et al. Transmission efficiency of the plague pathogen (Y.pestis) by the flea, Xenopsylla skrjabini, to mice and great gerbils[J]. Parasit Vectors, 2015, 8(1): 256. DOI:10.1186/s13071-015-0852-z |
| [7] |
张渝疆. 基于自然生态模式的鼠疫媒介效能研究新思考[J]. 中华地方病学杂志, 2017, 36(6): 391-394. Zhang YJ. A new thinking of the study on plague vector efficiency based on the natural ecological model[J]. Chin J Endemiol, 2017, 36(6): 391-394. DOI:10.3760/cma.j.issn.2095-4255.2017.06.001 |
| [8] |
纪树立, 贺建国, 孙玺, 等. 鼠疫[M]. 北京: 人民卫生出版社, 1988: 186-187. Ji SL, He JG, Sun X, et al. Plague[M]. Beijing: People's Medical Publishing House, 1988: 186-187. |
| [9] |
Fine PEM. Epidemiological principles of vector-mediated transmission[M]//McKelvey JJ Jr, Eldridge BF, Maramorosch K, et al. Vectors disease agents. New York: Praeger, 1981: 77-91.
|
| [10] |
Macdonald G. Epidemiologic models in studies of vector-borne diseases: the R. E. Dyer Lecture[J]. Public Health Rep, 1961, 76(9): 753-764. DOI:10.2307/4591271 |
| [11] |
Eisen RJ, Eisen L, Gage KL. Studies of vector competency and efficiency of north American fleas for Yersinia pestis: state of the field and future research needs[J]. J Med Entomol, 2009, 46(4): 737-744. DOI:10.1603/033.046.0403 |
| [12] |
Yang RF, Cui YJ, Bi YJ. Perspectives on Yersinia pestis: a model for studying zoonotic pathogens[M]//Yang RF, Anisimov A. Yersinia pestis: retrospective and perspective. Dordrecht: Springer, 2016: 377-391. DOI: 10.1007/978-94-024-0890-4_14.
|
| [13] |
王启果, 古丽阿依·包开西, 雒涛, 等. 簇鬃客蚤对宿主侵袭能力的实验观察[J]. 疾病预防控制通报, 2013, 28(5): 1-3. Wang QG, Baokaixi G, Luo T, et al. Experimental observations on infestation ability of Xenopsylla skrjabini on hosts[J]. Bull Dis Control Prev, 2013, 28(5): 1-3. DOI:10.13215/j.cnki.jbyfkztb.2013.05.019 |
| [14] |
热娜·吐尔地, 布仁明德, 戴翔, 等. 新疆准噶尔盆地鼠疫菌生化和毒力测定[J]. 中国人兽共患病学报, 2006, 22(11): 1086-1087. Rena TED, Burenmingde, Dai X, et al. Biochemical and virulence determination of Yersinia pestis from Jungar basin in Xinjiang[J]. Chin J Zoonoses, 2006, 22(11): 1086-1087. DOI:10.3969/j.issn.1002-2694.2006.11.022 |
| [15] |
Hinnebusch BJ, Jarrett CO, Bland DM. "Fleaing" the plague: adaptations of Yersinia pestis to its insect vector that lead to transmission[J]. Annu Rev Microbiol, 2017, 71: 215-232. DOI:10.1146/annurev-micro-090816-093521 |
| [16] |
Hinnebusch BJ, Bland DM, Bosio CF, et al. Comparative ability of Oropsylla montana and Xenopsylla cheopis fleas to transmit Yersinia pestis by two different mechanisms[J]. PLoS Negl Trop Dis, 2017, 11(1): e0005276. DOI:10.1371/journal.pntd.0005276 |
| [17] |
Eisen RJ, Dennis DT, Gage KL. The role of early-phase transmission in the spread of Yersinia pestis[J]. J Med Entomol, 2015, 52(6): 1183-1192. DOI:10.1093/jme/tjv128 |
| [18] |
Boegler KA, Graham CB, Johnson TL, et al. Infection prevalence, bacterial loads, and transmission efficiency in Oropsylla montana (Siphonaptera: Ceratophyllidae) one day after exposure to varying concentrations of Yersinia pestis in blood[J]. J Med Entomol, 2016, 53(3): 674-680. DOI:10.1093/jme/tjw004 |
| [19] |
Dewitte A, Bouvenot T, Pierre F, et al. A refined model of how Yersinia pestis produces a transmissible infection in its flea vector[J]. PLoS Pathog, 2020, 16(4): e1008440. DOI:10.1371/journal.ppat.1008440 |
| [20] |
Webb CT, Brooks CP, Gage KL, et al. Classic flea-borne transmission does not drive plague epizootics in prairie dogs[J]. Proc Natl Acad Sci USA, 2006, 103(16): 6236-6241. DOI:10.1073/pnas.0510090103 |
| [21] |
Lorange EA, Race BL, Sebbane F, et al. Poor vector competence of fleas and the evolution of hypervirulence in Yersinia pestis[J]. J Infect Dis, 2005, 191(11): 1907-1912. DOI:10.1086/429931 |
| [22] |
Bland DM, Jarrett CO, Bosio CF, et al. Infectious blood source alters early foregut infection and regurgitative transmission of Yersinia pestis by rodent fleas[J]. PLoS Pathog, 2018, 14(1): e1006859. DOI:10.1371/journal.ppat.1006859 |
| [23] |
Eisen RJ, Lowell JL, Montenieri JA, et al. Temporal dynamics of early-phase transmission of Yersinia pestis by unblocked fleas: secondary infectious feeds prolong efficient transmission by Oropsylla montana (Siphonaptera: Ceratophyllidae)[J]. J Med Entomol, 2007, 44(4): 672-677. DOI:10.1093/jmedent/44.4.672 |
| [24] |
Wilder AP, Eisen RJ, Bearden SW, et al. Oropsylla hirsuta (Siphonaptera: Ceratophyllidae) can support plague epizootics in black-tailed prairie dogs (Cynomys ludovicianus) by early-phase transmission of Yersinia pestis[J]. Vector-Borne Zoonotic Dis, 2008, 8(3): 359-368. DOI:10.1089/vbz.2007.0181 |
| [25] |
王启果, 孟卫卫, 雒涛, 等. 簇鬃客蚤生活史实验观察[J]. 中国媒介生物学及控制杂志, 2012, 23(1): 35-38. Wang QG, Meng WW, Luo T, et al. Experimental observations of the life cycle of Xenopsyll askrjabini[J]. Chin J Vector Biol Control, 2012, 23(1): 35-38. |
| [26] |
Wilder AP, Eisen RJ, Bearden SW, et al. Transmission efficiency of two flea species (Oropsylla tuberculata cynomuris and Oropsylla hirsuta) involved in plague epizootics among prairie dogs[J]. Ecohealth, 2008, 5(2): 205-212. DOI:10.1007/s10393-008-0165-1 |
| [27] |
Enscore RE, Babi N, Amatre G, et al. The changing triad of plague in Uganda: invasive black rats (Rattus rattus), indigenous small mammals, and their fleas[J]. J Vec Ecol, 2020, 45(2): 333-355. DOI:10.1111/JVEC.12404 |
| [28] |
张晓雪. 有关中国跳蚤与鼠疫菌关系研究的进展[J]. 地方病译丛, 1994, 15(2): 1-4. Zhang XX. Research progress on the relationship between fleas and Yersinia pestis in China[J]. Fore Endemic Dis, 1994, 15(2): 1-4. |
| [29] |
Lemon A, Sagawa J, Gravelle K, et al. Biovar-related differences apparent in the flea foregut colonization phenotype of distinct Yersinia pestis strains do not impact transmission efficiency[J]. Parasit Vectors, 2020, 13(1): 335. DOI:10.1186/s13071-020-04207-x |
| [30] |
Bosio CF, Jarrett CO, Scott DP, et al. Comparison of the transmission efficiency and plague progression dynamics associated with two mechanisms by which fleas transmit Yersinia pestis[J]. PLoS Pathog, 2020, 16(12): e1009092. DOI:10.1371/JOURNAL.PPAT.1009092 |
 2021, Vol. 32
2021, Vol. 32


