扩展功能
文章信息
- 郭秀霞, 程鹏, 刘丽娟, 王海防, 张崇星, 王怀位, 公茂庆
- GUO Xiu-xia, CHENG Peng, LIU Li-juan, WANG Hai-fang, ZHANG Chong-xing, WANG Huai-wei, GONG Mao-qing
- 白纹伊蚊紫外光敏感视蛋白基因的克隆及序列特征
- Cloning and sequence features of ultraviolet sensitive opsin gene in Aedes albopictus
- 中国媒介生物学及控制杂志, 2021, 32(5): 553-559
- Chin J Vector Biol & Control, 2021, 32(5): 553-559
- 10.11853/j.issn.1003.8280.2021.05.009
-
文章历史
- 收稿日期: 2021-01-20
蚊虫是重要的医学昆虫,不仅通过吸血骚扰人类,更是多种传染病的传播媒介。视觉是蚊虫感知周围视觉刺激,适应周围环境最重要的途径。研究发现,蚊虫在定位宿主进行吸血的过程中,是通过嗅觉和视觉的综合作用协调完成的[1]。蚊虫通过气味激发视觉反射,发现潜在宿主从而完成吸血过程。视觉在蚊虫吸血定位宿主、寻找配偶和栖息地、交配繁殖等有重要意义[2-3]。视蛋白是视觉系统中的重要蛋白分子,与发色团结合形成对特定光谱敏感的光色素。根据视蛋白所能感受的光谱范围,蚊虫的视蛋白主要分为3类,即长光波敏感视蛋白(long wavelength-sensitive opsin,LWS-opsin)、短光波敏感视蛋白(short wavelength-sensitive opsin,SWS-opsin)及紫外光敏感视蛋白(ultraviolet-sensitive opsin,UV-opsin)[4-6]。其中UV-opsin可能对于蚊虫的吸血行为、雌雄蚊的相互识别交配及信息传递等有重要作用[7-9]。白纹伊蚊(Aedes albopictus)是我国常见的蚊种之一,攻击性强,能够传播多种病原体,是我国登革热的重要传播媒介[10],对白纹伊蚊UV-opsin的研究有助于掌握蚊虫的视觉与吸血行为的关系,从而发现新的防治手段干扰蚊虫对宿主的吸血攻击。本研究通过提取白纹伊蚊雌蚊的核糖核酸,设计简并引物,进行反转录-聚合酶链式反应(RT-PCR),克隆白纹伊蚊紫外光敏感视蛋白基因的cDNA全长序列,对获得的基因序列及编码蛋白序列进行生物信息学分析,了解该蛋白的分子特征,为进一步研究白纹伊蚊紫外光敏感视蛋白的生物学功能及视觉行为特征相关分子机制奠定基础。
1 材料与方法 1.1 材料 1.1.1 蚊虫样本白纹伊蚊(敏感种群)取自山东省疾病预防控制中心,在养蚊室内连续饲养。饲养条件为光照∶黑暗=14 h∶10 h,温度为26~28 ℃,相对湿度为75%~85%,用健康小白鼠饲喂来产卵传代。
1.1.2 试剂RNeasy Mini Kit和Omniscript Reverse Transcription Kit试剂盒购自QIAGEN公司;EcoRⅠ酶、XhoⅠ酶、DNA连接试剂盒、DNA分子质量标准(DL-2 000)和大肠埃希菌(Escherichia coli)感受态细胞DH5α购自TaKaRa公司;pET28a(+)simple vector购自Novagen公司;凝胶回收试剂盒和质粒小提取试剂盒购自Axygen公司;其余试剂均为国产分析纯。
1.2 方法 1.2.1 白纹伊蚊总RNA提取取羽化后3 d,生理状态良好,未经吸血和交配的白纹伊蚊成蚊雌蚊10只,在无RNase的匀浆器中,加入液氮后充分研磨。使用RNeasy Mini Kit按照说明书具体操作步骤提取白纹伊蚊总RNA,测定RNA的吸光度(A)并计算A260/A280值及浓度。
1.2.2 反转录以获得的总RNA为模板,使用Omniscript Reverse Transcription Kit(购自QIAGEN公司),反转录合成cDNA,实验同时设立无反转录酶的阴性对照。反应体系为:5 mmol/L dNTP Mix 2 μl、10×Buffer RT 2 μl、Oligo(dT)15 primer 2 μl、10 U/μl RNase inhibitor 1 μl、Omniscript Reverse Transriptase 1 μl、Total RNA 500 ng、RNase-free water 11 μl。置于37 ℃反应60 min。
1.2.3 白纹伊蚊UV-opsin基因的克隆根据GeneBank中收录的埃及伊蚊(Ae. aegypti)和白纹伊蚊紫外光敏感视蛋白核苷酸序列设计简并引物,正向引物:5'-CGGAATTCATGCCTTTCSWAGAGCATCTGA-3';反向引物:5'-TGCTCGAGTTAAGAAGATYCTGGTGCCGA-3'。以合成的cDNA为模板进行PCR反应,反应体系为:模板cDNA 1 μl、正反向引物各1 μl、10 mmol/L dNTP 1 μl、10×LA PCR Buffer 5 μl、LA Taq聚合酶0.5 μl、ddH2O 40.5 μl。反应条件:94 ℃预热3 min;94 ℃ 30 s,55 ℃ 45 s,72 ℃ 1 min 20 s,扩增30个循环;72 ℃ 5 min延伸后产物在4 ℃保存。取2 μl PCR产物进行1%琼脂糖凝胶电泳,观察目的条带。
1.2.4 重组载体的构建及测序对获得的目的片段进行凝胶回收纯化,用EcoRⅠ和XhoⅠ酶对目的片段和pET28a(+)simple vector进行双酶切,反应体系如下:10×H Buffer 5 μl、pET28a(+)simple vector或目的片段10 μl,15 U/μl EcoRⅠ1 μl、10 U/μl XhoⅠ1 μl、ddH2O 33 μl,37 ℃反应16 h后进行1%琼脂糖凝胶电泳并切胶回收。将回收的PCR产物片段与载体片段通过DNA连接试剂盒进行连接,取连接产物1 μl转化至大肠埃希菌感受态细胞DH5α,涂布到含有卡那霉素(50 μg/ml)的LB固体培养平板上,37 ℃过夜培养,挑取单菌落进行PCR鉴定,阳性菌落摇菌提取质粒后送Invitrogen公司进行测序。
1.2.5 白纹伊蚊UV-opsin基因的序列分析将测序结果在美国国立生物技术信息中心(NCBI)网站上进行BLAST比对,搜集GenBank中收录的伊蚊属、库蚊属、按蚊属及其他昆虫的视蛋白氨基酸序列,通过DNAMan 9.0、Clustal X 1.81和MEGA 4.0软件进行序列同源性比对并用邻接法绘制生物进化树。利用Protparam分析该蛋白的分子质量及稳定性等特征;通过Tmpred进行蛋白的跨膜区分析;利用在线软件ScanProsite分析视蛋白的结构域和功能位点,通过在线软件SOPMA进行氨基酸序列的二级结构预测,利用SWISSMODEL和Deepview 4.1.0软件对该蛋白的三级结构进行预测。
2 结果 2.1 白纹伊蚊UV-opsin全长cDNA的克隆及测序将扩增获得的PCR产物进行1%琼脂糖凝胶电泳,发现在1 000 bp与2 000 bp之间有1条显著条带,与理论分子质量大小相符(图 1)。将基因回收产物与经EcoRⅠ和XhoⅠ双酶切线性化的pET28a(+)载体相连接,转化至大肠埃希菌感受态细胞DH5α,阳性克隆质粒进行测序,与预期结果相一致。
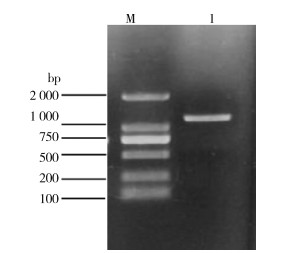
|
| 注:M表示DL 2 000 DNA marker;1白纹伊蚊紫外光敏感视蛋白RT-PCR扩增产物。 图 1 白纹伊蚊紫外光敏感视蛋白RT-PCR产物电泳结果 Figure 1 Agarose gel electrophoresis of the RT-PCR products of UV-opsin from Aedes albopictus |
| |
测序结果显示,白纹伊蚊UV-opsin基因片段全长1 146 bp(含终止密码子),其中G+C含量为50.10%,A+T含量为49.90%。该基因可编码的氨基酸为381个,理论蛋白相对分子质量为42 500,理论等电点为7.06。体外半衰期为30 h,不稳定系数为39.85,性质稳定。正电荷氨基酸残基(Arg+Lys)和负电荷氨基酸残基(Asp+Glu)各有27个,总平均亲水性为0.33,脂肪系数为93.46。将该序列在GenBank中进行BLAST比对,发现白纹伊蚊UV视蛋白与其他昆虫的UV视蛋白具有较高同源性,利用DANMan 9.0软件进行比对,与白纹伊蚊(XP_029730343)相似性高达99.74%,与埃及伊蚊(ABF18478)相似性为96.85%,与致倦库蚊(Culex pipiens quinquefasciatus)(XP_001851157)相似性为92.65%,与GenBank中收录的不同蚊种及其他昆虫的紫外光敏感视蛋白序列进行同源性序列比对,使用邻接法绘制系统进化树并进行分析,结果显示这几类昆虫位于不同的分支,其中白纹伊蚊与埃及伊蚊合并为一个分支,之后与致倦库蚊合并,按蚊属的冈比亚按蚊(Anopheles gambiae)与斯氏按蚊(An. stephensi)合并后再与白魔按蚊(An. albimanus)合并为一大分支,属于鞘翅目的粒步甲(Carabus granulatus)与烟草甲(Lasioderma serricorne)合并,白蜡窄吉丁(Agrilus planipennis)与赤拟谷盗(Tribolium castaneum)合并,属于膜翅目的意蜂(Apis mellifera)与美州东部熊蜂(Bombus impatiens)合并为一个分支,烟草天蛾(Manduca sexta)为独立分支。双翅目、膜翅目、鞘翅目和鳞翅目的昆虫形成不同的分支。见图 2、3。
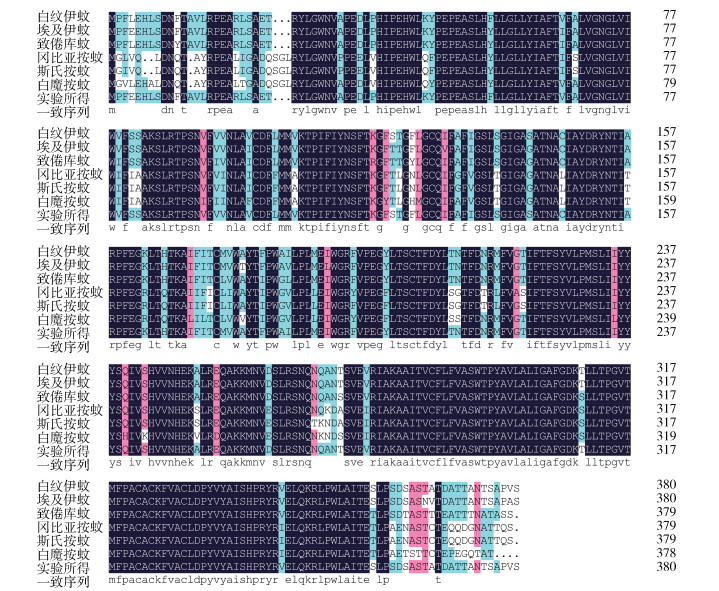
|
| 注:根据同源序列≥50.00%进行蓝黑色、粉色和蓝色的级别上色,其中蓝黑色为高度保守区域(保守性100%);粉色和蓝色为相似区域。 图 2 不同蚊种紫外光敏感视蛋白的序列比对 Figure 2 Sequence alignment of UV-opsin from different mosquito species |
| |
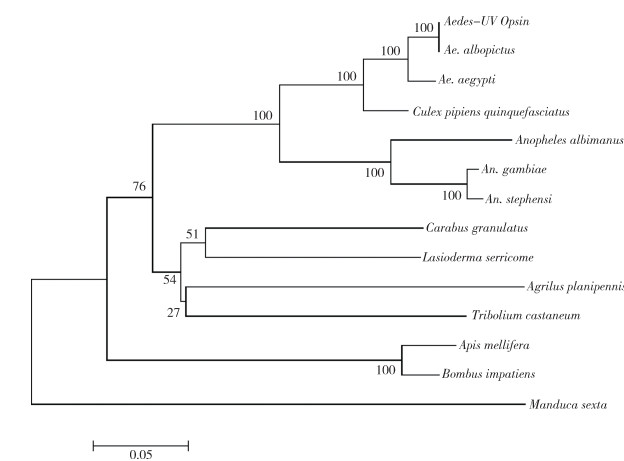
|
| 图 3 不同蚊种与多种昆虫的视蛋白生物进化分析 Figure 3 Phylogenetic tree of UV-opsin from different mosquito species and other insect species |
| |
对获得的视蛋白序列进行二级结构预测,白纹伊蚊UV视蛋白的α螺旋约占41.73%,延伸链约占17.06%,β转角约占3.41%,随机卷曲结构约占37.80%(图 4)。通过Tmpred蛋白跨膜区分析发现,该视蛋白在第56~80、92~113、123~144、169~189、217~239、282~303、315~338氨基酸位具有7个跨膜拓扑结构,其中跨膜区第56~80、123~144、217~239、315~338氨基酸位为由外向内,其他3个跨膜区为由内向外。该蛋白包括1个G蛋白偶联受体家族,利用NCBI在线网站对视觉基因编码的氨基酸序列保守区进行分析,白纹伊蚊UV视蛋白与已知的视蛋白结构域吻合,包括7次跨膜螺旋和GCPRs结构。利用在线分析软件ScanProsite对白纹伊蚊视蛋白功能位点进行分析,发现白纹伊蚊UV视蛋白含有1个G蛋白偶联受体家族(第140~156氨基酸位),4个N-豆蔻酰化位点(第134~139、138~143、140~145、220~225氨基酸位)、3个N-糖基化位点(第10~13、272~275、374~377氨基酸位)、1个酪氨酸激酶磷酸化位点(第20~27氨基酸位)、3个蛋白激酶C磷酸化位点(第82~84、85~87、263~265氨基酸位)以及2个酪蛋白激酶Ⅱ磷酸化位点(第273~276,366~369氨基酸位),具有6种不同模式(图 5)。该视蛋白含有昆虫视蛋白所具有的一些保守的基序,如LRTPSN基序(第86~91氨基酸位),DRY基序(第151~153氨基酸位)和QAKK基序(第255~258氨基酸位),为视蛋白发挥作用的重要基序[11-12]。

|
| 注:h α螺旋;e延伸链;t β转角;c随机卷曲。 图 4 白纹伊蚊紫外光敏感视蛋白二级结构分析 Figure 4 Secondary structure analysis of UV-opsin of Aedes albopictus |
| |

|
| 注:跨膜拓扑结构(第56~80、92~113、123~144、169~189、217~239、282~303、315~338氨基酸位)涂黑标出,蛋白激酶C磷酸化位点(第82~84、85~87、263~265氨基酸位)用下划线标出,N-糖基化位点(第10~13、272~275、374~377氨基酸位)用实线框标出,酪蛋白激酶Ⅱ磷酸化位点(第273~276、366~369氨基酸位)用双下划线标出,酪氨酸激酶磷酸化位点(第20~27氨基酸位)用虚下划线标出,N-豆蔻酰化位点(第134~139、138~143、140~145、220~225氨基酸位)用虚线框标出,G蛋白偶联受体家族(第140~156氨基酸位)用曲线标出。 图 5 白纹伊纹紫外光敏感视蛋白基因的核苷酸序列及推导的氨基酸序列 Figure 5 Nucleotide and deduced amino acid sequences of the UV-opsin gene in Aedes albopictus |
| |
应用Swissmodel对该蛋白进行结构建模,获得的三维结构如图 6所示。该结构模型的构建基于模型4ww3.1(2.80 Å)完成,序列一致性达到35.11%,全局模型质量估计值为0.60,定性模型能量分析值为-3.45,运用拉马钱德兰图检测所模拟的结构模型具有合理性,符合2个二面角ϕ和ψ分布的基本要求。见图 7。
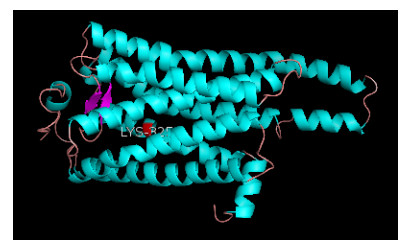
|
| 注:与视蛋白紫外敏感性相关的赖氨酸残基用红色标出。 图 6 白纹伊蚊紫外光敏感视蛋白三级结构预测 Figure 6 Prediction of the 3D structure of UV-opsin of Aedes albopictus |
| |
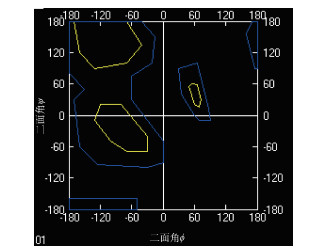
|
| 图 7 白纹伊蚊紫外光敏感视蛋白三维结构的拉马钱德兰图 Figure 7 Ramachandran plot of 3D structure of UV-opsin of Aedes albopictus |
| |
视觉在动物体生命活动的很多方面有重要作用,比如搜寻食物、寻找配偶和栖息地,躲避天敌及不安全环境等,是感知周围生存环境及视觉刺激的最重要途径。昆虫对环境中视觉刺激的反应主要依靠于视蛋白,视蛋白与小分子的发色团共价结合,从而使昆虫对光线做出反应。发色团在光子的作用下发生光异构化,诱导视蛋白发生构象变化,并激活下游信号级联反应。大部分的视蛋白基因在光感受器中表达,发挥视觉功能,如觅食、寻找配偶和栖息地、躲避天敌等,也有少部分视蛋白在其他组织中表达,起到非视觉的功能,如生物节律和光周期调节[13-14]。视蛋白在进化中形成3个主要的家族:纤毛视蛋白,视杆视蛋白和RGR/Go视蛋白,昆虫中主要为视杆视蛋白,其中,紫外光敏感视蛋白的光谱敏感范围在雌性和雄性昆虫之间存在差异,对于雌性与雄性昆虫的相互识别、取食交配及信息传递等有重要的作用[7-9]。
本研究成功克隆得到白纹伊蚊紫外光敏感视蛋白基因序列,序列分析显示,白纹伊蚊UV视蛋白基因的cDNA序列全长1 146 bp,编码381个氨基酸,使用邻接法构建系统发育树,分析表明,白纹伊蚊UV视蛋白与其他蚊种的同源性较高,其中伊蚊属与库蚊属的同源性较高,不同蚊属合并为一大分支,蚊科所属的双翅目与鞘翅目昆虫形成的分支合并,不同目的昆虫为独立分支,可见UV视蛋白在不同的物种之间具有较高的保守性,在以后的工作中可以将该视蛋白基因作为亲缘关系鉴定及物种系统发育进化研究的靶基因[15]。
对白纹伊蚊紫外光敏感视蛋白氨基酸序列分析发现,该序列具有视蛋白的典型结构,即包含7个跨膜拓扑结构和1个G蛋白偶联受体家族[16]。第7跨膜区325位的赖氨酸为视黄醛发色团结合的保守位点,该位点为视蛋白分子的重要特征,与视蛋白的紫外敏感性有关[17],不同视蛋白所含有的赖氨酸位点位置不同,大部分赖氨酸位点位于视蛋白的第7个跨膜区内,以Schiff碱基的形式与视黄醛发色团结合[18-19]。该视蛋白具有昆虫视蛋白所具有的一些保守的基序,如细胞质膜的第1个环内的LRTPXN基序,在该视蛋白中为LRTPSN(第86~91氨基酸位),该基序中的亮氨酸和天冬氨酸是视蛋白发挥功能所必需的氨基酸[11]。该视蛋白含有1个保守的DRY(第151~153氨基酸位)基序和保守的QAKK(第255~258氨基酸位)基序,DRY基序与QAKK基序在视蛋白与G-蛋白发生作用时发挥重要的作用,第151~152氨基酸位的DR与G蛋白偶联受体的活化作用有关[12]。
国内外对鳞翅目、膜翅目、鞘翅目等昆虫的视觉基因研究较多,而对双翅目蚊媒的视觉基因和视觉依赖行为机制的研究较少。蚊虫视蛋白是直接感受外界光环境的受体,对蚊虫的吸血定位、交配和繁殖等有重要意义。目前,冈比亚按蚊和斯氏按蚊的视蛋白基因已有相关研究[20],白纹伊蚊的抗药性相关视蛋白基因已被克隆鉴定[21]。白纹伊蚊是我国重要的媒介蚊虫,是登革热的重要传播媒介。本研究成功克隆了白纹伊蚊紫外光敏感视蛋白基因并对其编码蛋白进行分析,为进一步研究视蛋白的功能奠定了基础,对于根据蚊媒视觉行为特征进行蚊媒防治及蚊传播疾病的控制有重要意义。此次研究采用的白纹伊蚊是实验室饲养的敏感种群,对于抗性种群及不同地理株的白纹伊蚊,以及不同性别及生理状态的蚊虫,该基因的表达是否存在差异,还有待进一步研究。
利益冲突 无
| [1] |
van Breugel F, Riffell J, Fairhall A, et al. Mosquitoes use vision to associate odor plumes with thermal targets[J]. Curr Biol, 2015, 25(16): 2123-2129. DOI:10.1016/j.cub.2015.06.046 |
| [2] |
Leung NY, Montell C. Unconventional roles of opsins[J]. Annu Rev Cell Dev Biol, 2017, 33: 241-264. DOI:10.1146/annurevcellbio-100616-060432 |
| [3] |
Cardé RT. Multi-cue integration: how female mosquitoes locate a human host[J]. Curr Biol, 2015, 25(18): R793-R795. DOI:10.1016/j.cub.2015.07.057 |
| [4] |
Feuda R, Marlétaz F, Bentley MA, et al. Conservation, duplication, and divergence of five opsin genes in insect evolution[J]. Genome Biol Evol, 2016, 8(3): 579-587. DOI:10.1093/gbe/evw015 |
| [5] |
Henze MJ, Oakley TH. The dynamic evolutionary history of pancrustacean eyes and opsins[J]. Integr Comp Biol, 2015, 55(5): 830-842. DOI:10.1093/icb/icv100 |
| [6] |
Giraldo-Calderón GI, Zanis MJ, Hill CA. Retention of duplicated long-wavelength opsins in mosquito lineages by positive selection and differential expression[J]. BMC Evol Biol, 2017, 17(1): 84. DOI:10.1186/s12862-017-0910-6 |
| [7] |
Baik LS, Recinos Y, Chevez JA, et al. Multiple phototransduction inputs integrate to mediate UV light-evoked avoidance/attraction behavior in Drosophila[J]. J Biol Rhythms, 2019, 34(4): 391-400. DOI:10.1177/0748730419847339 |
| [8] |
Li LF, Chi H, Liu HN, et al. Retention and losses of ultraviolet-sensitive visual pigments in bats[J]. Sci Rep, 2018, 8: 11933. DOI:10.1038/s41598-018-29646-6 |
| [9] |
Arikawa K, Wakakuwa M, Qiu XD, et al. Sexual dimorphism of short-wavelength photoreceptors in the small white butterfly, Pieris rapae crucivora[J]. J Neurosci, 2005, 25(25): 5935-5942. DOI:10.1523/JNEUROSCI.1364-05.2005 |
| [10] |
Gao J, Zhang HD, Guo XX, et al. Dispersal patterns and population genetic structure of Aedes albopictus (Diptera: Culicidae) in three different climatic regions of China[J]. Parasit Vectors, 2021, 14(1): 12. DOI:10.1186/s13071-020-04521-4 |
| [11] |
Senthilan PR, Helfrich-FÖrster C. Rhodopsin 7-the unusual rhodopsin in Drosophila[J]. Peer J, 2016, 4: e2427. DOI:10.7717/peerj.2427 |
| [12] |
Baldwin JM, Schertler GFX, Unger VM. An alpha-carbon template for the transmembrane helices in the rhodopsin family of G-protein-coupled receptors[J]. J Mol Biol, 1997, 272(1): 144-164. DOI:10.1006/jmbi.1997.1240 |
| [13] |
Katana R, Guan CL, Zanini D, et al. Chromophore-independent roles of opsin apoproteins in Drosophila mechanoreceptors[J]. Curr Biol, 2019, 29(17): 2961-2969. DOI:10.1016/j.cub.2019.07.036 |
| [14] |
Yourick MR, Sandkam BA, Gammerdinger WJ, et al. Diurnal variation in opsin expression and common housekeeping genes necessitates comprehensive normalization methods for quantitative real-time PCR analyses[J]. Mol Ecol Resour, 2019, 19(6): 1447-1460. DOI:10.1111/1755-0998.13062 |
| [15] |
Pohl N, Sison-Mangus MP, Yee EN, et al. Impact of duplicate gene copies on phylogenetic analysis and divergence time estimates in butterflies[J]. BMC Evol Biol, 2009, 9(1): 99. DOI:10.1186/1471-2148-9-99 |
| [16] |
Zanini D, Giraldo D, Warren B, et al. Proprioceptive opsin functions in Drosophila larval locomotion[J]. Neuron, 2018, 98(1): 67-74. DOI:10.1016/j.neuron.2018.02.028 |
| [17] |
Salcedo E, Zheng LJ, Phistry M, et al. Molecular basis for ultraviolet vision in invertebrates[J]. J Neurosci, 2003, 23(34): 10873-10878. DOI:10.1523/JNEUROSCI.23-34-10873.2003 |
| [18] |
Wang T, Montell C. Phototransduction and retinal degeneration in Drosophila[J]. Pflügers Arch-Eur J Physiol, 2007, 454(5): 821-847. DOI:10.1007/s00424-007-0251-1 |
| [19] |
Owens GL, Rennison DJ. Evolutionary ecology of opsin gene sequence, expression and repertoire[J]. Mol Ecol, 2017, 26(5): 1207-1210. DOI:10.1111/mec.14032 |
| [20] |
Jenkins AM, Muskavitch MAT. Crepuscular behavioral variation and profiling of opsin genes in Anopheles gambiae and An. stephensi (Diptera: Culicidae)[J]. J Med Entomol, 2015, 52(3): 296-307. DOI:10.1093/jme/tjv024 |
| [21] |
孙艳. 视蛋白基因参与蚊抗药性机制的研究[D]. 南京: 南京医科大学, 2012. Sun Y. Opsin, involved in mosquito resistance to deltamethrin[D]. Nanjing: Nanjing Medical University, 2012. |
 2021, Vol. 32
2021, Vol. 32


