扩展功能
文章信息
- 赵琼瑶, 邱星辉, 杨研, 罗兴, 宋晓明, 贾永朝
- ZHAO Qiong-yao, QIU Xing-hui, YANG Yan, LUO Xing, SONG Xiao-ming, JIA Yong-chao
- 四川省广元市中华按蚊杀虫剂靶标基因的多态性及抗性突变频率研究
- Polymorphism and resistance mutation frequency of the target genes of insecticides in Anopheles sinensis in Guangyuan of Sichuan province, China
- 中国媒介生物学及控制杂志, 2021, 32(5): 541-545
- Chin J Vector Biol & Control, 2021, 32(5): 541-545
- 10.11853/j.issn.1003.8280.2021.05.006
-
文章历史
- 收稿日期: 2020-12-07
2 中国科学院动物研究所农业虫害鼠害综合治理研究国家重点实验室, 北京 100101
2 Institute of Zooloy, Chinese Academy of Sciences, Beijing 100101, China
疟疾是全球最严重的公共卫生问题之一,是许多热带和亚热带地区常见的威胁生命的疾病。世界卫生组织《2019年世界疟疾报告》数据显示,2018年全世界估计发生2.28亿例疟疾病例[1]。2019年全国报告疟疾病例2 674例,四川省报告病例数位居全国第5[2]。
全世界有400多种按蚊,在疟疾传播中起重要作用的按蚊有27种。在我国,50余种按蚊中较重要的传疟媒介有中华按蚊(Anopheles sinensis)、雷氏按蚊(An. lesteri)、微小按蚊(An. minimus)等[3-5]。亚洲的中华按蚊种群可能是间日疟最重要的传播媒介[6]。由于目前没有可以商业化的疟疾疫苗[7],疟疾的防控主要依靠蚊虫防制。化学防治是除孳生地治理之外的媒介蚊虫控制的必要手段,而化学防治的可持续性受到杀虫剂抗性的严重制约。媒介蚊虫对杀虫剂的抗性已普遍存在,杀虫剂靶标的突变是抗药性的重要机制[1]。研究发现,与中华按蚊靶标抗性相关的点突变主要包含乙酰胆碱酯酶(acetylcholinesterase,有机磷与氨基甲酸酯类杀虫剂靶标,由ace基因编码)的G119S[8-9]、电压门控钠离子通道(voltage gated sodium channel,滴滴涕与拟除虫菊酯类杀虫剂靶标,由VGSC基因编码)的L1014 F/S/C[9-10]和γ-氨基丁酸受体Rdl亚基〔gamma aminobutyric acid(GABA)receptor subunit Rdl,环戊二烯类和氟虫腈的靶标,由rdl基因编码〕的A296S等[11-13]。
四川省广元市存在的主要传疟媒介为中华按蚊,且中华按蚊是广元市主要蚊种之一,分布广泛,密度较高。广元市自2002年后无本地感染疟疾病例发生,2014年达到国家消除疟疾标准,但每年仍有输入性间日疟等疟疾病例报告,一旦发生输入性病例,如不及时采取化学灭蚊等有效控制措施,存在引发本地病例的风险。目前广元市对蚊虫抗药性研究较少,仅有白纹伊蚊抗药性生物测定结果的相关报道[14]。本研究旨在了解广元市中华按蚊靶标抗性相关基因突变情况,为该地区的按蚊治理提供依据,提升疟疾防控水平。
1 材料与方法 1.1 材料2018年8月16日采用灯诱法在四川省广元市利州区龙潭乡建设村一猪圈(32°21'36"N,105°49'60"E)采集雌蚊,从91只雌蚊中随机选择35只用于抗性基因检测。此次样本采集地位于旅游度假村内,该区域无大量农业生产类药物使用历史,卫生类杀虫剂主要有溴氰菊酯与高效氯氰菊酯。
1.2 中华按蚊基因组DNA(gDNA)提取参考Rinkevich等[15]的方法,将清洗干净的中华按蚊(头胸部)加入盛有400 μl裂解液的1.5 ml的EP管中,用研磨棒把蚊虫研碎后加入5 μl的蛋白酶K(TIANGEN®),混匀;56 ℃水浴1 h;取出后加入60 μl的8 mol/L醋酸钾,冰上放置10 min;14 000×g离心30 min,小心吸取320 μl上清液,转移至提前做好标记的新EP管,然后加入640 μl(2倍体积)冰无水乙醇,常温放置20 min;再次同上条件离心,去除上清液,留下沉淀,加入75%的乙醇溶液200 μl;14 000×g条件下,离心10 min,丢掉上清液,放置超净工作台中1 h风干;加入25 μl ddH2O,4 ℃冰箱溶解。
1.3 Ace基因片段的扩增使用引物ASACE-F和ASACE-R[6],PCR产物涵盖部分3号和4号外显子序列和全部内含子3序列(表 1)。PCR反应体系:2×Ex Taq MasterMix(CWBIO®)25 μl,ASACE-F 1 μl,ASACE-R 1 μl,gDNA 1 μl,用ddH2O补充至50 μl。PCR条件为95 ℃ 2 min;95 ℃ 30 s、60 ℃ 30 s和72 ℃ 50 s,共38个循环;72 ℃延伸5 min。
采用引物ASKDR-F和ASKDR-R[8],扩增的产物包含完整的20号内含子以及外显子19和20号的部分序列(表 1)。PCR体系:2×Ex Taq MasterMix(CWBIO®)25 μl,ASKDR-F 1 μl,ASKDR-R 1 μl,模板1 μl,ddH2O补至50 μl。PCR反应条件为95 ℃ 3 min;95 ℃ 30 s、55 ℃ 30 s和72 ℃ 30 s,共38个循环;72 ℃延伸5 min。
1.5 Rdl基因片段的扩增采用引物ASRDL-F和ASRDL-R[11],PCR产物包含部分外显子7和部分内含子7的DNA序列(表 1)。PCR体系:2×Ex Taq MasterMix(CWBIO®)25 μl,ASRDL-F 1 μl,ASRDL-R 1 μl,gDNA模板1 μl,ddH2O补充至50 μl。PCR反应条件为95 ℃ 3 min;95 ℃ 30 s、62 ℃ 30 s和60 ℃ 40 s,共38个循环;72 ℃延伸5 min。
1.6 DNA测序与数据分析上述1.3~1.5获得的PCR产物经1.50%的凝胶电泳确认后,由北京擎科生物科技有限公司使用引物进行Sanger测序,测序引物分别为ASACE-F,ASKDR-F和ASRDL-F。DNA序列比对采用在线软件muscle 3.8(https://www.ebi.ac.uk/Tools/msa/muscle/)。DNA序列的分子进化树构建采用MEGA 7.0[16]软件的邻接法(Neighbor-Joining)进行。
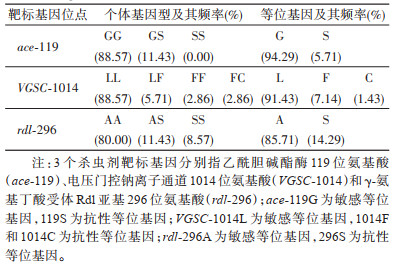
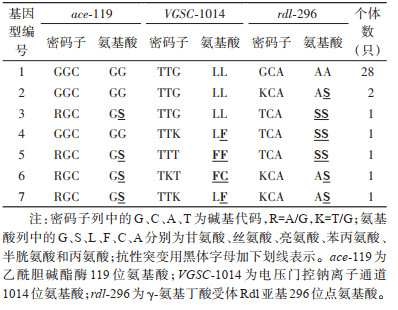
2 结果 2.1 中华按蚊杀虫剂靶标基因个体基因型与频率本研究通过DNA测序检测了乙酰胆碱酯酶ace、电压门控钠离子通道VGSC以及GABA受体Rdl亚基rdl基因抗性相关位点的基因型。35只雌蚊中,检测到抗性突变有7只,占检测个体总数的20.00%,其中3个靶标均发生突变的个体有3只,同时携带2个靶标突变的有2只。见表 2。
|
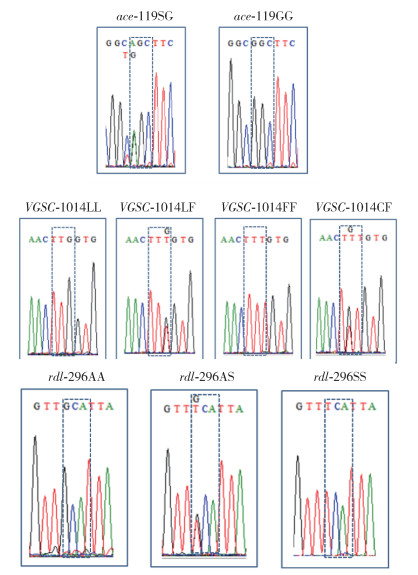
Ace基因119位点发现2种基因型(图 1,表 2、3),即119GG野生纯合子(密码子为GGC)和119GS抗性杂合型(密码子是AGC/GGC),未检测到119SS抗性纯合子(AGC),其中119GG基因型频率为88.57%,119GS为11.43%;ace抗性等位基因(ace-119S)频率为5.71%,敏感等位基因(ace-119G)频率为94.29%。
|
| 注:3个杀虫剂靶标基因分别指乙酰胆碱酯酶119位氨基酸(ace-119)、电压门控钠离子通道1014位氨基酸(VGSC-1014)和γ-氨基丁酸受体Rdl亚基296位氨基酸(rdl-296)。ace-119SG为杂合基因型,ace-119GG为敏感基因型;VGSC-1014LL为敏感基因型,1014LF为杂合基因型,1014FF和1014FC为抗性基因型;rdl-296AA为敏感基因型,rdl-296AS为杂合基因型,rdl-296SS为抗性基因型。 图 1 3个杀虫剂靶标基因抗药性相关位点的基因 Figure 1 Genotypes of insecticide resistance-related loci in the three target genes |
| |
VGSC基因发现4种基因型(图 1,表 2、3),LL敏感纯合、LF敏感与抗性杂合、FF抗性纯合以及FC抗性杂合子的频率分别为88.57%、5.71%、2.86%和2.86%,未检测到理论上可能存在的LC抗性杂合子和CC抗性纯合子;VASC1014L敏感等位基因、1014F抗性等位基因和1014C抗性等位基因频率分别为91.43%、7.14%和1.43%。
Rdl基因有3种基因型(图 1,表 2、3),敏感纯合(AA)、杂合(AS)和抗性(SS)纯合子的频率分别为80.00%、11.43%和8.57%,敏感(rdl-296A)和抗性(rdl-296S)等位基因频率分别为85.71%和14.29%。
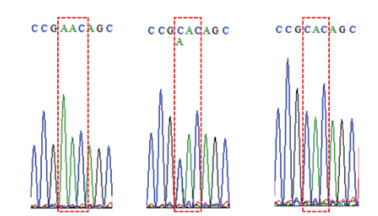
2.2 中华按蚊杀虫剂靶标基因的DNA序列分析通过分析ace基因片段的DNA序列发现(图 2、3),内含子3存在长度多态性:在31只个体的测序数据中,发现3种不同长度的内含子(35只检测的个体中的另4只个体因杂合无法获得其内含子长度信息),其长度分别为61、68和81 bp,占比分别为9.68%、6.45%和83.87%。值得注意的是,内含子3的长度为61 bp的个体均携带119S抗性突变。从10条内含子序列纯合的序列中鉴定出5种不同的单倍型(aceH1~aceH5),其中aceH2在携带119G抗体突变的个体中检测到。

|
| 图 2 乙酰胆碱酯酶基因内含子3的代表性序列比对 Figure 2 Alignment of the representative sequences of intron 3 of the acetylcholinesterase gene |
| |
|
| 图 3 乙酰胆碱酯酶基因第65位密码子第1位核苷酸差异 Figure 3 Variation of the first nucleotide of codon 65 in the acetylcholinesterase gene |
| |
长度为662 bp的外显子区比对分析发现45个核苷酸多态位点,其中43个核苷酸差异为无义突变;除了抗性相关的119位点突变外,还发现另一有义突变,即第65位的天冬酰胺(N,密码子为AAC)替换为组氨酸(H,密码子为CAC)。
从35只个体VASC基因片段(265 bp)检测到34个多态位点,其中外显子(159 bp+42 bp)区发现15个多态位点,除1014位密码子的第2与第3位的碱基差异可以导致氨基酸替换外,其他多态位点为无义突变。在第20号内含子区(64 bp)发现19个多态位点。从这些序列中共鉴定出7个不同的单倍型,其中kdr 1-1014L频数最高,达26个。分子进化树显示,携带1014F抗性等位基因的个体分布在2个不同亚支(kdr 7a、kdr 21、kdr 28)。见图 4。
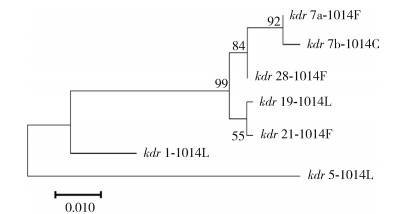
|
| 注:序列编号格式为kdr之后的数字为样品的编号,短横线后为等位基因型。 图 4 钠离子通道基因单倍型的分子进化树(邻接法) Figure 4 The molecular evolutionary tree of the voltage-gated sodium channel haplotypes using the neighbor-joining method |
| |
Rdl基因DNA序列比对分析发现,在外显子区(212 bp)只有1个多态位点,该位点核苷酸变异,可以导致A296S氨基酸替换。在内含子区(存在209和210 bp 2种长度)检测到13个差异位点,基于20只个体的24条内含子序列数据鉴定出7种不同的单倍型。进化树分析显示,抗性(296S)与敏感(296A)等位基因分别位于2个不同的分支中。见图 5。
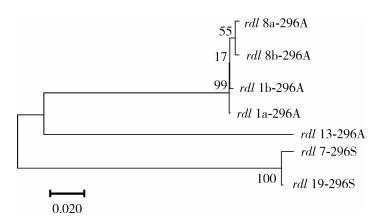
|
| 图 5 γ-氨基丁酸受体Rdl亚基基因单倍型的分子进化树(邻接法) Figure 5 The molecular evolutionary tree of the gamma-amino butyric acid receptor Rdl subunit haplotypes using the neighbor-joining method |
| |
本研究对四川省广元市采集的中华按蚊的杀虫剂靶标基因存在的抗性突变进行了检测。在检测的35只个体中携带抗性突变的个体占20.00%,3个靶标编码基因的抗性等位基因频率均在15.00%以下,抗性纯合子的比例 < 10.00%,据此推测该地区中华按蚊种群目前的靶标抗性水平较低。从另一角度看,该中华按蚊种群存在一定比例的抗性等位基因,具有向高水平抗性发展的遗传基础,随着杀虫剂使用次数和强度的加大,中华按蚊的抗药性有可能快速上升。虽然该中华按蚊种群携带抗性突变的个体所占比例不高(20.00%),但这些抗性个体中70.00%以上存在多靶标基因突变,一旦携带多靶标突变的个体在种群中比例上升,将导致对多种不同类型杀虫剂的抗性,给防治带来困难,因此需要加强该地区中华按蚊抗性基因频率的监测。
通过对3个基因片段的测序分析发现,该3个杀虫剂靶标蛋白的编码基因都表现出丰富的个体多态性,存在数量较多的核苷酸多态位点。值得注意的是,本次检测的35只样本中,携带抗性突变个体的ace基因内含子长度均为61 bp,且VGSC和rdl基因的抗性单倍型与敏感单倍型位于分子进化树的不同分支,这一结果表明携带抗性突变个体与占多数的不携带抗性突变的个体的遗传背景差异较大,提示这些抗性个体可能是外迁而来。广元市旅游业发达,随着人流物流的增加,也加大了蚊虫及其携带的抗性基因的迁入可能性,因此加强物流的管理,防范抗性基因的入侵也应该是抗药性监测与治理的重要内容。
广元市环境类型和用药历史不同地区有所不同,在理论上不同地区的中华按蚊的遗传背景和抗药性状况也会有差异,本研究是针对1个特定地点中华按蚊抗性突变的检测,不足以代表广元市的全貌。但本研究检测到了一定频率的多靶标抗性突变,警示抗药性风险的存在,因此在本地区开展范围更大、覆盖更多环境类型和样本数的生物测定以及抗性基因突变的调查工作显得十分必要。鉴于近年来广元市致力打造康养产业链,作为全国康养十强地级市,未来几年的人口迁入量和物流量有增长的可能性,在中华按蚊抗药性监测的基础上,做好本地蚊虫控制的同时,还要加强关口管理,减少外来抗性蚊虫的入侵。
志谢 本研究得到中国科学院动物研究所硕士研究生刘念的大力 帮助,谨此志谢利益冲突 无
| [1] |
World Health Organization. World malaria report 2019[R]. Geneva, Switzerland: World Health Organization, 2019: 4.
|
| [2] |
梁裕芬. 我国常见虫媒寄生虫病流行概况[J]. 生物学教学, 2020, 45(9): 76-78. Liang YF. Prevalence of common vector-borne parasitic diseases in China[J]. Biol Teach, 2020, 45(9): 76-78. |
| [3] |
中华人民共和国卫生部疾病预防控制局. 疟疾防治手册[M]. 3版. 北京: 人民卫生出版社, 2007: 47-135. Bureau of Disease Control and Prevention, Ministry of Health, PRC. Malaria control handbook[M]. 3rd ed. Beijing: People's Medical Publishing House, 2007: 47-135. |
| [4] |
Wilkerson RC, Li C, Rueda LM, et a1. Molecular confirmation of Anopheles (Anopheles) lesteri from the Republic of South Korea and its genetic identity with An. (Ano.) anthropophagus from China (Diptera: Culicidae)[J]. Zootaxa, 2003, 378: 1-14. DOI:10.11646/zootaxa.378.1.1 |
| [5] |
华亚琼, 闫振天, 付文博, 等. 中国按蚊属(双翅目: 蚊科)分类研究进展[J]. 重庆师范大学学报(自然科学版), 2015, 32(2): 23-31. Hua YQ, Yan ZT, Fu WB, et al. Progress of the taxonomic research of the genus Anopheles (Diptera Culicidae) in China[J]. J Chongqing Normal Univ: Natural Science, 2015, 32(2): 23-31. DOI:10.11721/cqnuj20150205 |
| [6] |
World Health Organization. World malaria report 2018[R]. Geneva, Switzerland: World Health Organization, 2018: xii-xiii.
|
| [7] |
Zhou D, Zhang DH, Ding GH, et al. Genome sequence of Anopheles sinensis provides insight into genetics basis of mosquito competence for malaria parasites[J]. BMC Genomics, 2014, 15(1): 42. DOI:10.1186/1471-2164-15-42 |
| [8] |
Feng XY, Yang C, Yang YC, et al. Distribution and frequency of G119S mutation in ace-1 gene within Anopheles sinensis populations from Guangxi, China[J]. Malar J, 2015, 14(1): 470. DOI:10.1186/s12936-015-1000-0 |
| [9] |
Yang C, Feng XY, Liu N, et al. Target-site mutations (AChE-G119S and kdr) in Guangxi Anopheles sinensis populations along the China-Vietnam border[J]. Parasit Vectors, 2019, 12(1): 77-83. DOI:10.1186/s13071-019-3298-x |
| [10] |
Yang C, Feng XY, Huang ZS, et al. Diversity and frequency of kdr mutations within Anopheles sinensis populations from Guangxi, China[J]. Malar J, 2016, 15(1): 411. DOI:10.1186/s12936-016-1467-3 |
| [11] |
Du W, Awolola TS, Howell P, et al. Independent mutations in the rdl locus confer dieldrin resistance to Anopheles gambiae and An. arabiensis[J]. Insect Mol Biol, 2005, 14(2): 179-183. DOI:10.1111/j.1365-2583.2005.00544.x |
| [12] |
Liu N, Feng XY, Qiu XH. Rdl mutations in Guangxi Anopheles sinensis populations along the China-Vietnam border: distribution frequency and evolutionary origin of A296S resistance allele[J]. Malar J, 2020, 19: 23. DOI:10.1186/s12936-020-3098-y |
| [13] |
Yang C, Huang ZS, Li M, et al. Rdl mutations predict multiple insecticide resistance in Anopheles sinensis in Guangxi, China[J]. Malar J, 2017, 16(1): 482. DOI:10.1186/s12936-017-2133-0 |
| [14] |
贾永朝, 杨研, 罗兴, 等. 2015年广元市白纹伊蚊抗药性监测分析[J]. 寄生虫病与感染性疾病, 2018, 16(1): 41-43. Jia YC, Yang Y, Luo X, et al. Monitoring and analysis of drug resistance of Aedes albopictus in Guangyuan in 2015[J]. Parasit Infect Dis, 2018, 16(1): 41-43. |
| [15] |
Rinkevich FD, Zhang L, Hamm RL, et al. Frequencies of the pyrethroid resistance alleles of Vssc1 and CYP6D1 in house flies from the eastern United States[J]. Insect Mol Biol, 2006, 15(2): 157-167. DOI:10.1111/j.1365-2583.2006.00620.x |
| [16] |
Kumar S, Stecher G, Tamura K. MEGA7:Molecular evolutionary genetics analysis version 7.0 for bigger datasets[J]. Molecular Biol Evol, 2016, 33(7): 1870-1874. DOI:10.1093/molbev/msw054 |
 2021, Vol. 32
2021, Vol. 32