扩展功能
文章信息
- 邢云天, 戴建荣, 曲国立, 梁幼生, 张苏阳, 冯柏年
- XING Yun-tian, DAI Jian-rong, QU Guo-li, LIANG You-sheng, ZHANG Su-yang, FENG Bai-nian
- 日本血吸虫中间宿主钉螺浸杀法给药后螺体内氯硝柳胺含量的变化研究
- Change in the content of niclosamide in Oncomelania hupensis, the intermediate host of Schistosoma japonicum, after treatment with the immersion killing method
- 中国媒介生物学及控制杂志, 2021, 32(4): 441-446
- Chin J Vector Biol & Control, 2021, 32(4): 441-446
- 10.11853/j.issn.1003.8280.2021.04.011
-
文章历史
- 收稿日期: 2020-12-23
2 国家卫生健康委员会寄生虫病预防和控制技术重点实验室, 江苏省 寄生虫与媒介控制技术重点实验室, 江苏省血吸虫病防治研究所, 江苏无锡 214064
2 National Health Commission Key Laboratory of Parasitic Disease Control and Prevention, Jiangsu Provincial Key Laboratory of Parasite and Vector Control Technology, Jiangsu Institute of Parasitic Diseases, Wuxi, Jiangsu 214064, China
氯硝柳胺是世界卫生组织(WHO)推荐唯一现场应用的杀螺药物[1-3]。虽然氯硝柳胺杀螺机制并不十分明确,但氯硝柳胺必须进入钉螺(Oncomelania hupensis)体内,作用于钉螺体内的靶分子或靶器官,才能导致钉螺死亡。因而,杀螺效果与进入螺体内药物的含量密切相关[4]。有关钉螺体内氯硝柳胺的含量检测及给药后药物含量随时间的变化尚未见报道。掌握钉螺体内氯硝柳胺含量的变化情况,可更科学地指导氯硝柳胺新剂型和增效剂的研制。检测氯硝柳胺的方法有比色法、高效液相色谱法(HPLC)、高效液相-质谱法等[5-6]。比色法精密度相对较低,检测限高,抗干扰能力差;质谱法检测仪器昂贵,测试费用高;而HPLC具有快速、稳定、可靠的特点,所以得以迅速普及。而且HPLC对样品前处理要求低,检测费用适中[7-8]。基于以上原因,本研究将建立HPLC检测钉螺体内氯硝柳胺含量的方法,并且测定给药后不同时间钉螺体内氯硝柳胺含量的变化,以期为研制氯硝柳胺新剂型和增效剂奠定基础。
1 材料与方法 1.1 材料 1.1.1 仪器高效液相色谱仪Agilent 1260(美国安捷伦公司),pH仪(瑞士梅特勒-托利多国际有限公司),分析天平(瑞士梅特勒-托利多国际有限公司),纯水仪(美国密理博公司),小型冷冻干燥仪(美国Labconco公司),试管震荡混匀器(美国赛默飞世尔科技公司),冷冻粉碎机CryoMill(德国莱驰公司)。
1.1.2 试剂氯硝柳胺(纯度 > 98%,生产批号:G144245),德国Dr. Ehrenstorfer GmbH公司生产;高纯氮气购自于无锡辉荣气站;甲醇(色谱纯,生产批号:201208),美国Fisher公司生产;乙酸(分析纯,生产批号:20190313)和二氯甲烷(分析纯,生产批号:20170417)购自于国药集团化学试剂公司。
1.1.3 钉螺现场采集的钉螺,实验室饲养1周,选取体质量39.00~41.00 mg的钉螺进行实验。
1.2 方法 1.2.1 HPLC的建立 1.2.1.1 色谱条件色谱柱:ZORBAX SB-C18,4.6×250 mm不锈钢柱,粒径5 μm;柱温:室温25 ℃;流动相:甲醇∶水=90∶10(体积分数),pH=4,经0.22 μm孔径滤膜过滤;检测波长为330 nm;流速为1.0 ml/min;进样体积为20 μl。
1.2.1.2 线性关系和检出限将3.12 mg/L的对照品溶液分别稀释成1.56、0.78、0.39、0.20、0.10和0.05 mg/L的标准溶液,按上述色谱条件测定。以浓度为自变量,峰面积为应变量进行线性回归。稀释标准溶液,当氯硝柳胺峰高信号和基线噪音信号比值为3时,作为检出限;当氯硝柳胺峰高信号和基线噪音信号比值为10时,作为定量限。
1.2.1.3 精密度和回收率取0.10 ml浓度为20.00、2.00和0.20 mg/L的氯硝柳胺标准品的甲醇溶液,加入到500 mg未接触药液冷冻干燥后的钉螺中,制备成含量为4.00、0.40和0.04 μg/g的样品,每个浓度组制备7个样品,按照下述计算方法测定含量,用氯硝柳胺含量计算精密度和回收率。
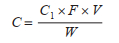
|
(1) |
式中,C表示钉螺体内氯硝柳胺含量,C1表示复溶液氯硝柳胺浓度,F表示稀释倍数,V表示复溶液体积,W表示钉螺干重。
1.2.2 样品前处理方法将每组10只待测钉螺样品冷冻干燥后,称重,放入2 ml研磨管中,加入1粒ϕ2 mm钢制研磨珠,置于冷冻粉碎机中,以30 Hz的频率,液氮粉碎5 min。将1 ml含有4%乙酸的二氯化碳溶液加入到研磨管中,超声萃取10 min,然后用离心半径为8.35 cm,8 000 r/min离心10 min,取上清。将上清液30 ℃下氮气吹干并用1 ml流动相复溶,再经0.22 μm滤膜过滤,HPLC测定含量,按照公式(1)计算钉螺体内药物含量。
1.2.3 样品制备 1.2.3.1 螺壳表面氯硝柳胺的清洗配制50.00 mg/L氯硝柳胺的甲醇溶液,用微量移液器将上述溶液滴加在钉螺外壳上,每只钉螺滴加2 μl,共处理钉螺30只,随机分成3组,每组10只。然后将钉螺放置于96孔板中(每孔1只),置于4 ℃冰箱9 h,减少钉螺活动,防止钉螺软体接触到外壳的药液。取出钉螺后用500 ml自来水清洗3次,吸水纸吸干钉螺壳外的水渍,-40 ℃保存,做为清洗后螺壳表面残留的药物是否会影响检测结果的检测样本。
1.2.3.2 样品制备配制浓度为8.00、2.00、0.50和0.12 mg/L的氯硝柳胺水溶液,取钉螺1 080只,分成108组,每组10只钉螺放置于含有90 ml药液的100 ml烧杯中,液面位置放置尼龙网,防止钉螺逃逸。分别在2、20、40、60、120、180、300、420和540 min取出钉螺,每个浓度取出3组钉螺,用500 ml自来水清洗3次,吸水纸吸干钉螺壳外的水渍,-40 ℃冷冻保存,做为测定钉螺体内氯硝柳胺含量实验的检测样本。
1.3 杀螺效果配制浓度为8.00、2.00、0.50和0.12 mg/L的氯硝柳胺水溶液,取钉螺1 350只,分成135组,每组10只钉螺放置于含有90 ml药液的100 ml烧杯中,液面位置放置尼龙网,防止钉螺逃逸,另设脱氯水为空白对照。分别在2、20、40、60、120、180、300、420和540min取出钉螺,每个浓度取出3组,用脱氯水清洗3次,吸水纸吸干钉螺壳外的水渍,脱氯水浸泡1 h,恢复饲养48 h后,敲击法判断钉螺死亡数。
2 结果 2.1 空白图谱和空白加样图谱在1.2.1.1的色谱条件下,氯硝柳胺出峰时间为9.21 min,无其他杂峰干扰(图 1),最低检出限为0.01 mg/L,最低定量限为0.05 mg/L。回归方程为A=45.499x+0.593(R2=0.99,n=7),其中A为色谱峰面积,x为氯硝柳胺浓度。在0.05~3.12 mg/L范围内线性良好。

|
| 注:a添加氯硝柳胺标准品后的样品;b空白样品。 图 1 添加氯硝柳胺标准品和空白样品的色谱图 Figure 1 Chromatogram of blank samples and samples added with niclosamide standard solution |
| |
为避免螺壳表面的氯硝柳胺影响实验结果,本研究采用1.2.3.1的方法对钉螺的螺壳进行清洗,按照样品前处理方法对钉螺进行处理,经HPLC法检测,未测到氯硝柳胺。加标样品前处理的回收率为99.64%~110.36%(表 1),精密度在3.97%~6.49%之间,相对标准偏差 < 10.00%,满足测定要求。
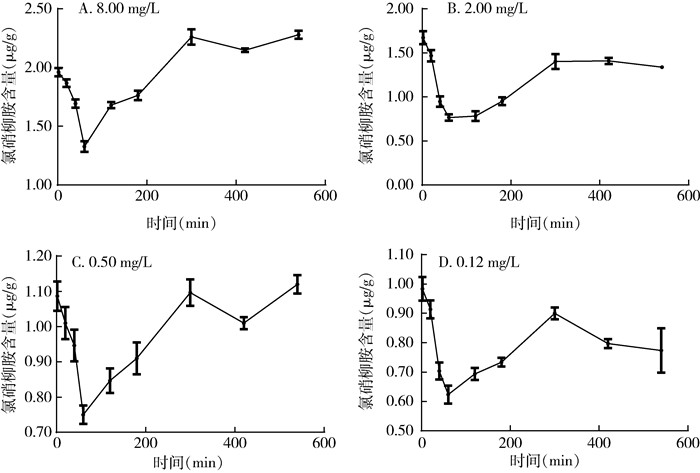
钉螺在接触浓度为8.00、2.00、0.50和0.12 mg/L的氯硝柳胺2 min时,体内药物含量达到最高,分别为1.96、1.67、1.08和0.98 μg/g;死亡率分别为33.33%、36.67%、16.67%和0。各浓度组在60 min后降至最低点,分别为1.32、0.76、0.75和0.62 μg/g,然后均有一定程度的升高(图 2)。浓度为8.00和2.00 mg/L的药液杀死100%钉螺所需时间分别为3和7 h;浓度为0.50和0.12 mg/L作用9 h时钉螺死亡率分别为60.00%和46.67%。见表 2。
|
| 图 2 不同浓度药液中钉螺体内氯硝柳胺含量的变化 Figure 2 Change in the content of niclosamide in Oncomelania hupensis immersed in different concentrations of niclosamide |
| |

|
样品前处理方法是决定检测方法的重现性、稳定性和准确性的重要环节。钉螺体积较小,解剖钉螺费时费力。在解剖的过程中难免有钉螺的淋巴液和组织液流出至载玻片上,造成所取样品的不均一,可导致分析结果的波动[9-10]。因此本研究采取将整个钉螺粉碎的方法,进行药物含量测定,减少在样品制备环节产生的误差。
为确证清洗后螺壳上残留的氯硝柳胺不影响螺体内氯硝柳胺含量的检测结果,本研究首先在空白钉螺螺壳表面滴加氯硝柳胺标准品,然后4 ℃单独饲养,以减少钉螺活动,防止钉螺头、足接触到螺壳上的氯硝柳胺。将处理过的钉螺饲养9 h后,用500 ml自来水清洗3次,经过样品前处理及上机检测,未检出氯硝柳胺,表明该方法可去除螺壳上的氯硝柳胺对检测结果的影响。
在样品的制备部分,由于氯硝柳胺在有光照和水的条件下可快速降解,冷冻干燥可在低温下去除样品中的水分,减少处理过程中氯硝柳胺的降解[11-13]。因此本研究对经氯硝柳胺处理过的钉螺进行冷冻干燥,在此过程中,样品中的水分可以被去除,样品的脆性大大增加,有利于韧性大的组织粉碎。在预实验中选取了3种研磨珠对钉螺进行处理,分别是陶瓷、玻璃和钢制研磨珠,实验中发现陶瓷研磨珠和玻璃研磨珠密度小,难以粉碎厣等高韧性角质。ϕ2 mm的钢制研磨珠,在液氮条件下对钉螺进行冷冻粉碎,粉碎效果良好。萃取溶剂选择贾悦[11]报道的方法,采用4%乙酸的二氯化碳溶液,超声萃取,回收率和精密度均能满足测定要求。
目前国内外对氯硝柳胺药效的研究主要集中在药物剂型、施药方法、给药环境和钉螺螺龄等方面,其中以氯硝柳胺的剂型研究最多,包括缓释剂、悬浮剂和粉剂等,不同剂型的氯硝柳胺杀螺效果也不同,但对于施药后钉螺体内药物含量的变化尚未见报道[14-18]。杀螺效果与进入螺体内药物的量密切相关。因此本研究建立的钉螺体内氯硝柳胺含量的检测方法,可以为今后氯硝柳胺制剂的研制提供数据支撑。
钉螺由外壳和软体构成,头、颈、足部可通过壳口伸出壳外进行活动;钉螺属于有厣螺类,钉螺的厣为角质,附于腹足后面。厣可以缩入螺壳,与螺壳形成封闭的空间,可起到保护作用[19]。由于钉螺特殊的结构,药物无法通过厣和外壳进入螺体内,只能通过头、颈和足吸收进入体内。钉螺在接触不同浓度的药液2 min时,体内药物的含量均达到最高值,这可能是因为钉螺接触药液后通过其鳃和口主动吞噬、过滤或经由头、颈、足吸收进入体内产生了一个药物浓度高峰。钉螺在接触药物后受到刺激,将头、颈、足缩回壳内,并闭合厣,同时,其体内的氯硝柳胺在多种酶的作用下发生氧化还原、水解、与氨基酸葡萄糖酸醛等结合的反应,因此在大约60 min内,药物浓度逐渐降低。由于外界药物无法进入钉螺体内,而螺体内原有的药物因代谢而减少,使得60 min内时,螺体内的药物含量最低。在钉螺接触药物120 min后,各浓度组钉螺死亡率均 > 33.33%,钉螺可能已经由于药物的作用产生器官衰竭、酶活性降低或“昏迷”等状况[20]。在这种状况下,头、足失去张力,厣闭合不紧,对外界的反应消失,体外的药物可通过扩散而非主动摄取的方式进入到螺体内,体内药物代谢的速率减慢,使得螺体内药物含量缓慢升高。钉螺的特殊结构和代谢酶的活性是否是产生此现象的原因,有待于进一步研究。
利益冲突 无
| [1] |
Dai JR, Wang W, Liang YS, et al. A novel molluscicidal formulation of niclosamide[J]. Parasitol Res, 2008, 103(2): 405-412. DOI:10.1007/s00436-008-0988-2 |
| [2] |
Yang GJ, Li W, Sun LP, et al. Molluscicidal efficacies of different formulations of niclosamide: result of meta-analysis of Chinese literature[J]. Parasit Vectors, 2010, 3(1): 84. DOI:10.1186/1756-3305-3-84 |
| [3] |
神学慧, 戴建荣, 王琳, 等. 5%杀螺胺乙醇胺盐颗粒剂在不同环境中的灭螺效果评价[J]. 中国媒介生物学及控制杂志, 2020, 31(4): 497-501. Shen XH, Dai JR, Wang L, et al. Molluscicidal effects of 5% niclosamide ethanolamine granules in different environments[J]. Chin J Vector Boil Control, 2020, 31(4): 497-501. DOI:10.11853/j.issn.1003.8280.2020.04.026 |
| [4] |
吴建华, 刘美红, 李帅岚, 等. 灭钉螺药物作用机制的研究进展[J]. 中国媒介生物学及控制杂志, 2019, 30(3): 356-360. Wu JH, Liu MH, Li SL, et al. Research advances in the mechanism of action of molluscicides in eliminating Oncomelania snails[J]. Chin J Vector Biol Control, 2019, 30(3): 356-360. DOI:10.11853/j.issn.1003.8280.2019.03.032 |
| [5] |
Paghadar C, Vadia NH. Development and validation of stability indicating RP-HPLC and HPTLC for determination of niclosamide in bulk and in synthetic mixture[J]. Arab J Chem, 2019, 12(8): 1803-1814. DOI:10.1016/j.arabjc.2014.11.064 |
| [6] |
万译文, 黄向荣, 李小玲, 等. 高效液相色谱-质谱/质谱联用法检测渔业水体中氯硝柳胺[J]. 分析试验室, 2015, 34(1): 53-56. Wan YW, Huang XR, Li XL, et al. Simultaneous determination of niclosamide in fishery water by high performance liquid chromatographytandem mass spectrometry[J]. Chin J Anal Lab, 2015, 34(1): 53-56. DOI:10.13595/j.cnki.issn1000-0720.2015.0012 |
| [7] |
刘永涛, 沈丹怡, 董靖, 等. 同位素稀释高效液相色谱-串联质谱法测定水体、底泥、鱼及虾中氯硝柳胺残留量[J]. 分析测试学报, 2020, 39(8): 980-985. Liu YT, Shen DY, Dong J, et al. Determination of niclosamide in water, sediment, fish and shrimp by HPLC-MS/MS method with isotope dilution[J]. J Instrum Anal, 2020, 39(8): 980-985. DOI:10.3969/j.issn.1004-4957.2020.08.006 |
| [8] |
邢云天, 李幼子, 李洪军, 等. 氯硝柳胺水样保存条件的研究[J]. 中国血吸虫病防治杂志, 2011, 23(2): 133-137. Xing YT, Li YZ, Li HJ, et al. Study on preservation of niclosamide in water samples[J]. Chin J Schisto Control, 2011, 23(2): 133-137. DOI:10.3969/j.issn.1005-6661.2011.02.007 |
| [9] |
谭苹, 于志君. 湖北钉螺中枢神经节的解剖方法[J]. 中国寄生虫学与寄生虫病杂志, 2015, 33(5): 350-351. Tan P, Yu ZJ. The anatomical method of isolating central ganglia from Oncomelania hupensis[J]. Chin J Parasitol Parasit Dis, 2015, 33(5): 350-351. |
| [10] |
何亮才, 王加松, 李华忠, 等. 钉螺压碎器批量检测钉螺应用效果[J]. 中国血吸虫病防治杂志, 2015, 27(2): 195-196, 205. He LC, Wang JS, Li HZ, et al. Application effect of Oncomelania hupensis snail crushers in batch detection[J]. Chin J Schisto Control, 2015, 27(2): 195-196, 205. DOI:10.16250/j.32.1374.2014134 |
| [11] |
贾悦. 氯硝柳胺的降解及其影响因素的研究[D]. 无锡: 江苏省血吸虫病防治研究所, 2013. Jia Y. Study on degradation and affecting factors of niclosamide[D]. Wuxi: Jiangsu Institute of Parasitic Diseases, 2013. |
| [12] |
王晗, 徐世芳, 陈爱瑛, 等. 分析化学方法研究螺灭杀的水体降解动态[J]. 中国媒介生物学及控制杂志, 2010, 21(5): 445-447. Wang H, Xu SF, Chen AY, et al. Study of degradation dynamics of luomiecide in water by analytical chemistry method[J]. Chin J Vector Biol Control, 2010, 21(5): 445-447. |
| [13] |
曹建平, 李洪军, 廖慨, 等. 氯硝柳胺乙醇胺盐降解规律研究Ⅱ同位素示踪及光解终产物含量测定[J]. 中国血吸虫病防治杂志, 2010, 22(3): 251-254. Cao JP, Li HJ, Liao K, et al. Studies on degradation mechanism of niclosamide ethanolamine salt Ⅱ Isotopic tracing and determination of photolysis end-product[J]. Chin J Schisto Control, 2010, 22(3): 251-254. DOI:10.3969/j.issn.1005-6661.2010.03.015 |
| [14] |
贾悦, 邢云天, 戴建荣, 等. 土壤中氯硝柳胺降解影响因素的研究[J]. 中国血吸虫病防治杂志, 2020, 32(6): 559-564. Jia Y, Xing YT, Dai JR, et al. Study on the factors affecting the degradation of niclosamide in the soil[J]. Chin J Schisto Control, 2020, 32(6): 559-564. DOI:10.16250/j.32.1374.2019169 |
| [15] |
元艺, 蔡顺祥, 贺正文, 等. 50%杀螺胺乙醇胺盐悬浮剂灭螺效果评价[J]. 中国血吸虫病防治杂志, 2017, 29(4): 416-419, 435. Yuan Y, Cai SX, He ZW, et al. Molluscicidal effect of suspension concentrate of niclosamide ethanolamine salt[J]. Chin J Schisto Control, 2017, 29(4): 416-419, 435. DOI:10.16250/j.32.1374.2016269 |
| [16] |
李伟, 游本荣, 施亮, 等. 氯硝柳胺乙醇胺盐不同剂型在江滩地区灭螺效果[J]. 中国血吸虫病防治杂志, 2018, 30(5): 540-543. Li W, You BR, Shi L, et al. Molluscicidal effects of different formulations of niclosamide ethanolamine salt in marshlands[J]. Chin J Schisto Control, 2018, 30(5): 540-543. DOI:10.16250/j.32.1374.2018095 |
| [17] |
杨国静, 孙乐平, 吴锋, 等. 50%氯硝柳胺乙醇胺盐可湿性粉剂现场灭螺效果的Meta分析[J]. 中国血吸虫病防治杂志, 2010, 22(6): 579-582. Yang GJ, Sun LP, Wu F, et al. Meta analysis of molluscicidal effect of 50% wettable powder of niclosamide ethanolamine salt in field[J]. Chin J Schisto Control, 2010, 22(6): 579-582. DOI:10.3969/j.issn.1005-6661.2010.06.014 |
| [18] |
游本荣, 黄轶昕, 胡恒光, 等. 氯硝柳胺乙醇胺盐粉粒剂杀钉螺效果[J]. 中国血吸虫病防治杂志, 2016, 28(3): 237-240, 326. You BR, Huang YX, Hu HG, et al. Molluscicidal effect of niclosamide ethanolamine salt powder-granula against Oncomelania hupensis[J]. Chin J Schisto Control, 2016, 28(3): 237-240, 326. DOI:10.16250/j.32.1374.2016046 |
| [19] |
周晓农. 实用钉螺学[M]. 北京: 科学出版社, 2005: 28-33. Zhou XN. Science on Oncomelania snail[M]. Beijing: Science Press, 2005: 28-33. |
| [20] |
杨柳. 湖北钉螺形态与结构变化关系及存活率的研究[D]. 武汉: 湖北大学, 2011. Yang L. The relationship of Oncomelania hupensis morphology and structure development change and the survival rate[D]. Wuhan: Hubei University, 2011. |
 2021, Vol. 32
2021, Vol. 32