扩展功能
文章信息
- 王洋, 刘宏美, 郭秀霞, 宋晓, 王海洋, 程鹏, 王海防, 王怀位, 公茂庆
- WANG Yang, LIU Hong-mei, GUO Xiu-xia, SONG Xiao, WANG Hai-yang, CHENG Peng, WANG Hai-fang, WANG Huai-wei, GONG Mao-qing
- 淡色库蚊表皮蛋白CpCPR117基因克隆及表达分析
- Molecular cloning and expression analysis of cuticular protein gene CpCPR117 in Culex pipiens pallens
- 中国媒介生物学及控制杂志, 2021, 32(4): 436-440
- Chin J Vector Biol & Control, 2021, 32(4): 436-440
- 10.11853/j.issn.1003.8280.2021.04.010
-
文章历史
- 收稿日期: 2020-10-12
淡色库蚊(Culex pipiens pallens)主要分布在我国北方地区,骚扰性强,是主要的家栖型蚊虫之一。同时,淡色库蚊是班氏丝虫病的主要传播媒介,严重危害着人类健康。目前,化学防治一直是媒介蚊虫治理的主要手段,拟除虫菊酯类杀虫剂因其具有高效、广谱、低毒和易生物降解而被广泛使用,但化学杀虫剂的长期选择作用导致了蚊虫对杀虫剂抗药性的产生与发展,我国多个地区淡色库蚊已对拟除虫菊酯类杀虫剂达到了较高的抗性水平[1-3]。目前已经公认的蚊虫抗药性机制主要有4种,即代谢抗性、靶标抗性、表皮抗性和行为抗性[4]。其中,表皮抗性是指蚊虫可通过表皮增厚或改变表皮的组成来减缓杀虫剂的渗透,从而提升自身抗药性[5-6]。表皮不仅塑造了蚊虫的体型,而且提供了保护降低其所受环境压力,如物理伤害、脱水、病原微生物和杀虫剂。本实验室前期从淡色库蚊氯氰菊酯抗性品系RNA-seq数据库中筛选出显著差异表达的表皮蛋白CpCPR117基因,并预测该基因与蚊虫抗药性相关[7]。本文通过克隆获得淡色库蚊CpCPR117基因序列,采用实时荧光定量PCR(quantitative real-time PCR,RT-qPCR)分析该基因在淡色库蚊敏感和抗性品系不同发育阶段的表达差异,旨在为研究蚊虫表皮蛋白基因参与抗药性形成机制奠定基础。
1 材料与方法 1.1 材料 1.1.1 蚊虫淡色库蚊敏感品系由本研究室常规饲养,未接触过任何杀虫剂,其对氯氰菊酯的半数致死浓度(LC50)为0.04 mg/L。抗性品系为本室用氯氰菊酯逐代筛选而来,LC50为7.30 mg/L,抗性系数为182.50。饲养条件:温度(25±1) ℃、光周期为14 L∶10 D、相对湿度为(70±10)%。幼虫给予酵母和猪肝粉喂食,成蚊给予10%葡萄糖水喂食,雌蚊产卵前喂食血液。
1.1.2 主要试剂总RNA提取试剂盒(Qiagen公司,德国),反转录试剂盒、DNA marker、凝胶回收试剂盒、pMD19-T载体、Escherichia coli JM109感受态细胞(宝日医生物技术有限公司,北京),2×Power Taq PCR MasterMix(百泰克生物技术有限公司,北京),质粒小提试剂盒(全式金生物技术有限公司,北京),实时荧光定量试剂盒(Roche公司,瑞士)。
1.2 方法 1.2.1 淡色库蚊RNA提取与cDNA合成将敏感和抗性品系Ⅲ龄末Ⅳ龄初幼虫混合,使用RNeasy Mini Kit提取总RNA,使用PrimeScript™ II 1st Strand cDNA Synthesis Kit反转录RNA获得cDNA模板。
1.2.2 引物设计将GenBank中已发表的致倦库蚊(Cx. pipiens quinquefasciatus)表皮蛋白基因(XM_001845883.1)作为参考序列设计淡色库蚊引物。引物序列为CpCPR117 F:5´-ATGGCATTCAAGTTCGCCGTC-3´;CpCPR117 R:5´-TTAACCGAGGATGGCCTTGC-3´。引物由生工生物工程(上海)股份有限公司合成。反应体系:2×MasterMix 25 μl,正、反向引物各1 μl,模板cDNA 2 μl,ddH2O 21 μl。反应条件:98 ℃预变性2 min;98 ℃变性10 s,54 ℃退火15 s,72 ℃延伸1 min,共38个循环;72 ℃延伸10 min。用1.0%琼脂糖凝胶电泳鉴定PCR产物,凝胶成像仪读取结果。
1.2.3 表皮蛋白基因克隆与序列分析凝胶回收试剂盒进行回收与纯化目的基因片段,随后连接到pMD-19T载体上,连接产物转化E. coli JM109感受态细胞中,37 ℃培养过夜,挑取阳性克隆接种于LB液体培养基,摇菌培养后提取质粒送生工生物工程(上海)股份有限公司测序。在美国国立生物技术信息中心(NCBI)网站上利用BLAST工具(https://blast.ncbi.nlm.nih.gov/Blast.cgi)将测序结果与GenBank中收录的核苷酸序列进行比对分析。利用在线工具(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)对蛋白质保守结构域进行分析。利用CutProtFam-Pred(http://bioinformatics.biol.uoa.gr/CutProtFam-Pred)网站预测所属亚族。
1.2.4 同源性比对与系统发育树分析利用GENEDOC软件对淡色库蚊与致倦库蚊、白纹伊蚊(Aedes albopictus)、埃及伊蚊(Ae. aegypti)、达氏按蚊(Anopheles darlingi)等昆虫表皮蛋白(insect cuticular proteins,ICPs)的氨基酸序列进行同源性分析。利用DNAman和MEGA 5.0软件的邻接法(Neighbor-joining method)构建系统发育树。
1.2.5 RT-qPCR验证表皮蛋白基因的表达水平以淡色库蚊β-actin(GenBank登录号:AY100005.1)为内参进行RT-qPCR[7]。引物序列为β-actin F:5´-AGGACTCGTACGTCGGTGAC-3´;β-actin R:5´-TGGTGCCAGATCTTCTCTCCAT-3´。采用Primer primier 5.0软件设计CpCPR117的特异性引物,引物如下:CpCPR117 Real-F:5´-ACAACAAGGAACAGCAGGAGT-3´;CpCPR117 Real-R:5´-GTGGCTCACGGTGGACAA-3´。分别提取敏感和抗性品系各龄期(Ⅰ和Ⅱ龄幼虫、Ⅲ和Ⅳ龄幼虫、蛹、羽化3 d成蚊)的总RNA。每个样品设置3次生物学重复和3次技术重复。不同品系间基因表达差异采用SPSS 16.0软件进行独立样本t检验,P < 0.05为差异有统计学意义。
2 结果 2.1 CpCPR117基因克隆与氨基酸序列分析本研究通过对淡色库蚊转录组数据分析,以特异性引物扩增获得与理论大小一致的条带(图 1),经测序大小为459 bp,命名为CpCPR117(GenBank登录号:MW030645.1)。开放阅读框(ORF)分析表明,开放阅读框长459 bp,编码152个氨基酸(图 2)。预测该蛋白含有表皮蛋白典型Rebers & Riddiford(R & R)保守序列结构域:Chitin_bind_4(pfam00379)。BLAST比对结果显示,测序核苷酸序列与致倦库蚊参考序列(XM_001845883.1)的一致性为97.00%。

|
| 注:M表示DNA marker;1表示淡色库蚊CpCPR117基因的PCR产物。 图 1 淡色库蚊CpCPR117基因PCR扩增结果 Figure 1 The results of PCR amplification of the CpCPR117 gene of Culex pipiens pallens |
| |

|
| 注:方框内为R & R保守序列结构域。 图 2 淡色库蚊CpCPR117基因及推导的氨基酸序列 Figure 2 The sequence of CpCPR117 gene of Culex pipiens pallens and its deduced amino acid sequence |
| |
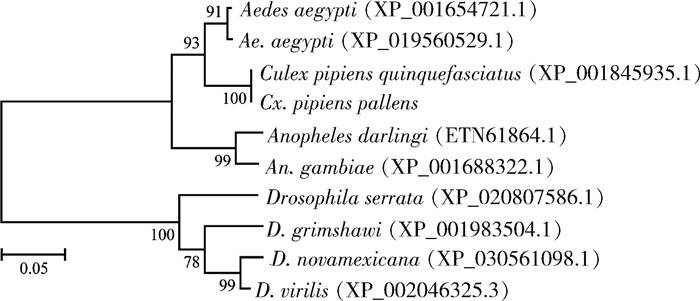
根据氨基酸序列比对结果可知,CpCPR117与致倦库蚊的ICPs氨基酸序列一致性最高,为98.00%,与白纹伊蚊、埃及伊蚊、达氏按蚊、冈比亚按蚊(An. gambiae)ICPs的一致性在80.00%~90.00%,与Drosophila serrata、D. virilis、D. novamexicana和D. grimshawi ICPs的一致性为50.00%~53.00%。
系统发育树显示淡色库蚊与致倦库蚊的遗传距离最近,在一个分支上,与埃及伊蚊、白纹伊蚊、达氏按蚊、冈比亚按蚊、D. serrata等遗传距离较远。此结果与氨基酸序列比对结果一致。见图 3。
|
| 图 3 淡色库蚊与其他昆虫表皮蛋白氨基酸序列系统发育树 Figure 3 Phylogenetic tree based on amino acid sequences of insect cuticular proteins of Culex pipiens pallens and other insects |
| |
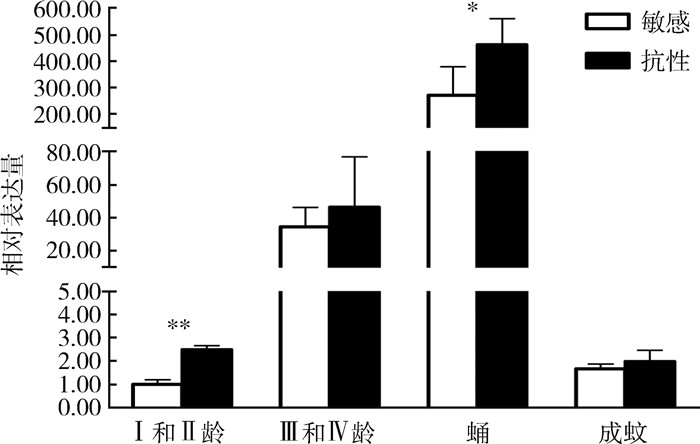
以淡色库蚊β-actin基因为内参,分别对敏感和抗性品系不同发育阶段的CpCPR117表达水平进行RT-qPCR检测。结果显示,内参基因荧光定量(β敏感和β抗性)平均每个反应管内荧光信号达到设定的阈值时所经历的循环数(Ct值)分别为18.37和18.51。CpCPR117在淡色库蚊敏感和氯氰菊酯抗性品系的各个龄期均有表达。其中,Ⅰ和Ⅱ龄幼虫和蛹期该基因在抗性品系的表达量分别是敏感品系的2.49和1.70倍,差异有统计学意义(Ⅰ和Ⅱ龄幼虫:t=-17.177,P < 0.001;蛹期:t=-3.964,P=0.001)。见图 4。
|
| 注:*P < 0.01;**P < 0.001。 图 4 淡色库蚊氯氰菊酯敏感和抗性品系不同龄期CpCPR117基因表达水平分析 Figure 4 Expression of the CpCPR117 gene in different developmental stages of cypermethrin-sensitive and cypermethrin-resistant strains of Culex pipiens pallens |
| |
表皮作为昆虫抵抗外界不利环境和外来病原体入侵的第一道屏障,由几丁质和表皮蛋白组成。同时,表皮(如节间膜、足、翅)也是杀虫剂进入昆虫体内发挥作用的主要途径,尤其对于以触杀为主的杀虫剂,如拟除虫菊酯类。研究发现,昆虫表皮对化学杀虫剂具有屏障作用、“脱靶作用”、清除作用和缓冲作用[8]。ICPs根据其保守基序的不同可以分为12个家族,如CPR、CPAPn、CPG、CPF和CPLCG等,每个家族都有其独特的结构和区别特征[9]。CPR家族是节肢动物ICPs中最大的家族,其可分为3个亚族:RR-1、RR-2和RR-3。其中,RR-1型常见于柔性表皮,RR-2型主要分布在刚性表皮,而RR-3型比较少见,目前还没有明确的定义[10-11]。本实验以淡色库蚊为研究对象,对表皮蛋白CpCPR117基因进行克隆鉴定,序列分析结果显示淡色库蚊与致倦库蚊同源蛋白一致性较高。淡色库蚊与致倦库蚊同属尖音库蚊复合组(Cx. pipiens complex),虽存在地理分布的不同,但其亲缘关系较近[12]。进一步分析显示CpCPR117具有R & R保守基序,为几丁质结合蛋白,因此属于CPR家族[13],并且可归为RR-2亚族。R & R保守基序重要生物学功能是结合几丁质,参与昆虫表皮形成[14]。
Huang等[5]发现淡色库蚊CPLCG5基因在溴氰菊酯抗性品系的表达量比敏感品系升高了8倍,CPLCG5降低显著提高了蚊虫对溴氰菊酯的敏感性并且造成了其表皮几丁质排列的改变。这种表皮厚度和结构的改变是因为一种核受体型转录因子FTZ-F1与CPLCG5启动子区域结合从而调节了CPLCG5的表达,CPLCG5表达量的增加促使蚊虫形成厚且坚固的表皮,以减少杀虫剂向体内的渗透[15]。另外,CPLCG5在淡色库蚊不同发育阶段的表达水平分析发现,其蛹期(白色蛹)和羽化1 d成蚊中表达水平较高,而在羽化3 d成蚊中表达水平却明显下降[5]。CpCPR117和CPLCG5的表达模式相似,也具有时间特异性。我们分别收集了淡色库蚊Ⅰ和Ⅱ龄幼虫、Ⅲ和Ⅳ龄幼虫、蛹期、羽化3 d成蚊,发现无论在敏感还是抗性品系中,CpCPR117的表达都随着龄期的的增长而逐渐增加,其在蛹期的表达水平最高,但在成蚊该基因又降至较低的水平。这可能是由于幼虫期、蛹期为其表皮组装和发育期,CpCPR117参与了表皮组成,而羽化3 d时成蚊表皮已基本发育成熟。进一步分析发现,Ⅰ和Ⅱ龄幼虫和蛹期该基因在敏感和抗性品系中的显著性差异表达提示其可能有助于氯氰菊酯抗药性的形成。而CpCPR117参与氯氰菊酯抗性的潜在机制可能是通过修饰表皮结构,导致杀虫剂的渗透速度减慢,从而减少杀虫剂分子在昆虫体内的数量。Sun等[16]发现CpCPR63和CpCPR47在淡色库蚊拟除虫菊酯抗性品系中表现出比在敏感品系中更高的转录水平,并且RNA干扰实验提示CpCPR63和CpCPR47之间存在交互作用,1个基因的沉默将导致另1个基因的表达下降。Balabanidou等[17]分析了拟除虫菊酯、滴滴涕(DDT)抗性和敏感品系冈比亚按蚊的足部蛋白质组学,发现ICPs的上调表达与其足部表皮增厚的表现型相一致,但是CPR8和CPR120却在抗性品系蚊虫的足部表达下调,这表明表皮蛋白有可能存在另一种尚不清楚的机制来影响杀虫剂的渗透,而非只通过表皮增厚。Ma等[18]也发现淡色库蚊CpCPR4在溴氰菊酯抗性品系低表达,显微注射该基因调控因子miR-92a的抑制剂后CpCPR4表达增加,并使蚊虫对溴氰菊酯更敏感,提示microRNA可通过对表皮蛋白基因的调控促进蚊虫抗药性的形成。但表皮蛋白在蚊虫敏感和抗性品系中存在着不同的差异表达趋势,提示该类蛋白间存在复杂的相互调节机制参与蚊虫抗药性。
化学杀虫剂极大地减少了蚊媒传播疾病在世界各地的流行,但蚊虫抗药性水平的提高限制了化学杀虫剂的使用效力。表皮抗性是一个研究不足的领域,研究其抗性机制分子基础是实施适当的抗性管理策略的关键。某些表皮蛋白的表达具有龄期特异性,如果可以在表皮尚未发育成熟前结合发育特点进行化学防治,那么杀虫剂的渗透效率会更高。但CpCPR117是否是抗性蚊虫中发挥作用的特定表皮蛋白基因,还需使用RNA干扰技术,研究该基因的抑制表达对淡色库蚊氯氰菊酯抗药性的影响。
利益冲突 无
| [1] |
宋晓, 程鹏, 王海防, 等. 鲁西南地区淡色库蚊抗药性评价[J]. 中国血吸虫病防治杂志, 2020, 32(1): 69-72. Song X, Cheng P, Wang HF, et al. Study on insecticide resistance of Culex pipiens pallens in southwest region of Shandong province[J]. Chin J Schisto Control, 2020, 32(1): 69-72. DOI:10.16250/j.32.1374.2018261 |
| [2] |
张咏梅, 王姝, 胡晓辉, 等. 天津市2013-2019年淡色库蚊对常用杀虫剂的抗药性监测分析[J]. 中国媒介生物学及控制杂志, 2020, 31(4): 438-441. Zhang YM, Wang S, Hu XH, et al. Surveillance and analysis of the resistance of Culex pipiens pallens to commonly used insecticides in Tianjin, China, 2013-2019[J]. Chin J Vector Biol Control, 2020, 31(4): 438-441. DOI:10.11853/j.issn.1003.8280.2020.04.012 |
| [3] |
Wang Y, Cheng P, Jiao BY, et al. Investigation of mosquito larval habitats and insecticide resistance in an area with a high incidence of mosquito-borne diseases in Jining, Shandong province[J]. PLoS One, 2020, 15(3): e0229764. DOI:10.1371/journal.pone.0229764 |
| [4] |
Zhu F, Lavine L, O'Neal S, et al. Insecticide resistance and management strategies in urban ecosystems[J]. Insects, 2016, 7(1): 2. DOI:10.3390/insects7010002 |
| [5] |
Huang Y, Guo Q, Sun XH, et al. Culex pipiens pallens cuticular protein CPLCG5 participates in pyrethroid resistance by forming a rigid matrix[J]. Parasit Vectors, 2018, 11(1): 6. DOI:10.1186/s13071-017-2567-9 |
| [6] |
Vinson BS, Law PK. Cuticular composition and DDT resistance in the tobacco budworm[J]. J Econ Entomol, 1971, 64(6): 1387-1390. DOI:10.1093/jee/64.6.1387 |
| [7] |
史琦琪. 淡色库蚊RNA-seq及CPGs与抗药性关系的研究[D]. 济南: 济南大学, 2018. Shi QQ. Culex pipiens pallens RNA-seq and relationship study of CPGs among resistance[D]. Jixnan: University of Jinan, 2018. |
| [8] |
孙雅雯, 郑彬. 昆虫表皮与化学杀虫剂抗性机制关系的研究进展[J]. 中国病原生物学杂志, 2015, 10(11): 1055-1056. Sun YW, Zheng B. Advances in the study of the relationship between insect cuticle proteins and insecticide resistance[J]. J Pathog Biol, 2015, 10(11): 1055-1056. DOI:10.13350/j.cjpb.151123 |
| [9] |
He NJ, Botelho JMC, McNall RJ, et al. Proteomic analysis of cast cuticles from Anopheles gambiae by tandem mass spectrometry[J]. Insect Biochem Mol Biol, 2007, 37(2): 135-146. DOI:10.1016/j.ibmb.2006.10.011 |
| [10] |
Vannini L, Willis JH. Localization of RR-1 and RR-2 cuticular proteins within the cuticle of Anopheles gambiae[J]. Arthropod Struct Dev, 2017, 46(1): 13-29. DOI:10.1016/j.asd.2016.10.002 |
| [11] |
Ioannidou ZS, Theodoropoulou MC, Papandreou NC, et al. CutProtFam-Pred: detection and classification of putative structural cuticular proteins from sequence alone, based on profile hidden Markov models[J]. Insect Biochem Mol Biol, 2014, 52: 51-59. DOI:10.1016/j.ibmb.2014.06.004 |
| [12] |
邢丹. 中国尖音库蚊复合组分子系统学的研究[D]. 北京: 中国人民解放军军事医学科学院, 2013. Xing D. Molecular systematic studies of Culex pipiens complex in China[D]. Beijing: Academy of Military Medical Sciences, 2013. |
| [13] |
Rebers JE, Willis JH. A conserved domain in arthropod cuticular proteins binds chitin[J]. Insect Biochem Mol Biol, 2001, 31(11): 1083-1093. DOI:10.1016/s0965-1748(01)00056-x |
| [14] |
Vaclaw MC, Sprouse PA, Dittmer NT, et al. Self-assembled coacervates of chitosan and an insect cuticle protein containing a Rebers-Riddiford motif[J]. Biomacromolecules, 2018, 19(7): 2391-2400. DOI:10.1021/acs.biomac.7b01637 |
| [15] |
Xu Y, Yang XS, Sun XH, et al. Transcription factor FTZ-F1 regulates mosquito cuticular protein CPLCG5 conferring resistance to pyrethroids in Culex pipiens pallens[J]. Parasit Vectors, 2020, 13(1): 514. DOI:10.1186/s13071-020-04383-w |
| [16] |
Sun XL, Guo JX, Ye WY, et al. Cuticle genes CpCPR63 and CpCPR47 may confer resistance to deltamethrin in Culex pipiens pallens[J]. Parasitol Res, 2017, 116(8): 2175-2179. DOI:10.1007/s00436-017-5521-z |
| [17] |
Balabanidou V, Kefi M, Aivaliotis M, et al. Mosquitoes cloak their legs to resist insecticides[J]. Proc R Soc B Biol Sci, 2019, 286(1907): 20191091. DOI:10.1098/rspb.2019.1091 |
| [18] |
Ma K, Li XX, Hu HX, et al. Pyrethroid-resistance is modulated by miR-92a by targeting CpCPR4 in Culex pipiens pallens[J]. Comp Biochem Physiol B Biochem Mol Biol, 2017, 203: 20-24. DOI:10.1016/j.cbpb.2016.09.002 |
 2021, Vol. 32
2021, Vol. 32


