扩展功能
文章信息
- 王琴燕, 付士红, 孙定炜, 许秀燕, 吴群, 曾林海, 李善干, 何英, 李樊, 聂凯, 许松涛, 殷启凯, 王环宇, 鲁晓晴, 梁国栋
- WANG Qin-yan, FU Shi-hong, SUN Ding-wei, XU Xiu-yan, WU Qun, ZENG Lin-hai, LI Shan-gan, HE Ying, LI Fan, NIE Kai, XU Song-tao, YIN Qi-kai, WANG Huan-yu, LU Xiao-qing, LIANG Guo-dong
- 海南省野生蠓虫西藏环状病毒的研究
- A study of wild midges carrying Tibet orbivirus in Hainan province, China
- 中国媒介生物学及控制杂志, 2021, 32(4): 415-421
- Chin J Vector Biol & Control, 2021, 32(4): 415-421
- 10.11853/j.issn.1003.8280.2021.04.006
-
文章历史
- 收稿日期: 2021-03-05
2 中国疾病预防控制中心病毒病预防控制所, 传染病预防控制国家重点实验室, 北京 102206;
3 海南省疾病预防控制中心, 海南 海口 570203
2 State Key Laboratory of Infectious Disease Prevention and Control, National Institute for Viral Disease Control and Prevention, Chinese Center for Disease Control and Prevention, Beijing 102206, China;
3 Hainan Center for Disease Control and Prevention, Haikou, Hainan 570203, China
环状病毒(Orbivirus)属于呼肠孤病毒科(Reoviridae)环状病毒属[1]。该病毒属包括22种病毒以及10种未分类的病毒[2]。环状病毒属由10节段双链RNA组成,病毒基因组编码7种结构蛋白(VP1~VP7)和4种非结构蛋白(NS1~NS4)[3]。环状病毒属病毒为媒介传播的病毒,主要传播媒介包括库蠓、蚊虫和蜱等。环状病毒属中含多种重要的可致动物疾病的病毒,是引起动物流行病的重要病原体。如通过库蠓等传播的蓝舌病毒(Bluetongue virus,BTV)、非洲马瘟病毒(African horse sickness virus,AHSV)和鹿流行性出血热病毒(Epizootic hemorrhagic disease virus,EHDV),可以引起动物相关疾病,给畜牧业造成严重经济损失[4-6]。
西藏环状病毒(Tibet orbivirus,TIBOV,XZ0906)首次于2009年在我国西藏地区的墨脱县采集的斑点按蚊(Anopheles maculatus)中分离到,被认为是环状病毒属中新的病毒种[7]。随后,在广东省采集的致倦库蚊(Culex pipiens quinquefasciatus)、云南省采集的蠓虫(Culicoides spp.)和蚊虫标本、湖南省采集的三带喙库蚊(Cx. tritaeniorhynchus)标本中分离到TIBOV[7-12]。此外,在我国云南省采集的家养牛的双份血清中检测到TIBOV中和抗体有4倍以上升高,提示牛可以感染TIBOV[10]。
海南省地处热带地区(东经108°37′~111°05′,北纬18°10′~20°10′)。常年雨量充沛,气候湿润且炎热,独特的地理环境非常适宜多种吸血昆虫的孳生,也为虫媒病毒的繁殖和传播提供了天然条件。海南省是流行性乙型脑炎(乙脑)和登革热的流行区,在自然界吸血昆虫中多次分离到乙脑病毒(JEV)[13]、登革病毒[14]、多种甲病毒[15]、东南亚十二节段RNA病毒属(Seadornavirus)病毒等[16-17]。本研究于2019年夏季在海南省琼中黎族自治县(琼中县)进行蚊虫和蠓虫标本采集及虫媒病毒的分离鉴定。在当地采集的蠓虫标本中分离到1株病毒(HNQZ1927),该毒株可以引起白纹伊蚊C6/36细胞病变(cytopathic effect,CPE),不引起金黄地鼠肾细胞(BHK-21)病变,病毒分子生物学分析结果显示该病毒分离株为TIBOV,这是首次在我国海南省分离到TIBOV,现将结果报告如下。
1 材料与方法 1.1 标本采集在当地羊圈和猪圈采集吸血昆虫标本,标本采集工具使用“功夫小帅”牌紫外诱蚊灯(武汉吉星医疗科技有限公司)。每个采样点放置1盏诱蚊灯并于18:00悬挂在牲畜圈内,次日07:00收集标本。昆虫标本放置-20 ℃冰箱20 min冷冻后取出,在冰浴条件下进行标本的形态学鉴定和分装。按照采集环境将标本分装并进行编号登记。标本放入液氮中保存,最后干冰送至实验室检测[18-19]。
1.2 细胞BHK-21和C6/36细胞为本实验室保存。BHK-21细胞培养条件:90%Eagle’s(实验室配制)、7%胎牛血清(FBS;Invitrogen)、1%的青霉素和链霉素(100 U/ml)、1%谷氨酰胺(30 g/L)、1%NaHCO3;C6/36细胞培养条件:89%RMPI1640(Invitrogen)、10%胎牛血清(FBS;Invitrogen)、1%的青霉素和链霉素(100 U/ml)。BHK-21和C6/36细胞分别置于含5%CO2的37 ℃培养箱及28 ℃培养箱中培养[18-19]。
1.3 病毒分离液氮冻存的蚊虫每50只、蠓虫每500只为1批,标本置于玻璃研磨器,用上述培养液清洗2次,再加入1.5 ml培养液在冰浴条件下反复研磨。研磨后离心(4 ℃,离心半径8.4 cm,12 000 r/min,30 min),离心后取上清液100 μl分别接种到生长至80%的单层BHK-21和C6/36细胞培养板中(24孔板,Corning incorporated),并分别放入5%CO2的37和28 ℃培养箱中连续培养。每12 h在显微镜下观察CPE,细胞出现CPE时收取病毒液保存于-80 ℃冰箱直至进一步鉴定。未出现CPE的标本在上述2种细胞盲传3代,无病变者丢弃[18-19]。
1.4 病毒RNA提取、cDNA文库制备使用Viral RNA Mini Kit(QIAamp;Qiagen,Valencia,CA)试剂盒,按照说明书的操作步骤提取标本中总RNA。(1)标本研磨液提取总RNA;(2)接种BHK-21和C6/36细胞上清液标本中提取总RNA。提取的RNA立即放入65 ℃水浴10 min,然后冰浴2 min。吸取32 μl的RNA标本放入Ready-To-Gokit试剂盒中的第一链反应管(GEHealthcare,LittleChalfont,Buckinghamshire,UK),室温静置1 min,加入1 μl随机引物〔pd(N)6,TaKaRa,Japan〕后瞬时离心,37 ℃水浴1 h。如此制备的病毒RNA的cDNA文库总体积为33 μl,可立即使用或放入-40 ℃保存备用[20-21]。
1.5 病毒分离物的初步鉴定使用虫媒病毒属特异性(布尼亚病毒、甲病毒属、黄病毒属)和多种病毒种特异性基因扩增引物筛查病毒分离物[7, 9-12]。病毒基因扩增(PCR)体系为25 μl,包括:cDNA模板、GoTaq®GreenMasterMix,2×(Promega,Madison,WI)、10 μmol/L的正、反向引物。PCR反应结束后,取5 μl基因扩增产物进行1%琼脂糖凝胶电泳检测。基因扩增阳性产物开展核苷酸序列测定[20-21]。
1.6 病毒全基因组核苷酸序列扩增根据对病毒分离物的初步鉴定结果,合成TIBOV 10个基因节段的基因扩增引物[7, 9, 11],最终获得病毒分离物的全基因核苷酸序列。
1.7 病毒基因组核苷酸序列分析将病毒基因核苷酸序列进行BLAST〔美国国立生物技术信息中心(NCBI),https://blast.ncbi.nlm.nih.gov/Blast.cgi〕比对。使用Seqman软件(DNAStar、Madison、WI)进行核苷酸序列拼接与质量分析;使用BioEdit(Version7.0、Thomas)软件进行核苷酸多序列比对;使用MEGA 6.0软件完成基于Neighbour-joining方法的系统进化分析,Bootstrap值设定为1 000,病毒基因系统进化所使用的病毒基因序列[10],使用MegAlign软件进行核苷酸和氨基酸序列的同源性分析[18, 21]。
2 结果 2.1 吸血昆虫标本采集2019年8月,在琼中县(东经109°47'55″,北纬19°2'17″)人舍和猪圈、羊圈等进行标本采集。共采集到蚊虫3属34只,其中库蚊26只、按蚊1只和骚扰阿蚊(Armigeres subalbatus)7只;采集蠓虫1 450只(未鉴定种类)。
2.2 HNQZ1927病毒分离将采集的蠓虫标本分为3批研磨处理(蚊虫标本数量有限,因此未对蚊虫标本进行病毒分离研究),每批蠓虫标本的研磨离心上清液平行接种BHK-21和C6/36细胞。经过连续培养,来自羊圈的1批(HNQZ1927)研磨液接种至C6/36细胞第6天出现CPE(图 1A2),而第2和第3代出现CPE时间均为4 d,可观察到细胞生长缓慢,贴壁细胞减少和脱落,未见细胞融合和圆缩。但是平行接种至BHK-21细胞的蠓虫研磨上清液的标本并未观察到肉眼可见的CPE。另2批蠓虫标本研磨上清液接种至BHK-21和C6/36细胞连续传代3次均未观察到CPE。

|
| 注:A1正常C6/36细胞对照(96 h);A2接种过HNQZ1927的C6/36细胞病变(96 h)。 图 1 病毒分离株(HNQZ1927)引起的C6/36细胞病变(×200) Figure 1 Cytopathic effect of the virus isolate HNQZ1927 on C6/36 cells(×200) |
| |
采用反转录聚合酶链式反应(reverse transcription-PCR,RT-PCR)方法对病毒分离物(HNQZ1927)进行分子生物学鉴定,首先使用虫媒病毒黄病毒属(黄-FU1/CFD2)、布尼亚病毒属(布-BUP/BDW)和甲病毒属等11对特异性引物对HNQZ1927病毒分离物进行基因扩增,结果均为阴性。使用引物包括OYA病毒(OYA-11F/2R)、JEV、BTV、辛德毕斯病毒(SINV)、阿卡斑病毒(AKV)、版纳病毒(BAV)等均未检测基因扩增阳性产物[7, 9-12]。最终我们使用TIBOV扩增引物(TIBOV-6-4-2F/TIBOV-6-4-2)获得该病毒第4节段基因扩增阳性(848 bp),核苷酸序列测定与分析结果表明,HNQZ1927分离物的基因扩增产物和TIBOV核苷酸序列具有99.0%同源性,提示从海南省蠓虫标本分离的HNQZ1927病毒为TIBOV分离株。
2.4 病毒核酸序列测定与分析根据已经获得的HNQZ1927病毒第4基因节段核苷酸序列,并参考其他已经分离到的TIBOV的核苷酸序列,本研究设计了针对病毒1~10基因节段基因序列扩增引物[7, 9, 11],以获得HNQZ1927病毒全基因组基因扩增产物和全部核苷酸序列。通过基因扩增和序列测定,最终获得了HNQZ1927病毒株5个基因节段(Seg1、Seg3、Seg5、Seg8和Seg10)的全部编码区序列。而病毒第2、4、6、7、9节段基因的扩增未获得相应的结果,最终仅获得第2(1 473 bp)、第4(834 bp)、第6(972 bp)、第7(469 bp)和第9(284 bp)基因节段的部分核苷酸序列。HNQZ1927病毒S1、S3、S5、S8和S10基因节段编码区序列核苷酸(氨基酸)长度分别为3 915(1 304)、2 769(899)、1 775(554)、1 142(359)和832(234),与TIBOV原始分离株(TIBOV XZ0906)相应基因节段核苷酸序列长度相同。
将HNQZ1927分离株与TIBOV(XZ0906、DH13C120、YN12246和Fengkai病毒)、Orbivirus SX-2017a以及其他环状病毒S1、S3、S5、S8、S10基因节段进行同源性分析,结果显示HNQZ1927与TIBOV病毒株S1、S3节段的核苷酸(氨基酸)同源性分别为90.6%~98.7%(98.4%~99.8%)和79.4%~97.6%(96.3%~99.9%),HNQZ1927的S1、S3节段与蠓媒环状病毒的核苷酸(氨基酸)序列同源性分别为60.3%~67.6%(58.5%~72.4%)和61.6%~70.1%(57.2%~78.1%),与蚊媒传播的YOUV的核苷酸(氨基酸)序列同源性分别为56.8%(46.5%)和1.2%(9.7%)。HNQZ1927的非结构基因(NS1~NS3)与TIBOV 5株毒株的核苷酸和氨基酸同源性分别为84.9%~98.6%和94.6%~100%;HNQZ1927的非结构基因(NS1~NS3)与蠓虫为媒介传播的4株病毒的核苷酸和氨基酸同源性分别为20.0%~59.5%和25.4%~55.6%;HNQZ1927的非结构基因(NS1~NS3)与蚊虫为媒介传播的YOUV的核苷酸和氨基酸同源性分别为4.2%~16.2%和14.9%~20.0%。见表 1。
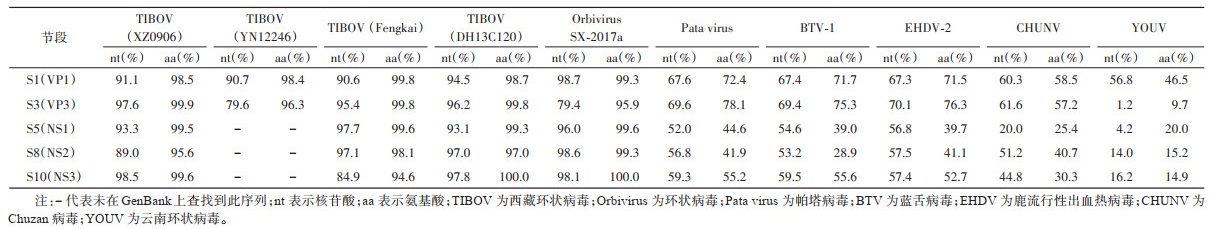
|
病毒基因的系统进化分析表明,包括本研究分离的HNQZ1927病毒在内的6株TIBOV(XZ0906、DH13C120、YN12246、Fengkai和Orbivirus SX-2017a)独立于其他环状病毒而处于同一进化分支(图 2)。而这6株病毒再次形成2个相对独立的进化簇,每个进化簇分别由3株病毒构成。HNQZ1927病毒株与其他5株TIBOV病毒,无论VP3蛋白核苷酸序列或者VP1蛋白核苷酸序列,其系统进化分析结果均相同(图 2A、B)。
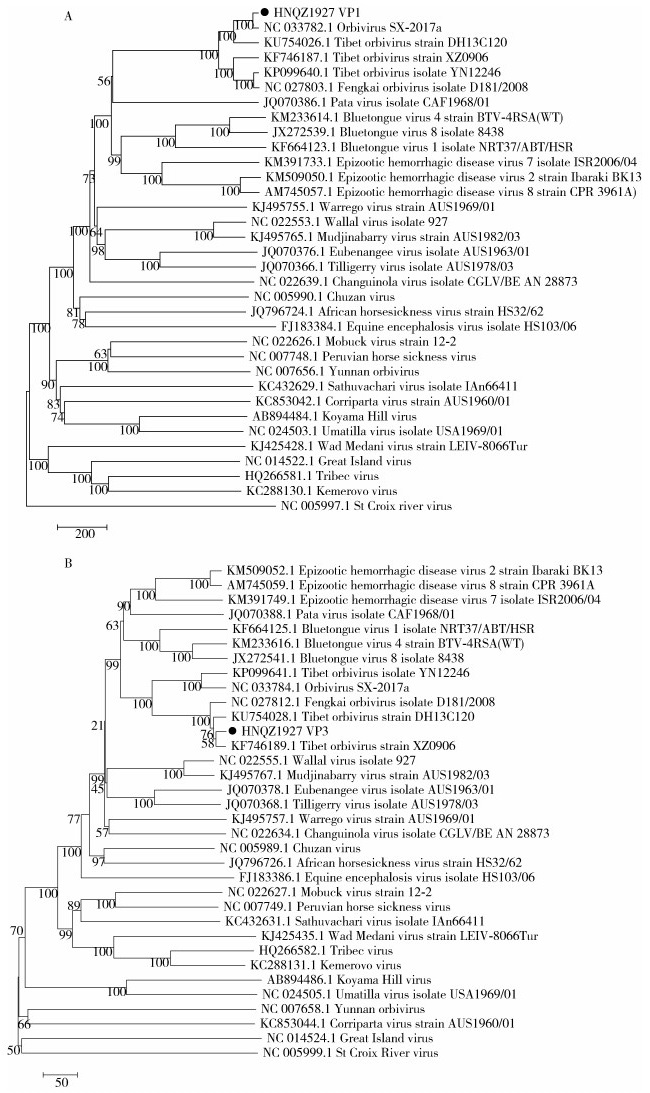
|
| 注:A基于VP1蛋白核苷酸序列构建的系统进化树;B基于VP3蛋白核苷酸序列构建的系统进化树。●表示HNQZ1927毒株。 图 2 HNQZ1927病毒株基于VP1和VP3蛋白核苷酸序列构建的系统进化树 Figure 2 Phylogenetic tree of the HNQZ1927 virus constructed based on the nucleotide sequences of VP1 and VP3 proteins |
| |
本文报道在海南省琼中县自然界采集的蠓虫标本中分离到1株TIBOV(HNQZ1927),这也是首次在海南省自然界吸血昆虫中分离到的TIBOV。虽然该病毒经过分子生物学方法被鉴定为TIBOV,但是该病毒的生物学表型和病毒基因序列等均与此前分离的TIBOV存在较大差异,主要表现:此前研究结果显示,我国已经从自然界采集的多种蚊虫〔圆斑按蚊(An. maculatus)、三带喙库蚊、致倦库蚊〕和蠓虫标本中分离到TIBOV,而这些病毒分离株无一例外均可以引起BHK-21细胞发生病变,而本次在海南省自然界采集的蠓虫标本分离的HNQZ1927病毒,仅对蚊虫C6/36细胞引起病变而对平行接种的BHK-21细胞并未出现CPE。这也是首次发现对BHK-21细胞不致病变的TIBOV分离株。BHK-21细胞对多种虫媒病毒敏感,是开展虫媒病毒研究中最常使用的哺乳动物细胞系,虽然此前发现的TIBOV对BHK-21均可引起CPE,但是此次发现HNQZ1927病毒分离株对BHK-21细胞无致病变作用,提示TIBOV具有多种生物学表型特性。这一结果也提示在今后使用BHK-21细胞开展TIBOV或者其他虫媒病毒分离研究时要平行使用多种组织培养细胞,如蚊虫细胞(C6/36);多种哺乳动物细胞,如Vero细胞和Vero-E6细胞等,以提高病毒分离的可能性。
研究显示TIBOV为10个基因节段的双链RNA病毒,本研究根据TIBOV 10个基因节段序列设计了48对覆盖病毒全基因组的基因扩增引物[7, 9, 11],并使用这些引物对HNQZ1927病毒进行病毒基因组扩增。结果显示22对引物并未获得阳性产物。经过多次调整PCR反应条件和重新设计新的扩增引物,最终仅获得了HNQZ1927病毒5个基因节段(S1、S3、S5、S8和S10)编码区核苷酸序列信息,而其余5个基因节段(S2、S4、S6、S7和S9)只获得了部分基因序列信息。以上结果提示HNQZ1927病毒是一株与此前发现的环状病毒在基因序列上存在较大差异的病毒分离株,进一步提示TIBOV具有基因多样性。研究结果显示,环状病毒属病毒的第2基因节段编码病毒外膜衣壳蛋白(VP2),该蛋白具有血清型特异性和病毒血凝素活性,对介导环状病毒侵入细胞起重要作用,同时参与病毒的致病性,研究表明VP2蛋白很可能是库蠓向脊椎动物宿主(牛、羊等)传播BTV的主要蛋白质因子[22]。本研究设计的10条针对病毒VP2基因的基因扩增引物,仅有3条可以获得阳性产物,经过调整反应条件和重新设计扩增引物,大部分引物仍然不工作,最终仅获得该基因的1 473个核苷酸(412个氨基酸)(VP2编码区应为2 901个氨基酸)。获得的VP2核苷酸序列与TIBOV原始分离株(XZO906)在VP2节段相应部位的核苷酸和氨基酸同源性分别为41.0%和34.1%,说明HNQZ1927病毒株在VP2基因节段上存在很大的变异。同样,对HNQZ1927病毒S4、S6、S7和S9基因节段进行扩增也仅获得部分基因序列,分别为834个核苷酸(S4片段)、972个核苷酸(S6片段)、469个核苷酸(S7片段)和284个核苷酸(S9片段),这进一步说明HNQZ1927病毒是一株与其他已经分离到的TIBOV在基因序列上存在较大差异的病毒分离株。HNQZ1927病毒分离株在分子生物学存在的差异很可能是其生物学表型与此前发现的病毒分离株的差异的分子基础,值得开展进一步研究。
综上所述,TIBOV是于2009年在我国西藏地区墨脱县采集的圆斑按蚊标本分离的环状病毒,被命名为TIBOV[7]。此后,在我国广东省(封开县)采集的致倦库蚊、湖南省采集的三带喙库蚊[11]和云南省采集的未鉴定蚊虫标本中分离到TIBOV。此外,近年来在我国云南省德宏地区采集的蠓虫标本和云南省西双版纳地区采集的蠓虫中分离到TIBOV,加之本研究在海南省蠓虫中分离到HNQZ1927病毒分离株。可见TIBOV是在我国西南部(云南省、西藏自治区)和南部(广东、湖南、海南省)地区广泛存在的虫媒病毒。不仅地域分布范围广泛(东经79°23′24″~116°26′24″,北纬18°24′~29°36′36″),而且其传播媒介也包括了在我国广泛分布的,兼具飞行和吸血能力的蚊虫和蠓虫,提示TIBOV很可能会随着这些媒介的移动而使该病毒分布范围进一步扩散。此外,三带喙库蚊和致倦库蚊是在我国分布最为广泛的吸血库蚊,也是我国JEV最主要的携带和传播媒介,此外这2种蚊虫还传播JEV以外的10余种虫媒病毒[23]。有鉴于此,TIBOV的地域分布很有可能会不断向我国北部地区扩散传播,因此要加强TIBOV在自然界吸血媒介中的检测和监测。此外在我国云南省采集的家养牛的双份血清中可以检测到TIBOV中和抗体的4倍以上升高,提示牛可以感染TIBOV[10]。因此要加强该病毒在人兽中感染的调查研究,特别是要加强发现和评估TIBOV感染对人兽致病性的研究,以应对该病毒感染所发生的公共卫生事件等。
志谢 2019年参加海南省琼中黎族苗族自治县吸血昆虫标本现场采集工作的基层工作人员对本工作给予大力支持, 特此志谢利益冲突 无
| [1] |
Belaganahalli MN, Maan S, Maan NS, et al. Genetic characterization of the tick-borne orbiviruses[J]. Viruses, 2015, 7(5): 2185-2209. DOI:10.3390/v7052185 |
| [2] |
Attoui H, Becnel J, Belaganahalli S, et al. Part II: The Viruses-the double stranded RNA viruses-family Reoviridae[R]. San Diego: Elsevier Academic Press, 2012.
|
| [3] |
Kapoor A, Tesh RB, Duraisamy R, et al. A novel mosquito-borne Orbivirus species found in South-east Asia[J]. J Gen Virol, 2013, 94(5): 1051-1057. DOI:10.1099/vir.0.046748-0 |
| [4] |
Calvo-Pinilla E, Castillo-Olivares J, Jabbar T, et al. Recombinant vaccines against bluetongue virus[J]. Virus Res, 2014, 182: 78-86. DOI:10.1016/j.virusres.2013.11.013 |
| [5] |
Zientara S, Lecollinet S, Weyer CT. African horse sickness[J]. Rev Sci Tech, 2015, 34(2): 315-327. DOI:10.20506/rst.34.2.2359 |
| [6] |
Maclachlan NJ, Zientara S, Savini G, et al. Epizootic haemorrhagic disease[J]. Rev Sci Tech, 2015, 34(2): 341-351. DOI:10.20506/rst.34.2.2361 |
| [7] |
Li MH, Zheng YY, Zhao GY, et al. Tibet orbivirus, a novel Orbivirus species isolated from Anopheles maculatus mosquitoes in Tibet, China[J]. PLoS One, 2014, 9(2): e88738. DOI:10.1371/journal.pone.0088738 |
| [8] |
Wu D, Tan QQ, Zhang H, et al. Genomic and biological features of a novel orbivirus isolated from mosquitoes, in China[J]. Virus Res, 2020, 285: 197990. DOI:10.1016/j.virusres.2020.197990 |
| [9] |
Lei WW, Guo XF, Fu SH, et al. Isolation of Tibet orbivirus, TIBOV, from Culicoides collected in Yunnan, China[J]. PLoS One, 2015, 10(8): e0136257. DOI:10.1371/journal.pone.0136257 |
| [10] |
Wang JL, Li HC, He YW, et al. Isolation of Tibet orbivirus from Culicoides and associated infections in livestock in Yunnan, China[J]. Virol J, 2017, 14(1): 105. DOI:10.1186/s12985-017-0774-9 |
| [11] |
范娜, 曹玉玺, 付士红, 等. 三带喙库蚊中分离的西藏环状病毒全基因序列测定及分析[J]. 病毒学报, 2018, 4(5): 625-637. Fan N, Cao YX, Fu SH, et al. Genome sequencing and analyses of the Tibet orbivirus isolated from Culex tritaeniorhynchus[J]. Chin J Virol, 2018, 4(5): 625-637. DOI:10.13242/j.cnki.bingduxuebao.003452 |
| [12] |
Xing SZ, Guo XF, Zhang XLL, et al. A novel mosquito-borne reassortant orbivirus isolated from Xishuangbanna, China[J]. Virol Sin, 2017, 32(2): 159-162. DOI:10.1007/s12250-016-3886-2 |
| [13] |
游志勇, 王逸民, 赵子江, 等. 海南岛两个虫媒病毒分离物的初步鉴定[J]. 病毒学报, 1988, 4(1): 11-17. You ZY, Wang YM, Zhao ZJ, et al. Preliminary identification of two arbovirus isolates from Hainan island[J]. Chin J Virol, 1988, 4(1): 11-17. |
| [14] |
周俊梅, 江丽芳, 高阳, 等. 登革2型病毒海南分离株全长E基因的测定与分析[J]. 中华微生物学和免疫学杂志, 2003, 23(4): 304-306. Zhou JM, Jiang LF, Gao Y, et al. Gene sequencing and analysis of the envelope protein of dengue 2 virus isolated in Hainan China[J]. Chin J Microbiol Immunol, 2003, 23(4): 304-306. DOI:10.3760/j:issn:0254-5101.2003.04.021 |
| [15] |
董必军, 陈文州, 李秀维, 等. 首次从海南岛蚊虫和蝙蝠中分离出两株基孔肯雅病毒[J]. 中国媒介生物学及控制杂志, 1993, 4(3): 205-208. Dong BJ, Chen WZ, Li XW, et al. Two isolates of Chikungunya virus isolated from Culex fatigans and bats, for the first time in Hainan, China[J]. Chin J Vector Biol Control, 1993, 4(3): 205-208. |
| [16] |
游志勇, 王逸民, 赵治国, 等. 海南省两株环状病毒的分离与鉴定[J]. 病毒学报, 1990, 6(3): 272-276. You ZY, Wang YM, Zhao ZG, et al. Isolation and identification of two strains of orbivirus in Hainan province[J]. Chin J Virol, 1990, 6(3): 272-276. |
| [17] |
郑雅匀, 王志玉, 梁国栋. 海南省虫媒病毒调查研究状况[J]. 中国媒介生物学及控制杂志, 2011, 22(6): 607-610. Zheng YY, Wang ZY, Liang GD. Review on arbovirus studies in Hainan province, China[J]. Chin J Vector Biol Control, 2011, 22(6): 607-610. |
| [18] |
Song S, Li YY, Fu SF, et al. Could Zika virus emerge in mainland China? Virus isolation from nature in Culex quinquefasciatus, 2016[J]. Emerg Microbes Infect, 2017, 6(11): e93. DOI:10.1038/emi.2017.80 |
| [19] |
Fu SH, Song S, Liu H, et al. Zika virus isolated from mosquitoes: a field and laboratory investigation in China, 2016[J]. Sci China Life Sci, 2017, 60(12): 1364-1371. DOI:10.1007/s11427-017-9196-8 |
| [20] |
Feng Y, Li YY, Fu SH, et al. Isolation of Kaeng Khoi virus (KKV) from Eucampsipoda sundaica bat flies in China[J]. Virus Res, 2017, 238: 94-100. DOI:10.1016/j.virusres.2017.06.007 |
| [21] |
Ren XJ, Fu SH, Dai PF, et al. Pigsties near dwellings as a potential risk factor for the prevalence of Japanese encephalitis virus in adult in Shanxi, China[J]. Infect Dis Poverty, 2017, 6(1): 100. DOI:10.1186/s40249-017-0312-4 |
| [22] |
Hassan SS, Roy P. Expression and functional characterization of bluetongue virus VP2 protein: role in cell entry[J]. J Virol, 1999, 73(12): 9832-9842. DOI:10.1128/JVI.73.12.9832-9842.1999 |
| [23] |
Liang GD, Li XL, Gao XY, et al. Arboviruses and their related infections in China: a comprehensive field and laboratory investigation over the last 3 decades[J]. Rev Med Virol, 2018, 28(1): e1959. DOI:10.1002/rmv.1959 |
 2021, Vol. 32
2021, Vol. 32


