扩展功能
文章信息
- 王丹, 史鹏, 赵文平, 闫英, 周敬祝, 田珍灶, 梁文琴
- WANG Dan, SHI Peng, ZHAO Wen-ping, YAN Ying, ZHOU Jing-zhu, TIAN Zhen-zao, LIANG Wen-qin
- 贵州省兴义及赤水市白纹伊蚊抗药性监测分析
- Monitoring and analysis of insecticide resistance of Aedes albopictus in Xingyi and Chishui cities of Guizhou province, China
- 中国媒介生物学及控制杂志, 2021, 32(3): 302-306
- Chin J Vector Biol & Control, 2021, 32(3): 302-306
- 10.11853/j.issn.1003.8280.2021.03.009
-
文章历史
- 收稿日期: 2020-07-22
2 贵州医科大学公共卫生学院, 贵州 贵阳 550025
2 Public Health Institute of Guizhou Medical University, Guiyang, Guizhou 550025, China
登革热是由登革病毒引起,经伊蚊叮咬传播的一种急性传染病,是全球传播最广、发病人数最多、危害最严重的蚊传疾病之一[1-2]。全球登革热疫情近年来呈持续高发态势,发病率在过去50年中增加了30倍,涉及100多个国家和地区,25亿~30亿人面临感染风险,每年新增感染病例约3.9亿例[3]。2019年是继2016年后全球登革热疫情再次出现暴发的年份,其中以菲律宾、越南、马来西亚等东南亚国家和南美洲的巴西疫情最为严重[4-5]。2019年中国大陆共报告登革热病例22 599例,发病率为1.63/10万,疫情形势较往年更为严峻[6]。目前,登革热输入性病例已呈全国性分布,而本地流行趋势亦由云南省及东南沿海地区向全国各地蔓延。贵州省为西南内陆省份,历史上未出现过登革热本地病例,白纹伊蚊(Aedes albopictus)为当地优势蚊种,省内无埃及伊蚊(Ae. aegypti)分布。近年来,贵州省输入性登革热病例逐年增多,周边省份相继出现登革热本地疫情,贵州省登革热防控压力日益凸显。为快速有效地控制当地白纹伊蚊种群密度,防止输入性登革热引起本地暴发、流行,课题组于2018-2019年选择黔西南布依族苗族自治州兴义市及遵义市赤水市开展白纹伊蚊抗药性监测工作,以期掌握两地白纹伊蚊对常用杀虫剂的敏感性并指导其科学、规范、合理用药,为贵州省防控登革热疫情及减少生态破坏提供理论依据。
1 材料与方法 1.1 供试蚊虫2018年9月和2019年7月,分别从兴义及赤水市不同方位的居民区小型积水容器中利用吸管和捞勺采集白纹伊蚊幼蚊,带回贵州省疾病预防控制中心(CDC)病媒生物饲养室鉴定并繁殖至F1~F2代;白纹伊蚊敏感品系引自中国CDC传染病预防控制所媒介生物控制室,室内常规饲养。选择Ⅲ龄末Ⅳ龄初健康幼蚊及羽化后3~5 d未吸血健康雌蚊进行测定。
1.2 杀虫剂96.85%溴氰菊酯、95%高效氯氰菊酯、90%氯菊酯、97.6%敌敌畏(DDVP)、97%残杀威、7 000 ITU/mg苏云金杆菌以色列亚种(Bti)原药、0.1%溴氰菊酯、0.4%高效氯氰菊酯、3%氯菊酯、0.2%杀螟硫磷、0.05%残杀威药膜及实验对照用纸,均由中国CDC传染病预防控制所媒介生物控制室提供;丙酮,分析纯,购自国药集团化学试剂有限公司。
1.3 实验条件饲养室和测试室温度为(26±1)℃,相对湿度为(75±5)%,光照周期(L∶D)=14 h:10 h。
1.4 实验方法 1.4.1 幼虫浸渍法正式实验前需进行预实验。准确称取待测药剂,用丙酮将供试杀虫剂原药(Bti除外)配制成5 mg/ml母液,Bti母液用蒸馏水进行配制,再经震荡器震荡30 min后配制成相同浓度。通过预实验确定幼蚊10%~90%死亡的药液浓度,并根据预实验结果将母液按等差或等比稀释成5~7个系列浓度。各取100 μl不同浓度的药液加入每个盛有199.9 ml脱氯水的250 ml烧杯中,对照组加入100 μl丙酮(Bti对照组加入100 μl蒸馏水)。按浓度由低到高的顺序在各杯中分别加入试虫20只,24 h后观察并记录试虫死亡数,计算死亡率,实验重复3次。死亡判断标准[7]:以锐器触动虫体不动或仅震颤即判为死亡。
1.4.2 成蚊接触筒法将恢复筒固定在隔板的一侧,用吸蚊器吸取20~25只供试雌蚊轻轻吹入恢复筒,平行放置15 min。将衬垫有药膜滤纸的接触筒各自固定在隔板的另一侧,同时设空白对照。抽开隔板,将恢复筒内蚊虫轻轻吹入接触筒,迅速关闭隔板,将筒平放,开始计算接触时间。接触药膜60 min后抽开隔板,将蚊虫吹至恢复筒内,关闭隔板,取下恢复筒直立放置并饲以10%葡萄糖水,恢复饲养24 h后观察死亡数,计算死亡率,实验重复4~5次。死亡判断标准[8]:试虫完全不动,或仅躯体、足、翅或触角等震颤而无存活的可能性,视为死亡。
1.4.3 结果判定幼蚊或成蚊抗药性测定过程中,若对照组死亡率 < 5%,可不必校正,如在5%~20%,用Abbott公式校正实验组死亡率:校正死亡率(%)=(实验组死亡率-对照组死亡率)/(1-对照组死亡率)×100。若对照组死亡率 > 20%或幼蚊化蛹率 > 10%,则实验结果无效。
1.5 统计与计算应用SPSS 24.0软件对生物测定结果进行统计学分析,得到幼蚊对每种杀虫剂的半数致死浓度(LC50)及95%可信区间(95%CI)、毒力回归方程及抗性倍数。抗性倍数(R/S)=野外种群LC50/敏感品系LC50,幼蚊敏感品系对Bti的LC50值由贵州省CDC测定,其余杀虫剂的LC50值参照中国CDC传染病预防控制所媒介生物控制室测定结果[9]。
1.6 抗性判定标准野外种群幼蚊根据抗性倍数判定抗性级别,抗性倍数 < 3为敏感,3≤抗性倍数 < 10为低抗,10≤抗性倍数 < 40为中抗,抗性倍数≥40为高抗[10]。野外种群成蚊以诊断剂量下的死亡率作为抗性判断标准,待测蚊虫种群的死亡率 > 98%为敏感(S),死亡率80%~98%为可疑抗性(M),死亡率 < 80%为抗性(R)[11]。
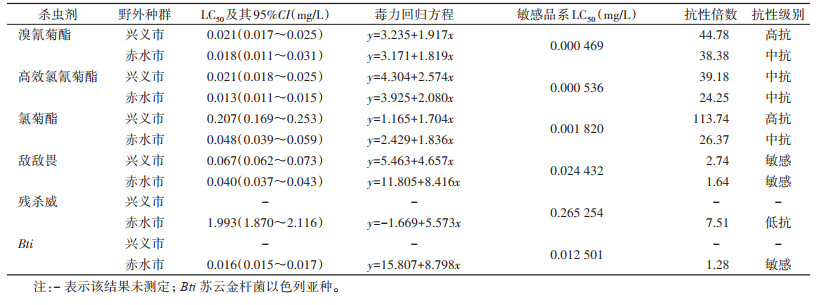
2 结果 2.1 白纹伊蚊幼蚊抗性测定兴义及赤水市白纹伊蚊幼蚊对拟除虫菊酯类杀虫剂均已产生明显的抗药性。其中,兴义市白纹伊蚊种群对溴氰菊酯及氯菊酯为高抗水平,LC50分别为0.021和0.207 mg/L,抗性倍数分别为44.78和113.74倍;对高效氯氰菊酯为中抗水平,LC50为0.021 mg/L,抗性倍数为39.18倍。赤水市白纹伊蚊种群对3种拟除虫菊酯类杀虫剂均为中抗水平,其对溴氰菊酯、高效氯氰菊酯和氯菊酯的LC50为0.018、0.013和0.048 mg/L,抗性倍数由高到低依次是溴氰菊酯、氯菊酯和高效氯氰菊酯。兴义及赤水市白纹伊蚊幼蚊对DDVP均属敏感水平,LC50分别为0.067和0.040 mg/L,抗性倍数分别为2.74和1.64倍。赤水市野外种群对残杀威及Bti分别呈低抗及敏感水平,LC50分别为1.993和0.016 mg/L,抗性倍数分别为7.51和1.28倍。见表 1。
|
兴义市白纹伊蚊成蚊对溴氰菊酯、高效氯氰菊酯、氯菊酯均为抗性,24 h死亡率分别为27.22%、57.89%和46.75%,对杀螟硫磷敏感,死亡率为100%;赤水市白纹伊蚊成蚊对溴氰菊酯为抗性,死亡率为53.00%,对高效氯氰菊酯和氯菊酯为可疑抗性,死亡率分别为93.33%和94.40%,对残杀威敏感,死亡率为99.20%。见表 2。

|
2004年舒莉萍等[12-13]曾对贵州省自然界白纹伊蚊体内登革病毒带毒情况及其易感性进行研究,结果表明,当地白纹伊蚊体内存在登革病毒或其抗原、核酸,且不同地理株白纹伊蚊对登革病毒普遍易感,证明贵州省存在登革病毒的自然循环且存在引发登革热本地流行的媒介条件。近年来,贵州省本地疫情暴发风险逐年升高,监测当地白纹伊蚊的抗药性水平对于登革热防控意义重大,但目前有关贵州省白纹伊蚊抗药性的调查仅见于2018年梁文琴等[14]与梁秋果等[15]对贵阳市白纹伊蚊抗药性进行的报道,其余地区从未开展过白纹伊蚊的抗药性监测,亦无历史监测数据累积。兴义及赤水市终年气候温暖湿润,雨量充沛,植被繁茂,适宜蚊媒孳生,且当地旅游资源丰富,人口流动性高,具备登革热本地疫情流行条件,故白纹伊蚊抗药性调查选择该两地开展。
化学防治是控制病媒生物种群密度的主要方式,但长期频繁施用化学杀虫剂会使得病媒生物出现严重的抗药性。本次测试的常用杀虫剂中,兴义及赤水市白纹伊蚊幼蚊对溴氰菊酯、高效氯氰菊酯及氯菊酯均已达高抗或中抗水平,对DDVP为敏感水平,而值得注意的是,该结果与2年前贵阳市白纹伊蚊抗药性的监测情况相比存在差异。贵阳市2018年白纹伊蚊幼蚊对该3种拟除虫菊酯类杀虫剂均为中抗或低抗水平,对DDVP为低抗水平[14-15],监测结果存在差异可能与各地历史用药情况不同或杀虫剂的使用频次推动了抗性水平变化有关,因拟除虫菊酯类杀虫剂具备高效、低毒、安全的特性,近年来,该类杀虫剂一直占据市场优势,但拟除虫菊酯类杀虫剂的大量使用易导致白纹伊蚊对其抗性水平快速增长,而DDVP属于有机磷类杀虫剂,其残效期长,对人畜高毒,已逐渐被停止使用,随着用药的减少及种群的不断繁殖,进而蚊媒抗性水平出现衰退。兴义及赤水市白纹伊蚊成蚊对3种拟除虫菊酯类杀虫剂的抗性水平与其幼蚊测定结果相近,均判定为抗性种群或可疑抗性种群,而赤水市白纹伊蚊幼蚊及成蚊对残杀威均较为敏感。
Bti是一种生物杀虫剂,具备易降解、不污染环境且蚊媒不易产生抗性等诸多优点,但也存在见效慢、持效期不稳定等不足。Bti的杀虫机制在于形成芽孢时产生的一种伴孢晶体蛋白,该蛋白被虫体吞食后可在虫肠道碱性环境及蛋白酶的作用下解离出毒素,破坏虫肠道上皮细胞,导致虫体死亡[16]。本次测定结果显示,赤水市白纹伊蚊幼蚊对Bti敏感,抗性倍数为1.28倍,当地施用Bti可获理想毒杀效果。有研究表明,Bti与不同化学杀虫剂复配具有良好的增效作用[17],后期当地可进一步开展Bti复配药剂筛选实验,优化Bti与化学杀虫剂的复配比例,以延缓化学杀虫剂的使用寿命。
贵州省白纹伊蚊已对常用化学杀虫剂产生了不同程度的抗药性,沿用传统的杀虫剂施用方式不仅无法有效杀灭媒介伊蚊,还会触发其抗性增强并直接造成环境药物残留,破坏生态平衡,最终通过生物富集作用影响人体健康[18]。因此,必须减轻对化学杀虫剂的依赖程度,加大对绿色防控技术的推广应用,积极使用新型杀虫剂并采取综合防治措施,才能同时实现蚊媒防制与环境保护。在今后的白纹伊蚊防制中,建议当地每1~2年开展1次白纹伊蚊密度及抗药性常规监测,及时掌握抗药性水平变化趋势,停止施用已产生抗药性的杀虫剂,合理选用敏感或低抗药剂,并采用复配或轮换用药方式延缓抗药性的产生及发展,重视环境治理及物理措施,广泛动员群众开展爱国卫生运动,积极清除小型积水容器,当孳生水体无法清理时,尽量采用生物杀虫剂或生物防治方式,保护生态平衡,避免环境污染。
利益冲突 无
| [1] |
中华医学会感染病学分会, 中华医学会热带病与寄生虫学分会, 中华中医药学会急诊分会. 中国登革热临床诊断和治疗指南[J]. 传染病信息, 2018, 31(5): 385-392. Society of Infectious Diseases, Society of Tropical Medicine and Parasitology, Chinese Medical Association Society of Emergency Medicine, China Association of Chinese Medicine. Guidelines for diagnosis and treatment of dengue in China[J]. Infect Dis Inf, 2018, 31(5): 385-392. DOI:10.3969/j.issn.1007-8134.2018.05.001 |
| [2] |
涂涛田, 季恒青, 冯绍全, 等. 重庆市部分地区白纹伊蚊幼虫对4种杀虫剂的敏感性调查[J]. 中国媒介生物学及控制杂志, 2016, 27(5): 506-507. Tu TT, Ji HQ, Feng SQ, et al. A survey on susceptibility of Aedes albopictus larvae to four insecticides in some areas of Chongqing[J]. Chin J Vector Biol Control, 2016, 27(5): 506-507. DOI:10.11853/j.issn.1003.8280.2016.05.024 |
| [3] |
Marimuthu P, Ravinder JR. Trends in clinical trials of dengue vaccine[J]. Perspect Clin Res, 2016, 7(4): 161-164. DOI:10.4103/2229-3485.192035 |
| [4] |
李杨, 张文宏. 全球登革热疫情态势、疫情警报[J]. 中华传染病杂志, 2019, 37(10): 619-621. Li Y, Zhang WH. Dengue fever in global: epidemic situation and alert[J]. Chin J Infect Dis, 2019, 37(10): 619-621. DOI:10.3760/cma.j.issn.1000-6680.2019.10.008 |
| [5] |
李晋涛. 登革热防治研究进展[J]. 第三军医大学学报, 2019, 41(19): 1902-1907. Li J T. Advances in prevention and control for dengue fever[J]. J Third Mil Med Univ, 2019, 41(19): 1902-1907. DOI:10.16016/j.1000-5404.201909095 |
| [6] |
刘起勇. 我国登革热流行新趋势、防控挑战及策略分析[J]. 中国媒介生物学及控制杂志, 2020, 31(1): 1-6. Li QY. Dengue fever in China: new epidemical trend, challenges and strategies for prevention and control[J]. Chin J Vector Biol Control, 2020, 31(1): 1-6. DOI:10.11853/j.issn.1003.8280.2020.01.001 |
| [7] |
中华人民共和国卫生部. GB/T 26347-2010蚊虫抗药性检测方法生物测定法[S]. 北京: 中国标准出版社, 2011. Ministry of Health of the People's Republic of China. GB/T 26347-2010 Test methods of mosquito resistance to insecticides-Bioassay methods[S]. Beijing: China Standards Press, 2011. |
| [8] |
韦凌娅, 孔庆鑫, 王慧敏, 等. 杭州市2017年登革热疫情应急控制前后白纹伊蚊抗药性调查[J]. 中国媒介生物学及控制杂志, 2019, 30(6): 678-681. Wei L Y, Kong QX, Wang HM, et al. Comparison of insecticide resistance of Aedes albopictus before and after emergency control of dengue fever in Hangzhou, China, 2017[J]. Chin J Vector Biol Control, 2019, 30(6): 678-681. DOI:10.11853/j.issn.1003.8280.2019.06.020 |
| [9] |
开文龙. 白纹伊蚊杀虫剂敏感品系的纯化与应用[D]. 北京: 中国疾病预防控制中心, 2018. Kai WL. Application and purification of insecticide susceptible strain of Aedes albopictus[D]. Beijing: Chinese Center for Disease Control and Prevention, 2018. |
| [10] |
Zhang K, Zhang W, Zhang S, et al. Susceptibility of Sogatella furcifera and Laodelphax striatellus (Hemiptera: Delphacidae) to six insecticides in China[J]. J Econ Entomol, 2014, 107(5): 1916-1922. DOI:10.1603/EC14156 |
| [11] |
World Health Organization. "Insecticide resistance in mosquito vectors of disease". Report of a regional working group meeting Salatiga (Indonesia)[R]. New Delhi: WHO, 1997: 6.
|
| [12] |
舒莉萍, 左丽, 郝牧, 等. 贵州自然界白纹伊蚊体内登革病毒带毒情况[J]. 中国公共卫生, 2004, 20(5): 532-534. Shu L P, Zuo L, Hao M, et al. Investigation on dengue virus from Aedes albopictus field in Guizhou[J]. Chin J Public Health, 2004, 20(5): 532-534. DOI:10.11847/zgggws2004-20-05-12 |
| [13] |
舒莉萍, 左丽, 赵星, 等. 贵州白纹伊蚊对登革病毒易感性的研究[J]. 中华实验和临床病毒学杂志, 2004, 18(3): 234-237. Shu L P, Zuo L, Zhao X, et al. Susceptibility of 15 collections of Aedes albopictus from Guizhou to dengue virus oral infection[J]. Chin J Exp Clin Virol, 2004, 18(3): 234-237. DOI:10.3760/cma.j.issn.1003-9279.2004.03.010 |
| [14] |
梁文琴, 林懿, 黎红, 等. 贵阳市白纹伊蚊对常用杀虫剂的抗性研究[J]. 中华卫生杀虫药械, 2018, 24(4): 348-351. Liang W Q, Lin Y, Li H, et al. Resistance of Aedes albopictus to commonly used insecticides in Guiyang city of China[J]. Chin J Hyg Insect Equip, 2018, 24(4): 348-351. DOI:10.19821/j.1671-2781.2018.04.009 |
| [15] |
梁秋果, 文赛, 杨茜, 等. 贵阳市致倦库蚊和白纹伊蚊对4种常用杀虫剂抗药性调查[J]. 中国媒介生物学及控制杂志, 2018, 29(1): 30-33. Liang Q G, Wen S, Yang X, et al. Resistance of Culex pipiens quinquefasciatus and Aedes albopictus to four insecticides in Guiyang, China[J]. Chin J Vector Biol Control, 2018, 29(1): 30-33. DOI:10.11853/j.issn.1003.8280.2018.01.008 |
| [16] |
关雄, 蔡峻. 我国苏云金杆菌研究60年[J]. 微生物学通报, 2014, 41(3): 459-465. Guan X, Cai J. Bacillus thuringiensis: sixty years of research, development and commercial applications in China[J]. Microbiol China, 2014, 41(3): 459-465. DOI:10.13344/j.microbiol.china.130724 |
| [17] |
宋晓, 程鹏, 王海防, 等. 淡色库蚊对苏云金杆菌及化学杀虫剂的抗性研究[J]. 中华卫生杀虫药械, 2019, 25(1): 13-16. Song X, Cheng P, Wang HF, et al. Resistance of Culex pipiens pallens to Bacillus thuringiensis and chemical insecticides[J]. Chin J Hyg Insect Equip, 2019, 25(1): 13-16. DOI:10.19821/j.1671-2781.2019.01.004 |
| [18] |
王俊伟, 周春江, 杨建国, 等. 农药残留在环境中的行为过程、危害及治理措施[J]. 农药科学与管理, 2018, 39(2): 30-34. Wang J W, Zhou CJ, Yang JG, et al. Behavior process, harm and treatment of pesticide residues in environment[J]. Pestic Sci Adm, 2018, 39(2): 30-34. DOI:10.3969/j.issn.1002-5480.2018.02.010 |
 2021, Vol. 32
2021, Vol. 32


