扩展功能
文章信息
- 袁媛, 孙永, 常宏伟, 陈晓龙, 撒楠, 高大维, 苏斌
- YUAN Yuan, SUN Yong, CHANG Hong-wei, CHEN Xiao-long, SA Nan, GAO Da-wei, SU Bin
- 安徽省2018-2019年小肠结肠炎耶尔森菌分型分布及分子特征分析
- Type distribution and molecular characteristics of Yersinia enterocolitica in Anhui province, China, 2018-2019
- 中国媒介生物学及控制杂志, 2021, 32(3): 298-301
- Chin J Vector Biol & Control, 2021, 32(3): 298-301
- 10.11853/j.issn.1003.8280.2021.03.008
-
文章历史
- 收稿日期: 2020-12-15
2 六安市疾病预防控制中心, 安徽 六安 237000;
3 宣城市疾病预防控制中心, 安徽 宣城 242000
2 Lu'an Center for Disease Control and Prevention, Lu'an, Anhui 237000, China;
3 Xuancheng Center for Disease Control and Prevention, Xuancheng, Anhui 242000, China
小肠结肠炎耶尔森菌(Yersinia enterocolitica)是一种对人和动物均具有致病性的人兽共患病原体,也是欧洲细菌性腹泻的第三大原因[1]。该菌经粪口途径传播,人类通过接触污染的水源、食品、感染动物的排泄物感染,受污染的肉类及肉制品等食物常常成为最主要传染源,猪被认为是导致人类致病的主要宿主[2]。小肠结肠炎耶尔森菌可分为70多种血清型,与人类耶尔森菌病相关的血清型通常为O∶3、O∶5、O∶8、O∶9与27血清型[3],在欧洲和北美生物主要流行的生物血清型为4/O∶3型[4-5],3/O∶3型是中国最流行的生物血清型[6]。该菌致病性和毒力机制仍然比较复杂,位于致病性菌株染色体上的黏附侵袭位点基因(ail)和耐热性肠毒素A基因(ystA)基因是最常用的染色体靶标基因,ail基因介导该菌的侵袭性,ystA是其致泻的主要原因。该菌中的另一个致病因子为pYV质粒,包含黏附素(yadA)和yop调节子转录活化因子(virF)基因,编码称为Yops蛋白质的产生,具有黏附和抑制吞噬等作用。由于在中国的国家监测系统中无法报告耶尔森菌病,因此大多数医院都没有对小肠结肠炎耶尔森菌进行常规检测,只有少数研究中零星数据的报道。
在过去几十年中,脉冲场凝胶电泳(PFGE)作为细菌分型的金标准,可以比较不同国家或地区微生物的细菌种群。为了研究近年来安徽省小肠结肠炎耶尔森菌分布状况及分子病原学特征,对2018-2019年从腹泻患者、动物、蝇类媒介外环境及各类食品中分离的菌株进行生化鉴定、血清学分型、毒力基因及PFGE分析,为今后小肠结肠炎耶尔森菌在各类样品中的监测及人群感染防控提供科学依据。
1 材料与方法 1.1 材料来源2018-2019年采集安徽省六安、宣城、合肥、铜陵市共计2 186份家禽家畜、病例、生熟食品、蝇类媒介外环境等各类标本,进行小肠结肠炎耶尔森菌分离鉴定。参考菌株ATCC23715购自中国药品生物制品检定所。
1.2 主要试剂选择性培养基为北京路桥技术有限公司产品;API20E生化鉴定条购自法国梅里埃公司;分型血清购自日本生研株式会社;核酸提取试剂盒购自中国台湾圆点公司;限制性内切酶购自Promega公司。
1.3 生化鉴定和血清凝集试验将分离菌株纯培养物进行生化鉴定,血清玻片凝集试验,同时生理盐水做自凝对照实验。
1.4 DNA模板制备和毒力相关基因检测核酸提取实验操作步骤及程序设置按照核酸提取仪及试剂盒说明书进行,提取核酸的洗脱体积为50 μl,-20 ℃冻存备用。毒力基因鉴定按参考文献[7]鉴定:小肠结肠炎耶尔森菌ail、ystA、耐热性肠毒素B基因(ystB)、yadA和yop调节子virF。模板量为5 μl,总反应体积25 μl。反应条件为:预变性95 ℃ 4 min,1个循环;变性95 ℃30 s,退火62 ℃30 s,延伸72 ℃90 s,30个循环;72 ℃5 min。使用1.5%的琼脂糖凝胶对扩增产物进行分离鉴定。
1.5 分子分型按照中国疾病预防控制中心《小肠结肠炎耶尔森菌实验室分离与鉴定手册》中PFGE方法,对随机选取的22株小肠结肠炎耶尔森菌进行分子分型,用Bionumerics软件对PFGE结果进行遗传变异分析。
1.6 统计学分析使用EpiData 3.1软件建立数据库,双重录入并检错,使用SPSS 13.0软件进行数据分析,计数资料采用绝对数进行描述,构成比比较采用χ2检验,检验水准为α=0.05。
2 结果 2.1 标本分离率2018-2019年安徽省2 186份标本共分离出97株小肠结肠炎耶尔森菌,分离率为4.44%,其中家禽家畜动物粪便分离率为5.12%(31/605),病例分离率为2.21%(20/903),生熟肉类食品分离率为8.94%(42/470),蝇类媒介外环境分离率为1.92%(4/208)。
2.2 血清学分型结果97株菌株经Api20E生化鉴定均为小肠结肠炎耶尔森菌,由于分型血清类型有限,共有O∶1,2、O∶3、O∶5、O∶8、O∶9五种血清型,97株小肠结肠炎耶尔森菌中分出O∶1,2血清型4株,占4.12%,O∶3血清型21株,占21.65%,O∶5血清型17株,占17.53%,O∶8血清型13株,占13.40%,O∶9血清型6株,占6.19%,未定型36株,占37.11%。血清分型在不同菌株来源组差异有统计学意义(χ2=64.160,P < 0.001)。见表 1。
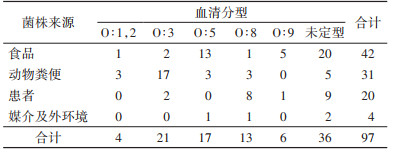
|
对97株分离的菌株进行ail、ystA、ystB、yadA和virF 5种毒力基因PCR检测,结果见表 2。其毒力基因分布特征为:21株O∶3血清型菌株有19株均携带ail、ystA、yadA和virF 4种毒力基因,即ail+、ystA+、ystB-、yadA+、virF+,占19.59%,3株为ail+、ystA+、ystB-、yadA-和virF-,占3.09%,其余除13株全部阴性外,均携带ystB基因,即ail-、ystA-、ystB+、yadA-和virF-,占63.92%。血清分型在不同基因型组间差异有统计学意义(χ2=103.591,P < 0.001)。见表 2。
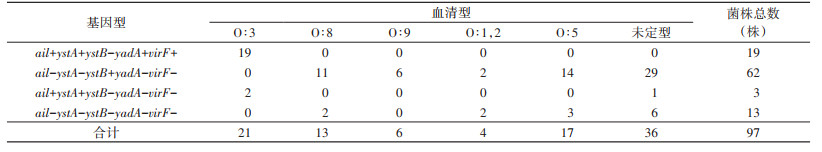
|
22株菌经NotⅠ内切酶酶切,将PFGE电泳图像储存为TIFF格式,用数据处理软件Bionumerics(version 5.0)识别图像条带,使用参考菌株Salmonella Braenderup H9812(XbaⅠ酶切)作为分子质量标准进行校准,必要时进行人工校正处理。选择20 kb以上可识别的条带进行聚类分析,小于Marker最小片段的条带被舍去。使用非加权配对算术平均法(unweighted pair group method using arithmetic averages,UPGMA)进行条带聚类。22株小肠结肠炎耶尔森菌共分为20种PFGE带型,图谱条带数为17~31条,主要酶切条带集中在25~240 kb,不同地市菌株带型比较独特,不同血清型带型分布广泛,未发现存在交叉性,不同年份同一地市的猪标本和腹泻患者中各有2株O∶3血清型致病性菌株,带型基本相同,相似性≥95.00%。见图 1。
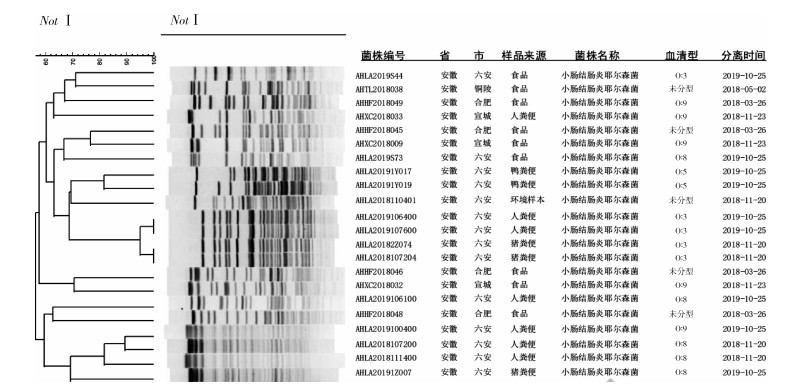
|
| 图 1 安徽省小肠结肠炎耶尔森菌脉冲场凝胶电泳分型聚类结果 Figure 1 Typing and clustering results with pulsed-field gel electrophoresis for Yersinia enterocolitica isolates from Anhui province |
| |
小肠结肠炎耶尔森菌在我国分布广泛[8]。通过对安徽省2018-2019年的不同地区采集标本进行监测,分析该菌在不同来源、不同类型样本中的相对分布情况,结果发现致病性菌株在安徽省家畜家禽中分离率最高,猪为小肠结肠炎耶尔森菌的主要宿主,非致病性菌株在生熟肉制品中分离率最高。但是小肠结肠炎耶尔森菌病在中国腹泻病患者中报告较少,多为散发,可能由于临床腹泻病例中可能存在漏报和就诊前服药等情况,从而使该菌的分离率普遍较低,河南省监测的病例分离率为0.26%[9],2018-2019年该菌在安徽省的分离率为2.21%,分离率略高于其他省份,在动物粪便的分离率为5.12%。在欧洲,采用荧光PCR和传统培养方法比较发现,猪扁桃体中该菌的阳性率分别为88.00%和34.00%,远高于粪便的分离率[10]。有研究小组使用PCR方法在婴儿粪便检测到约为20.00%的感染率[11],说明该菌在动物和人的感染情况远高于传统粪便分离培养的分离率。在今后的监测中,可以尝试在应用传统分离培养的同时,使用更为灵敏的PCR方法,并且采集不同类型的宿主样本,以提高在各种样品中的检出率。
本次监测结果与我国小肠结肠炎耶尔森菌非致病性菌株和致病性菌株的血清型和毒力基因分布情况一致。在我国致病性血清型主要为O∶3型[7],在安徽省本次分离的菌株中也获得了相似结果,O∶3型菌株从17株动物宿主猪和2名腹泻病例中分离出来,均携带ail、ystA、yadA和virF毒力基因,为典型的致病性菌株特征,从大多数病例、食品和其他蝇类媒介外环境等标本中分离出的菌株多为ystB+菌株,血清型别较为分散,其中血清型O∶5(17/97)和未定型菌株(36/97)是分析样品中占比较大的2个血清型,与国外研究相近[12]。该基因仅存于部分生物1A型菌株,该类菌株不携带其他毒力基因,属于传统意义上的非致病性菌株。但是该生物型菌株在腹泻患者、各类食品、环境、水和健康动物中的高流行性,说明该生物型菌株的致病潜力值得进一步研究。
当对不同来源的菌株进行PFGE分析时发现,不同年份的腹泻病例(2019年)和当地的宿主动物猪(2018年)在同一个聚类簇里,两者之间存在较高的同源性,相似性≥95.00%。表明动物分离株和人类感染存在联系。在世界范围内的大多数国家,猪被认为是致病性菌株的主要储存宿主。该菌具有在低温下的生长能力,这些因素均增加了其通过污染的猪肉、水源或者生熟食品的交叉污染进入食物链传播的可能性。猪是引起耶尔森菌病流行和暴发的载体[11],本次安徽省的监测于不同年份在宿主和病例中发现高度同源的菌株,提示在生猪肉的屠宰、产品销售和肉制品加工等环节,无论地理位置或是时间的不同,都有可能导致人类感染的风险。从ystB+腹泻病例、食物和环境中分离的非致病性菌株在其条带之间具有更大的多样性并且扩散到其他簇,这种多样性可能与该生物型的血清型的多样性有关。从目前的监测尚未发现非致病性菌株中病例与环境食品等样本之间的联系性。
本次监测在不同年份的人和动物中分离出高度同源的菌株,提示该菌在动物宿主的传播中,可能持续对食品安全和公共卫生构成潜在威胁,需要进一步的流行病学调查,确定小肠结肠炎耶尔森菌的传播途径。
利益冲突 无
| [1] |
Le Guern AS, Martin L, Savin C, et al. Yersiniosis in France: overview and potential sources of infection[J]. Int J Infect Dis, 2016, 46: 1-7. DOI:10.1016/j.ijid.2016.03.008 |
| [2] |
Chlebicz A, Śliżewska K. Campylobacteriosis, Salmonellosis, Yersiniosis, and Listeriosis as zoonotic foodborne diseases: a review[J]. Int J Environ Res Public Health, 2018, 15(5): 863. DOI:10.3390/ijerph15050863 |
| [3] |
Filik K, Szermer-Olearnik B, Wernecki M, et al. The podovirus φ80-18 targets the pathogenic American biotype 1B strains of Yersinia enterocolitica[J]. Front Microbiol, 2020, 11: 1356. DOI:10.3389/fmicb.2020.01356 |
| [4] |
Råsbäck T, Rosendal T, Stampe M, et al. Prevalence of human pathogenic Yersinia enterocolitica in Swedish pig farms[J]. Acta Vet Scand, 2018, 60(1): 39. DOI:10.1186/s13028-018-0393-5 |
| [5] |
Duan R, Liang JR, Zhang J, et al. Prevalence of Yersinia enterocolitica bioserotype 3/O∶3 among children with diarrhea, China, 2010-2015[J]. Emerg Infect Dis, 2017, 23(9): 1502-1509. DOI:10.3201/eid2309.160827 |
| [6] |
Liang JR, Kou ZQ, Qin S, et al. Novel Yersinia enterocolitica prophages and a comparative analysis of genomic diversity[J]. Front Microbiol, 2019, 10: 1184. DOI:10.3389/fmicb.2019.01184 |
| [7] |
景怀琦, 李继耀, 肖玉春, 等. O∶3和O∶9小肠结肠炎耶尔森菌主要毒力基因分布调查[J]. 中国媒介生物学及控制杂志, 2004, 15(4): 317-319. Jing HQ, Li JY, Xiao YC, et al. PCR detection and investigation of distribution of virolence factors for Yersinia enterocolitic serotype O∶3 and O∶9[J]. Chin J Vector Biol Control, 2004, 15(4): 317-319. DOI:10.3969/j.issn.1003-4692.2004.04.024 |
| [8] |
曹严华, 夏胜利, 顾玲, 等. 2004-2005年我国部分地区小肠结肠炎耶尔森菌宿主分布调查[J]. 中国媒介生物学及控制杂志, 2007, 18(3): 238-240. Cao YH, Xia SL, Gu L, et al. Investigation on host-distribution of Yersinia enterocolitica in China in 2004 and 2005[J]. Chin J Vector Biol Control, 2007, 18(3): 238-240. DOI:10.3969/j.issn.1003-4692.2007.03.019 |
| [9] |
穆玉姣, 张白帆, 潘静静, 等. 河南省小肠结肠炎耶尔森菌病原学特征和分子分型研究[J]. 中华微生物学和免疫学杂志, 2019, 39(3): 180-184. Mu YJ, Zhang BF, Pan JJ, et al. Etiological characteristics and molecular typing of Yersinia enterocolitica in Henan province[J]. Chin J Microbiol Immunol, 2019, 39(3): 180-184. DOI:10.3760/cma.j.issn.0254-5101.2019.03.004 |
| [10] |
Fredriksson-Ahomaa M, Stolle A, Stephan R. Prevalence of pathogenic Yersinia enterocolitica in pigs slaughtered at a Swiss abattoir[J]. Int J Food Microbiol, 2007, 119(3): 207-212. DOI:10.1016/j.ijfoodmicro.2007.07.050 |
| [11] |
Liang JR, Wang X, Xiao YC, et al. Prevalence of Yersinia enterocolitica in pigs slaughtered in Chinese abattoirs[J]. Appl Environ Microbiol, 2012, 78(8): 2949-2956. DOI:10.1128/AEM.07893-11 |
| [12] |
Tennant SM, Grant TH, Robins-Browne RM. Pathogenicity of Yersinia enterocolitica biotype 1A[J]. FEMS Immunol Med Microbiol, 2003, 38(2): 127-137. DOI:10.1016/S0928-8244(03)00180-9 |
 2021, Vol. 32
2021, Vol. 32


