扩展功能
文章信息
- 李贵昌, 王玉姣, 母群征, 夏青, 栗冬梅, 岳玉娟, 鲁亮, 赵宁, 李文, 宋秀平, 王君, 吴海霞, 李兴洲, 刘起勇
- LI Gui-chang, WANG Yu-jiao, MU Qun-zheng, XIA Qing, LI Dong-mei, YUE Yu-juan, LU Liang, ZHAO Ning, LI Wen, SONG Xiu-ping, WANG Jun, WU Hai-xia, LI Xing-zhou, LIU Qi-yong
- 北京市平谷区恙虫病自然疫源地宿主、媒介和病原体调查
- An investigation of the hosts, vectors, and pathogens of scrub typhus in Pinggu natural focus of Beijing, China
- 中国媒介生物学及控制杂志, 2021, 32(3): 291-297
- Chin J Vector Biol & Control, 2021, 32(3): 291-297
- 10.11853/j.issn.1003.8280.2021.03.007
-
文章历史
- 收稿日期: 2021-03-15
2 佳木斯大学公共卫生学院, 黑龙江 佳木斯 154007;
3 山东第一医科大学公共卫生学院, 山东 泰安 271016
2 School of Public Health, Jiamusi University, Jiamusi, Heilongjiang 154007, China;
3 School of Public Health, Shandong First Medical University, Tai'an, Shandong 271016, China
恙虫病(scrub typhus)是由恙螨幼虫叮咬而感染恙虫病东方体(Orientia tsutsugamushi,Ot)的一种自然疫源性疾病。Ot必须能经卵传递给下一代恙螨幼虫,它才能传播给人,因此恙螨既是媒介又是宿主。恙螨也可以通过叮咬鼠类等小型兽类宿主获得Ot,一般将恙螨视作媒介,而将鼠类作为宿主。我国近年来恙虫病发病率不断上升,发病区域不断扩大[1],然而一些新发疫区的宿主和媒介尚未开展调查。在秦岭-大别山-长江下游以北和燕山山脉以南存在广泛的秋季型恙虫病疫区[2]。该疫区以黑线姬鼠(Apodemus agrarius)、褐家鼠(Rattus norvegicus)、大仓鼠(Tscherskia triton)、北社鼠(Niviventer confucianus)、朝鲜姬鼠(A. peninsulae)为主要宿主动物,各疫区宿主动物并不完全一致。已知的小盾纤恙螨(Leptotrombidium scutellare)为主要传播媒介,但在山西省南部晋南地区姬鼠纤恙螨(L. apodemi)可能是当地主要媒介[3-4]。可见该疫区各地宿主、媒介存在差异,有必要对新发疫区宿主、媒介开展调查研究。
2008年北京市平谷区首次报告本地恙虫病病例,截至2018年共报告899例,患者以农民为主,发病时间集中在9-11月[5],属于秋季型疫区。吕燕宁等[6]调查北京市区及郊区鼠类种类及病原体携带率,其中平谷区捕获44只,褐家鼠、北社鼠、黑线姬鼠和朝鲜姬鼠分别为29、9、5和1只。经Ot 47 kDa基因荧光定量PCR对标本脏器中检测,鼠阳性率为4.50%(2/44)。Li等[7]证实平谷区病例感染的Ot基因型为Kawasaki型。该疫区至今尚无宿主、媒介种类和动物感染Ot分型的报道。本研究通过在平谷区连续采集鼠类等小兽及体表寄生恙螨,检测小兽脏器Ot核酸片段,了解当地小兽和体表恙螨构成、季节变化和Ot基因型,为确定疫源地性质,制定科学的恙虫病防控措施提供依据。
1 材料与方法 1.1 现场调查自2018年9月至2019年8月,每月中旬在平谷区的野外果园、农田、荒地、林地等生境沿直线或延田埂、沟渠、林带布放鼠夹,每5 m布放1夹。使用贵溪李氏捕鼠器械有限公司生产的中号钢板夹,以生花生米为诱饵,晚放晨收。捕获小兽连同鼠夹放入塑料自封袋中带回。在恙虫病发病高峰的2018年9-11月按东西和南北方位设4×3共12个采样点(图 1中蓝色点)。其他月份的采样点选择在上述捕获小兽密度高且恙螨数量较多的地点布放鼠夹(图 1中粉色点)。
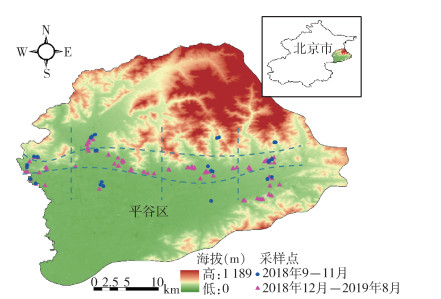
|
| 图 1 北京市平谷区宿主动物调查点分布 Figure 1 The distribution of surveillance sites in Pinggu district, Beijing |
| |
在白瓷盘中梳理小兽体毛,捡获恙螨等体外寄生虫,将有恙螨的小兽耳、皮肤等剪下,放入5 ml离心管中,每只鼠的鼠耳放1管,室温或4 ℃冰箱保存1~3 d,然后-20 ℃冷冻。解剖镜下捡取或刮取恙螨并计数,恙螨放75%乙醇溶液中-20 ℃保存。按季节、生境、宿主分层抽取一定比例的恙螨,用霍氏封片液制作玻片标本,玻片55 ℃烤箱烘干。在显微镜下根据恙螨形态特征鉴定种类[8-9]。
1.3 小兽病原体检测和基因分型在无菌条件下解剖小兽,取脾、肝等脏器组织,放入冻存管中,-20 ℃保存。采用《恙虫病预防控制指南(试用)》(中疾控疾发〔2009〕1号)中推荐的巢式PCR方法检测Ot 56 kDa表面蛋白基因核酸片段。第二轮扩增产物在1%琼脂糖凝胶上电泳,PCR阳性者送北京奥科鼎盛生物科技有限公司测序,以测序获得Ot核酸序列者为Ot阳性。根据文献[10]从GenBank中下载已确定基因分型的Ot序列确定基因分型。
1.4 病例数据来源平谷区恙虫病报告病例数来自中国疾病预防控制中心疾病监测信息报告管理系统。
1.5 统计分析及计算公式用ArcGIS 10.0软件绘制地图,用Excel 2019和SPSS 20.0软件录入和整理数据、绘制统计图表。采用MEGA 7.0软件中的最大似然法建立系统发育树。按照下面公式计算小兽捕获率、带恙螨率和恙螨指数,其中恙螨指数按分层抽样比例推算出每一种恙螨数量,作为计算依据。
捕获率(%)=(捕获小兽数/有效夹数)×100
带恙螨率(%)=(带恙螨小兽数/捕获小兽总数)×100
恙螨指数=捕获恙螨总数/捕获小兽总数。
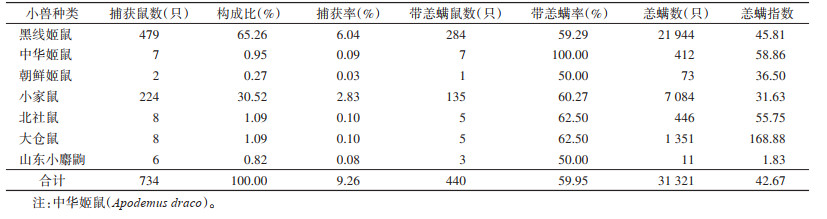
2 结果 2.1 小兽及体表恙螨种类和数量2018年9月至2019年8月在平谷区野外共布放7 926只有效鼠夹,捕获小型兽类734只,总捕获率为9.26%。小兽包括2目3科5属共7种(表 1),其中黑线姬鼠和小家鼠(Mus musculus)分别占捕获小兽总数的65.26%和30.52%,为该地区的优势鼠种。
|
小兽体表共采集到31 321只恙螨,总带恙螨率为59.95%,总恙螨指数为42.67。不同小兽恙螨指数差异较大,大仓鼠最高为168.88,山东小麝鼩(Crocidura shantungensi)最低为1.83。黑线姬鼠和小家鼠带恙螨率和恙螨指数虽不是最高,但2种鼠类数量多,其携带的恙螨占总数的92.69%,远多于其他小兽,是恙螨的主要寄生宿主。
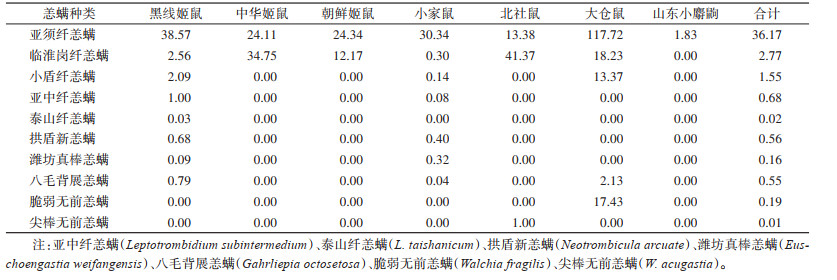
抽取5.45%(1 708只)小兽体表恙螨,共鉴定出1科5属10种,亚须纤恙螨(L. subpalpale)占84.79%,是优势螨种,临淮岗纤恙螨(L. linhuaikangense)、小盾纤恙螨数量次之,分别占6.49%和3.63%。亚须纤恙螨和临淮岗纤恙螨宿主分别为7和6种,而小盾纤恙螨只有大仓鼠、黑线姬鼠和小家鼠3种。见表 2。
|
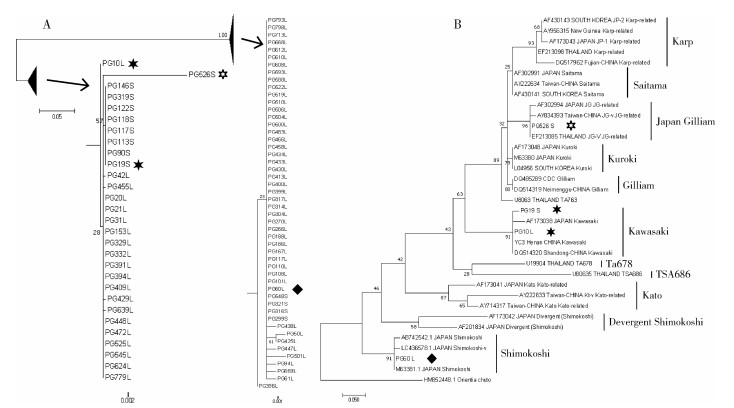
用巢式PCR检测725只小兽肝和脾的Ot 56 kDa蛋白基因,79只小兽为阳性,总阳性率为10.90%。将扩增的Ot基因序列(长115~124 bp)建最大似然树,可以形成2个分支,其中PG526号分支较长(图 2A)。选择PG526和图 2A中2个分支中的3条序列再与文献中的参考序列建树(以O. chuto序列为根),可见平谷区的Ot包括Kawasaki、Shimokoshi和Japan Gilliam(JG)3种基因型,以Kawasaki和Shimokoshi型为主(图 2B)。
|
注:A为所有平谷区序列的进化树;B为4条平谷区序列与参考序列的进化树;箭头指向分支扩展以后序列分支; ◆分别表示与参考序列比对的序列。
图 2 北京市平谷区恙虫病东方体56 kDa蛋白基因序列最大似然树
Figure 2 The maximum likelihood tree based on the DNA sequence of Ot 56 kDa protein gene in Pinggu district, Beijing ◆分别表示与参考序列比对的序列。
图 2 北京市平谷区恙虫病东方体56 kDa蛋白基因序列最大似然树
Figure 2 The maximum likelihood tree based on the DNA sequence of Ot 56 kDa protein gene in Pinggu district, Beijing
|
| |
山东小麝鼩、小家鼠、中华姬鼠和黑线姬鼠Ot阳性率分别为20.00%、14.86%、14.29%和9.30%。黑线姬鼠和小家鼠共占97.47%(77/79),是当地主要Ot宿主。见表 3。
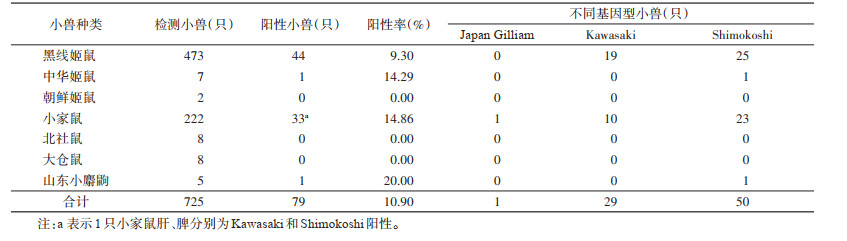
|
平谷区2008-2019年共报告1 011例恙虫病,9-11月病例占99.31%,10月发病数最高,11月高于9月,其余6例发病时间为1月1例、2月1例、6月3例、7月1例。该地全年小兽捕获率波动较大,2月捕获率最低。每月的小兽中均能检出Ot,2和10月为2个阳性率高峰,1-4月Ot阳性率比发病高峰的10月更高。亚须纤恙螨和临淮岗纤恙螨均在3和11月有2个高峰。亚须纤恙螨自10月持续到翌年6月,临淮岗纤恙螨只出现在9-11月和3-4月两季,冬季未出现。小盾纤恙螨只分布于9-11月,10月是最高峰,且9月高于11月。其季节消长与恙虫病发病基本一致,且其高峰早于发病高峰。见图 3。
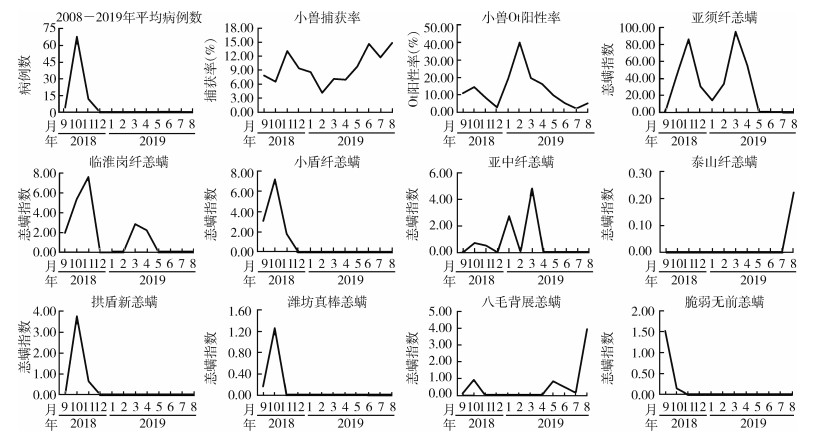
|
| 注:图中不包括仅出现于9月数量少的尖棒无前恙螨;Ot为恙虫病东方体。 图 3 北京市平谷区恙虫病病例数、小兽密度、Ot阳性率和部分种类恙螨指数的季节变化 Figure 3 Seasonal variation of number of cases, density of small mammals, positive rate of Ot, and chigger mite index of several species in Pinggu district, Beijing |
| |
平谷区北部和东南部为山区,中部和西南部为平原区。在2018年9-11月共捕获小兽6种324只,其中321只检测了病原体,阳性率为10.56%。黑线姬鼠在所有调查点均有分布,小家鼠分布在山区采样点4以外的所有点(图 4A)。除采样点6、10以外的其他采样点小兽均检出Ot阳性,Shimokoshi型比Kawasaki型分布更广(图 4B)。小兽体表恙螨9种21 115只,恙螨指数为65.17。恙螨指数总体上北部高于南部。山区和靠近山区的地点恙螨种类更丰富。亚须纤恙螨分布最广各采样点均有分布,小盾纤恙螨只分布在北部和中部靠近山区的点,远离山区的平原采样点(编号3、6、7、9、12)均未发现小盾纤恙螨(图 4C)。
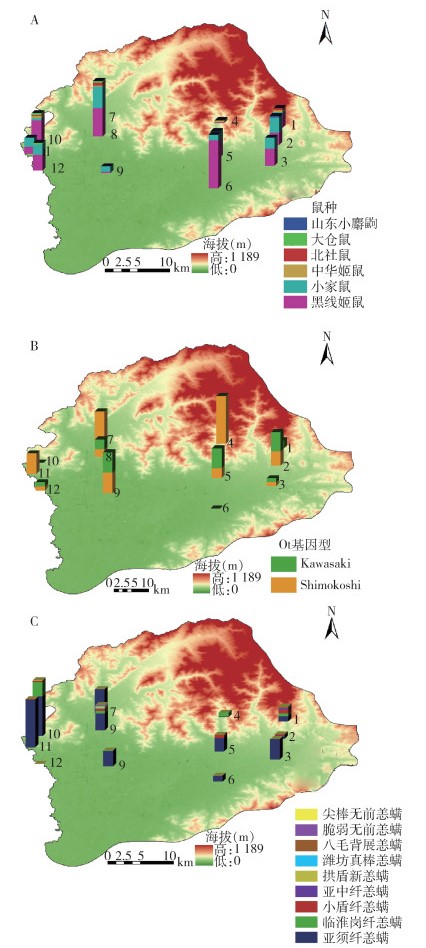
|
| 注:图中柱形高度分别代表:A小兽捕获率(%);B Ot阳性率(%);C恙螨指数;1~12为采样点编号;Ot为恙虫病东方体。 图 4 北京市平谷区2018年9-11月各采样地点小兽捕获率(A)、病原体阳性率(B)和恙螨指数(C) Figure 4 Capture rate of small mammals (A), positive rate of pathogen (B), and chigger mite index (C) in the surveillance sites of Pinggu district, Beijing, from September to November in 2018 |
| |
平谷区位于北京市东北部,华北平原北部,背靠燕山山脉,属温带季风性气候区。2008年平谷区首次报告本地恙虫病病例,是近年来出现的新发恙虫病疫源地,其发病季节集中于9-11月,高峰期在10月,与其东南相邻的天津市蓟州区(蓟县)同属秋季型恙虫病疫源地。1990年蓟县发生恙虫病流行,波及15个乡23个村,从病人分离到1株Ot,经间接免疫荧光检测鉴定为Gilliam血清型。此后对蓟县鼠类调查中发现褐家鼠(60.40%)和黑线姬鼠(28.10%)为当地主要鼠种,褐家鼠血清Ot抗体阳性率为13.90%,而黑线姬鼠未检出阳性,据此该作者认为褐家鼠是当地主要宿主[11]。本次调查发现黑线姬鼠和小家鼠分别占65.26%和30.52%,是平谷区野外的优势鼠种。2种鼠类Ot阳性率分别为9.30%和14.86%,其体表恙螨指数也比较高。虽然山东小麝鼩和中华姬鼠感染率也比较高,但这2种小兽数量较少,分布范围局限,其作用小于前述2种宿主。大仓鼠是山东省的恙虫病主要宿主之一,而在平谷区大仓鼠虽然体表恙螨指数高,但数量少,且未检出病原体阳性,在本地恙虫病流行中不能成为主要宿主。因此黑线姬鼠和小家鼠是该区野外主要Ot宿主。吕燕宁等[6]发现平谷区鼠类以褐家鼠为优势鼠种,在华北地区褐家鼠主要栖息在居民区附近,本次野外调查未捕获褐家鼠,其在平谷区疫源地中的作用还需要进一步调查。
Kawasaki型已被证实是山东、安徽、河南等省我国秋季型疫源地中主要Ot基因型[12-14]。Li等[7]证实平谷区病人Ot为Kawasaki基因型。本研究从平谷区小兽中不仅检出Kawasaki基因型,还发现Shimokoshi型和JG型。1984年Shimokoshi血清型Ot在日本东北部首次被发现,目前在日本感染该型病例仅报道几例[15]。Zhang等[13]曾在我国山东省亚须纤恙螨中检出Shimokoshi型。平谷区小兽中Shimokoshi型阳性率比Kawasaki型还高,其分布广泛,几乎全年均可检出,但在平谷区和周边地区人群中至今未检出Shimokoshi型核酸或抗体,推测可能是传播该型Ot的恙螨不嗜叮人或者与人接触机会少,此推测还需要进一步研究证实。JG型也主要分布在日本,在平谷区出现于4月,与Shimokoshi型一样,对其在平谷区疫源地中的致病性、传播媒介和潜在危害还需深入研究[16]。
与平谷区相邻的蓟县鼠体恙螨以小盾纤恙螨(43.10%)为主,在褐家鼠、黑线姬鼠体表均有寄生,根据恙螨数量和发生季节推测小盾纤恙螨可能是天津市疫区传播媒介[11]。同样,山东、安徽、江苏、河南、河北等省秋季型恙虫病疫源地均被证实以小盾纤恙螨为传播媒介[3, 14]。本研究证实平谷区小盾纤恙螨在该地仅占3.63%,但是该恙螨出现季节与人群发病季节一致,其出现高峰略早于人群发病高峰,本地区也未发现其他已确认的媒介恙螨种类。结合既往研究,我们认为小盾纤恙螨应是平谷区恙虫病的主要传播媒介。小盾纤恙螨分布在山区或靠近山区的丘陵、平原地带,这些地区也是恙虫病高发地区,是监测和防控的重点区域[5]。
亚须纤恙螨是平谷区小兽体表恙螨的优势螨种。亚须纤恙螨与须纤恙螨(L. palpale)形态差别主要在体型较小,足指数、背板和背板毛等的测量值均明显小于须纤恙螨,但上述特征是种间差异还是同一螨种不同地理种群变异还存在争议[8-9]。我国目前描述的须恙螨均符合亚须纤恙螨的特征,平谷区的亚须纤恙螨发现还有其他形态差异,可与须纤恙螨区分开,因此本文将其鉴定为亚须纤恙螨。但是两者出现季节和生态习性上具有相似特征,因此至少应是近缘种,在恙虫病传播上可能有相似之处。日本Seto等[17]和我国Zhang等[13]均从鼠体须纤恙螨体内检出Ot的Shimokoshi基因型,说明须纤恙螨和亚须纤恙螨能自然携带该型病原体。韩国Shin等[18]检测自然感染的须纤恙螨的F1代和F2代,Ot阳性率分别为100%和94.30%,说明须纤恙螨可以将Ot经卵传递给子代,该螨可以作为Ot的储存宿主。该报道并未说明须纤恙螨传播Ot基因型。我们发现平谷区在1月(1例)、2月(1例)、6月(3例)和7月(1例)均有个别病例,这些季节没有小盾纤恙螨,而亚须纤恙螨数量较多,是否由其叮咬传播以及是否感染的是Shimokoshi型病原体均属未知。因此亟需对我国的亚须纤恙螨与须纤恙螨的关系及其在疫源地中的作用开展深入研究。
本次调查基本可以确定平谷区疫源地以小盾纤恙螨为主要传播媒介,黑线姬鼠和小家鼠是主要宿主,在该疫源地存在至少3个Ot基因型,基本阐明了恙虫病自然疫源地基本要素。但本次调查地点覆盖范围有限,且未采集居民区鼠类,需在今后工作中补充相关数据,有针对性的提出防控措施。
利益冲突 无
| [1] |
Yue YJ, Ren DS, Liu XB, et al. Spatio-temporal patterns of scrub typhus in mainland China, 2006-2017[J]. PLoS Negl Trop Dis, 2019, 13(12): e0007916. DOI:10.1371/journal.pntd.0007916 |
| [2] |
李贵昌, 王玉姣, 岳玉娟, 等. 我国恙虫病夏季型和秋季型疫区划分研究[J]. 中国媒介生物学及控制杂志, 2019, 30(6): 233-236. Li GC, Wang YJ, Yue YJ, et al. Division of epidemic areas for summer and autumn-type scrub typhus in China[J]. Chin J Vector Biol Control, 2019, 30(6): 233-236. DOI:10.11853/j.issn.1003.8280.2019.03.001 |
| [3] |
姜志宽, 吴光华, 王长军, 等. 我国秋冬型恙虫病流行病学研究概况[J]. 中华卫生杀虫药械, 2014, 20(3): 209-212, 215. Jiang ZK, Wu GH, Wang CJ, et al. General situation of epidemiology of tsutsugamushi disease of autumn-winter type in China[J]. Chin J Hyg Insect Equip, 2014, 20(3): 209-212, 215. DOI:10.19821/j.1671-2781.2014.03.003 |
| [4] |
张金桐, 张洪杰, 郭天宇, 等. 晋南地区恙虫病疫源地的发现及其动物流行病学特点[J]. 寄生虫与医学昆虫学报, 1999, 6(3): 172-177. Zhang JT, Zhang HJ, Guo TY, et al. The discovery of natural foci of tsutsugamushi disease in southern Shanxi province and its zoo-epidemiologic characteristics[J]. Acta Parasitol Med Entomol Sin, 1999, 6(3): 172-177. |
| [5] |
王玉姣, 闫冬明, 李贵昌, 等. 北京市平谷区2008-2018年恙虫病流行特征分析[J]. 中国媒介生物学及控制杂志, 2019, 30(3): 244-247. Wang YJ, Yan DM, Li GC, et al. Epidemiological characteristics of scrub typhus in Pinggu district of Beijing, China, in 2008-2018[J]. Chin J Vector Biol Control, 2019, 30(3): 244-247. DOI:10.11853/j.issn.1003.8280.2019.03.003 |
| [6] |
吕燕宁, 李良辰, 窦相峰, 等. 2013年北京地区小兽中3种病原携带状况调查[J]. 中国媒介生物学及控制杂志, 2016, 27(4): 336-340. Lyu YN, Li LC, Dou XF, et al. An investigation on the harborage of three pathogens in small mammals in Beijing area, 2013[J]. Chin J Vector Biol Control, 2016, 27(4): 336-340. DOI:10.11853/j.issn.1003.8280.2016.04.006 |
| [7] |
Li WH, Dou XF, Zhang LQ, et al. Laboratory diagnosis and genotype identification of scrub typhus from Pinggu district, Beijing, 2008 and 2010[J]. Am J Trop Med Hyg, 2013, 89(1): 123-129. DOI:10.4269/ajtmh.12-0728 |
| [8] |
黎家灿, 王敦清, 陈兴保. 中国恙螨: 恙虫病媒介和病原体研究[M]. 广州: 广东科技出版社, 1997: 18-551. Li JC, Wang DQ, Chen XB. Trombiculid mites of China: studies on vector and pathogen of tsutsugamushi disease[M]. Guangzhou: Guangdong Publishing House of Science and Tequnich, 1997: 18-551. |
| [9] |
Stekolnikov AA. Leptotrombidium (Acari: Trombiculidae) of the World[J]. Zootaxa, 2013, 3728(1): 1-173. DOI:10.11646/zootaxa.3728.1.1 |
| [10] |
Kelly DJ, Fuerst PA, Ching WM, et al. Scrub typhus: the geographic distribution of phenotypic and genotypic variants of Orientia tsutsugamushi[J]. Clin Infect Dis, 2009, 48 Suppl 3: S203-230. DOI:10.1086/596576 |
| [11] |
张之伦, 于长水. 天津市恙虫病的发现及国内外研究概况[J]. 疾病监测, 1996, 11(3): 103-106. Zhang ZL, Yu CS. The discovery and general situation of the study on the scrub typhus in Tianjin[J]. Dis Surveill, 1996, 11(3): 103-106. DOI:10.3784/j.issn.1003-9961.1996.3.103 |
| [12] |
Zhang SY, Song HB, Liu Y, et al. Scrub typhus in previously unrecognized areas of endemicity in China[J]. J Clin Microbiol, 2010, 48(4): 1241-1244. DOI:10.1128/JCM.01784-09 |
| [13] |
Zhang M, Zhao ZT, Wang XJ, et al. Genetic variants of Orientia tsutsugamushi in domestic rodents, Northern China[J]. Emerg Infect Dis, 2013, 19(7): 1135-1137. DOI:10.3201/eid1907.120984 |
| [14] |
李贵昌, 李永香, 陈传伟, 等. 河南省永城市恙虫病自然疫源地调查研究[J]. 中国媒介生物学及控制杂志, 2019, 30(3): 255-258. Li GC, Li YX, Chen CW, et al. An investigation of natural focus of scrub typhus in Yongcheng, Henan province, China[J]. Chin J Vector Biol Control, 2019, 30(3): 255-258. DOI:10.11853/j.issn.1003.8280.2019.03.006 |
| [15] |
Seto J, Tanaka S, Murakata T, et al. Scrub typhus caused by Shimokoshi type Orientia tsutsugamushi showing variant 56‐kDa type‐specific antigen gene sequence in Tohoku region, Japan[J]. Microbiol Immunol, 2019, 63(7): 280-284. DOI:10.1111/1348-0421.12690 |
| [16] |
Ohashi N, Koyama Y, Urakami H, et al. Demonstration of antigenic and genotypic variation in Orientia tsutsugamushi which were isolated in Japan, and their classification into type and subtype[J]. Microbiol Immunol, 1996, 40(9): 627-638. DOI:10.1111/j.1348-0421.1996.tb01120.x |
| [17] |
Seto J, Suzuki Y, Otani K, et al. Proposed vector candidate: Leptotrombidium palpale for Shimokoshi type Orientia tsutsugamushi[J]. Microbiol Immunol, 2013, 57(2): 111-117. DOI:10.1111/1348-0421.12015 |
| [18] |
Shin EH, Roh JY, Park WI, et al. Transovarial transmission of Orientia tsutsugamushi in Leptotrombidium palpale (Acari: Trombiculidae)[J]. PLoS One, 2014, 9(4): e88453. DOI:10.1371/journal.pone.0088453 |
 2021, Vol. 32
2021, Vol. 32


