扩展功能
文章信息
- 曾旭灿, 许翔, 杨锐, 魏春, 吴林波, 罗春海, 孙晓东
- ZENG Xu-can, XU Xiang, YANG Rui, WEI Chun, WU Lin-bo, LUO Chun-hai, SUN Xiao-dong
- 云南省中华按蚊种群mtDNA-COⅠ基因序列的遗传结构分析
- A genetic structure analysis of mtDNA COⅠ gene sequence of Anopheles sinensis populations in Yunnan province, China
- 中国媒介生物学及控制杂志, 2021, 32(3): 265-270
- Chin J Vector Biol & Control, 2021, 32(3): 265-270
- 10.11853/j.issn.1003.8280.2021.03.002
-
文章历史
- 收稿日期: 2020-12-30
中华按蚊(Anopheles sinensis)分布于云南省大部分地区,是水稻种植区域的重要蚊种。其种群数量较大,分布广泛,是云南省疟疾媒介之一。而云南省地处中国西南,与缅甸、老挝、越南接壤。由于地理上山水相连,没有天然屏障的阻隔,从缅甸一侧不时有疟疾病例输入云南省。在输入疟疾病例和传疟媒介同时存在的情况下,可能会出现当地病例的传播。由于目前疟疾媒介控制主要依赖杀虫剂的使用,不同的使用频率和浓度是否对中华按蚊的种群结构产生影响,有助于推断杀虫剂抗性的现状和可能扩散途径,从而对防治提供重要科学依据。研究种群遗传结构常用的分子标记为微卫星和线粒体基因,其中线粒体DNA(mtDNA)具有严格的母系遗传特点,便于进行种群分析,只需少量材料就能反映种群的遗传结构,同时分子质量较小,结构相对简单、稳定,便于进行结果分析[1]。其中细胞色素C氧化酶亚基Ⅰ(cytochrome c oxidase subunit Ⅰ,COⅠ)序列因位置比较保守,常用作昆虫进化研究的标记[2]。目前已有研究分析我国多地中华按蚊种群遗传结构的报道,但对云南省中华按蚊的研究仅限于少数地区[3-5]。本研究在云南省东、南、西、北、中各个方位选择采样点进行采样,能够充分代表云南省中华按蚊的种群结构。在对中华按蚊mtDNA-COⅠ片段进行扩增的基础上,对该种群进行基因的多态性分析,探讨云南省中华按蚊种遗传差异和种群结构特征,通过对当地中华按蚊遗传结构的了解,为疟疾媒介的控制提供参考。
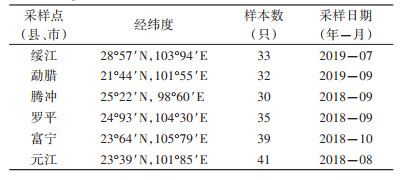
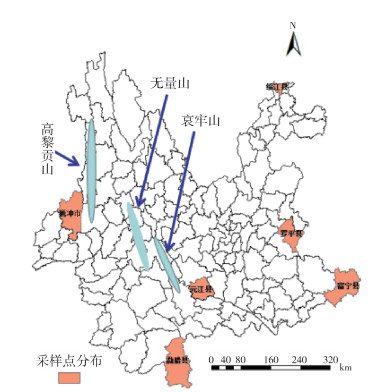
1 材料与方法 1.1 采样本研究样本采集于2018-2019年,在绥江、勐腊、腾冲、罗平、元江、富宁县(市)6个采样点(图 1、表 1)使用功夫小帅诱蚊灯(武汉吉星医疗科技有限公司,型号LTS-M02)在当地农户的牛圈采集蚊虫,次日08:00收集集蚊袋后放冰箱将蚊虫冻死。根据检索表[6],在体式显微镜下对蚊虫鉴定,检出的中华按蚊带回实验室-20 ℃保留备用。
|
| 图 1 云南省蚊虫采样点空间分布 Figure 1 Distribution map of mosquito collection sites in Yunnan province |
| |
DNA提取试剂盒(DP304)购自天根生化科技有限公司,1-14台式高速离心机购自Sigma公司,C1000-Touch梯度PCR仪购自BIO-RAD公司,DYY-6D电泳仪购自北京六一仪器厂,GoldocXR+凝胶成像分析系统购自BIO-RAD公司。
1.3 DNA制备和中华按蚊分子鉴定取中华按蚊样本,根据天根基因组DNA提取试剂盒的使用说明提取蚊基因组DNA,-20 ℃保存备用。参考Joshi等[7]建立的中华按蚊特异性引物D1和D2扩增ITS2(第2内转录间隔区)和28S rDNA区(表 1)。PCR反应体系(总体积25 μl):引物D1、D2各0.5 μl(10 μmol/L),2×Taq PCR预混液12.5 μl,DNA模板3 μl,ddH2O补齐至25 μl。反应条件:95 ℃3 min预变性;95 ℃30 s,55 ℃30 s,72 ℃1 min,35个循环;最后72 ℃6 min。1.5%琼脂糖凝胶电泳检测,样品送生工生物工程(上海)股份有限公司测序。将得到的序列在美国国立生物技术信息中心(NCBI)进行比对,确认为中华按蚊的样本用于后续研究。
1.4 中华按蚊mtDNA-COⅠ扩增和测序以中华按蚊gDNA为模板,根据文献[8]合成引物(表 2),PCR反应体系为(总体积25 μl):2×Taq PCR预混液12.5 μl,ddH2O 9.5 μl,引物(COⅠ-F和COⅠ-R)各1 μl,模板DNA 1 μl。PCR反应条件:94 ℃3 min预变性;94 ℃30 s,50 ℃30 s,72 ℃40 s,35个循环;72 ℃ 10 min,4 ℃保存。1.5%琼脂糖凝胶上样,在100V电泳仪上电泳30 min,凝胶成像系统观察跑胶情况拍照记录。样品送生工生物工程(上海)股份有限公司双向测序。

|
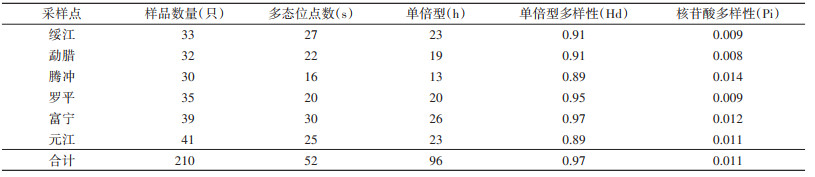
将全部COⅠ序列导入MEGA 6软件,经序列比对后,导出为DnaSP 5软件识别的Fasta格式。用DnaSP 5软件计算各地中华按蚊种群的DNA多态性相关指数,包括多态性位点个数(Polymorphic sites,s)、单倍型(Haplotypes,h)、单倍型多样性指数(Haplotype diversity,Hd)和核苷酸多样性指数(Nucleotide diversity,Pi),并进行中华按蚊COⅠ序列错配分析。Network构建单倍型网格图。将各地DNA单倍型数据的计算结果导出并修改为Arlequin软件格式后,运用该软件进行分子变异分析(AMOVA)和中性检验,以及计算遗传分化FST值和基因交流值(Nm)。Nm由公式Nm=(1-FST)/4 FST计算得出[3]。
2 结果 2.1 中华按蚊蚊种分子鉴定形态学鉴定得到中华按蚊标本217只,其中成功提取到中华按蚊基因组DNA 210只。PCR扩增后在约1 000 bp处出现特异条带,说明扩增成功,在NCBI经BLAST后,分别与GenBank公布的中华按蚊ITS2和28S rDNA区域序列(KU312199.1)100%同源。随后对中华按蚊的mtDNA-COⅠ序列扩增后电泳,在约500 bp处出现特异条带,测序结果经BLAST后,与GenBank公布的中华按蚊线粒体COⅠ基因(KX779762.1)99%以上同源。
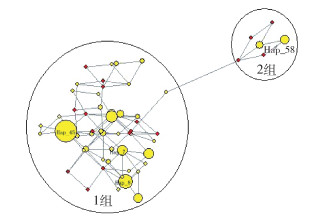
2.2 中华按蚊COⅠ基因片段碱基组成及多样性分析在mtDNA-COⅠ序列片段中A、T、G、C含量分别为30.97%、37.51%、15.04%和16.48%。符合线粒体DNA的特征[9]。210条序列中多态位点52个,有96种单倍型(表 3),种群间共享的单倍型共18个,占所有单倍型的18.75%(18/96),其中Hap_45、Hap_8和Hap_7是主要的单倍型,分别有32、13和8个个体,其中H_45单倍型共享的种群最多〔包括勐腊、腾冲、罗平、元江县(市)〕。单倍型多样性为0.97,核苷酸多样性为0.011。其中富宁县的多态位点和单倍型最多为30个和26种,同时,单倍型多样性最高的也是富宁县为0.97。核苷酸多样性最高的是腾冲县为0.014。各地单倍型多样性为富宁 > 罗平 > 绥江 > 勐腊 > 元江 > 腾冲县(市);核苷酸多样性为腾冲 > 富宁 > 元江 > 绥江 > 罗平 > 勐腊县(市)。单倍型网络图显示,单倍型可分聚成2类(图 2),聚类1中Hap_45是中心型,聚类2中Hap_58是中心型。
|
| 注:每个圆(黄色)代表 1种单倍型;圆圈的大小与单倍型的个体数量呈正比;红点是未检测到的单倍型。 图 2 中华按蚊种群mtDNA-COⅠ单倍型网络图(数字代表单倍型) Figure 2 Network map of mtDNA COⅠ haplotypes of Anopheles sinensis populations (the numbers represent haplotypes) |
| |
分子变异等级分析(表 4)结果显示,种群内变异率为90.80%,种群间变异率为9.20%,差异有统计学意义(P=0.013),种群内变异大于种群间变异。

|
各地之间FST均 < 1,Nm值除罗平和绥江县(0.96)外均 > 1,提示基因交流充分,群体间无明显分化。其中绥江和罗平县FST值为0.21,基因流为0.96,提示两地有一定程度的遗传分化。勐腊和元江县FST值最低为0.04,基因流最大,为5.70,两地基因流最丰富,群体间无遗传分化。见表 5。

|
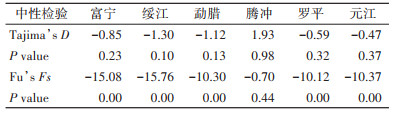
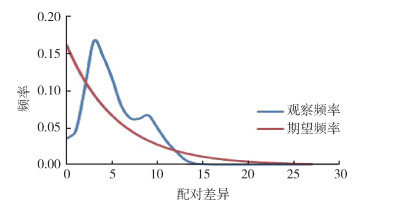
6个种群中(表 6)除了腾冲市,其余Tajima's D的值均为负值,且均P > 0.05,腾冲市的Fu's Fs(检验值也均为P > 0.05,不支持云南省中华按蚊种群近期发生过种群扩张。当种群单倍型碱基错配分析图为单峰时,群体符合扩张模型。但本研究6个中华按蚊地理种群纳入分析时,曲线呈双峰(图 3),与中性检验结果一致,即云南省中华按蚊种群近期未出现种群扩张。
|
|
| 图 3 云南省中华按蚊种群错配分析 Figure 3 Mismatch analysis of Anopheles sinensis populations in Yunnan province |
| |
本研究对中华按蚊样本的采集范围分布在云南省的东、南、西、北、中各个方位,具有一定的代表性。另外,中华按蚊在云南省广泛分布,嗜吸牛血兼吸人血,属于疟疾媒介之一。本次研究立足mtDNA-COⅠ基因,对云南省中华按蚊种群遗传结构展开调查分析,以期对疾病防控提供参考。本研究中共获得210条中华按蚊mtDNA-COⅠ基因的序列,其中碱基含量A+T68.48%,G+C31.52%;与相关报道A+T含量75.37%,G+C含量24.63%,A+T含量71.20%,G+C含量28.80%,以及雷氏按蚊(An. lesteri)COⅠ基因A+T含量68.60%,G+C含量31.40%的结果类似[2, 4, 10]。表明中华按蚊COⅠ具有明显的A/T偏倚,符合昆虫线粒体DNA的特征[9],单倍型多样性在0.89~0.97,核苷酸多样性在0.008~0.012,2种数值均较高,说明云南省内中华按蚊种群具有高度的遗传多样性,与其他相关研究结果类似[5, 10],也说明COⅠ适合用于做种群遗传结构的分子标记。高度的遗传多样性使中华按蚊在环境压力和杀虫剂压力下,可以保持一定规模的种群数量,同时使杀虫剂抗性基因更加有利于扩散,这可能是中华按蚊的适应性强且广泛分布的原因;也与云南省复杂的地理地貌,多样的气候条件,大跨度的海拔差异有关。核苷酸多样性最高的是腾冲市,最低为勐腊县,说明相对于其他种群,腾冲市的蚊虫个体间遗传差异较大。腾冲市所在的高黎贡山地区是三江并流世界自然遗产的重要组成部分,物种丰富,同时中华按蚊飞行距离有限,被天然屏障阻隔可能是造成其遗传多样性的原因。
分子变异分析中种群内变异大于种群间变异说明中华按蚊的遗传分化主要来自于种群内部,而不是种群之间,提示各地间种群遗传结构基本相同,无明显分化,与马雅军等[11]的结果一致。
FST值是衡量种群遗传差异的重要指标,值越大说明2个种群之间遗传分化程度越大,基因交流越少;反之,分化程度越小,基因交流越频繁[11]。当FST取值范围最大值为1,表明等位基因在各地方种群中固定,完全分化;最小值为0,意味着不同地方种群遗传结构完全一致,种群间没有分化。对中华按蚊种群的FST和Nm值的分析结果显示,绥江和罗平县存在一定程度遗传分化,绥江县位于金沙江南岸,是乌蒙山系向北延伸的末端,当地气候属四季分明的高原季风气候。而罗平县地处滇、桂、黔3省(自治区)结合部,地形结构复杂,除高原季风气候外,南部属南亚热带气候,两地的基因交流不充分,可能是造成遗传分化的原因。元江和勐腊县同属低海拔地区,降雨丰富,常年湿热。历史上交通往来便利,且相似的气候和自然条件使基因交流频繁,造成两地无遗传分化。
本研究中的中性检验和错配分析表明,云南省中华按蚊种群近期未出现种群扩张。与杨飞龙等[10]根据得到的单峰错配分析曲线得出云南地区中华按蚊种群近期经历种群扩张的结论不同,原因可能是云南省属高原山区,高山峡谷相间,地理环境相对内地复杂,海拔差异大,在以往的地质构造过程中形成了高黎贡山、哀牢山、金沙江等地理性的阻隔[12],不利于种群扩张。冯欣宇[13]对不同省份的中华按蚊FST值显示,云南省与其他省种群间的遗传分化程度均较大,与四川种群之间遗传分化程度更是达到0.622,但其他各省之间的遗传分化小,基因交流频繁。表明云南省作为高原地区,海拔的差异可能阻止了中华按蚊的基因交流。Jung等[14]曾分析韩国中华按蚊的种群遗传结构,发现可分为南北2个亚群体,阻碍其间基因流动的地理屏障是Taebaek和Sobaek山。常雪莲等[5]对山东、安徽、江苏、贵州和云南省以及广西壮族自治区共6个不同地理环境的中华按蚊进行同类研究,仅云南种群Tajima's D为正值,且差异无统计学意义(P > 0.05),另外云南省元阳种群与其他种群相对独立,在系统树中为孤立一支,这些都说明云南省的中华按蚊种群未出现扩张。
在本次研究中,标本采集点包括了历史上的疟疾高流行区和低流行区,通过对COⅠ基因的检测显示中华按蚊种群具有较高的遗传多态性。各地之间除罗平和绥江县外,基因交流频繁,可能使蚊体内杀虫剂抗性基因在群体间出现扩散,中华按蚊体内的抗性基因突变情况则需要做进一步的调查。
利益冲突 无
| [1] |
张亚平, 施立明. 动物线粒体DNA多态性的研究概况[J]. 动物学研究, 1992, 13(3): 289-298. Zhang YP, Shi LM. Mitochondrial DNA polymorphisms in animals: a review[J]. Zool Res, 1992, 13(3): 289-298. |
| [2] |
杨曼尼, 马雅军. 基于mtDNA-COⅠ基因序列的雷氏按蚊分子群体遗传结构研究[J]. 昆虫学报, 2009, 52(9): 1000-1007. Yang M N, Ma YJ. Molecular population genetic structure of Anopheles lesteri (Diptera: Culicidae) based on mtDNA-COⅠgene sequences[J]. Acta Entomol Sin, 2009, 52(9): 1000-1007. DOI:10.16380/j.kcxb.2009.09.004 |
| [3] |
Feng XY, Huang LB, Lin L, et al. Genetic diversity and population structure of the primary malaria vector Anopheles sinensis (Diptera: Culicidae) in China inferred by cox1 gene[J]. Parasit Vectors, 2017, 10(1): 75. DOI:10.1186/s13071-017-2013-z |
| [4] |
Ma YJ, Yang MN, Fan Y, et al. Population structure of the malaria vector Anopheles sinensis (Diptera: Culicidae) in China: two gene pools inferred by microsatellites[J]. PLoS One, 2011, 6(7): e22219. DOI:10.1371/journal.pone.0022219 |
| [5] |
常雪莲, 钟代斌, 李小聪, 等. 基于mtDNA-COⅠ基因序列分析我国中华按蚊种群的遗传结构[J]. 南方医科大学学报, 2015, 35(2): 234-238, 247. Chang X L, Zhong DB, Li XC, et al. Analysis of population genetic structure of Anopheles sinensis based on mitochondrial DNA cytochrome oxidase subunit I gene fragment[J]. J South Med Univ, 2015, 35(2): 234-238, 247. DOI:10.3969/j.issn.1673-4254.2015.02.15 |
| [6] |
董学书, 周红宁, 龚正达. 云南蚊类志[M]. 昆明: 云南科技出版社, 2010: 144-146. Dong XS, Zhou HN, Gong ZD. The mosquito fauna of Yunnan China[M]. Kunming: Yunnan Science and Technology Press, 2010: 144-146. |
| [7] |
Joshi D, Park MH, Saeung A, et al. Multiplex assay to identify Korean vectors of malaria[J]. Mol Ecol Resour, 2010, 10(4): 748-750. DOI:10.1111/j.1755-0998.2010.02835.x |
| [8] |
高博, 王宇平, 许卿, 等. 福建口岸三蚊种COⅠ基因序列分析[J]. 中国国境卫生检疫杂志, 2010, 33(6): 398-401. Gao B, Wang YP, Xu Q, et al. COI sequences analysis for three kinds of mosquitoes at Fujian port[J]. Chin J Front Health Quarant, 2010, 33(6): 398-401. DOI:10.16408/j.1004-9770.2010.06.008 |
| [9] |
Yuan Y, Li Q, Kong LF, et al. The complete mitochondrial genome of the grand jackknife clam, Solen grandis (Bivalvia: Solenidae): a novel gene order and unusual non-coding region[J]. Mol Biol Rep, 2012, 39(2): 1287-8259. DOI:10.1007/s11033-011-0861-8 |
| [10] |
杨飞龙, 李旭东, 闫振天, 等. 云南中华按蚊的遗传变异和种群结构[J]. 生态学报, 2015, 35(16): 5449-5457. Yang F L, Li XD, Yan ZT, et al. Genetic variation and population structure of Anopheles sinensis (Diptera: Culicidae) in Yunnan[J]. Acta Ecol Sin, 2015, 35(16): 5449-5457. DOI:10.5846/stxb201311172746 |
| [11] |
马雅军, 瞿逢伊, 徐建农, 等. 我国中华按蚊群体分子遗传多态研究[J]. 昆虫学报, 2001, 44(1): 33-39. Ma Y J, Qu FY, Xu JN, et al. Study on molecular genetic polymorphism of Anopheles sinensis populations in China[J]. Acta Entomol Sin, 2001, 44(1): 33-39. DOI:10.16380/j.kcxb.2001.01.006 |
| [12] |
朱世模, 黄复生. 地质变迁与云南白蚁的发生[J]. 动物学研究, 1989, 10(1): 1-8. Zhu SM, Huang FS. Effect of geological vicissitude on origination of termite from Yunnan, China[J]. Zool Res, 1989, 10(1): 1-8. |
| [13] |
冯欣宇. 中华按蚊免疫相关基因多态性研究[D]. 上海: 第二军医大学, 2012. Feng XY. Study on immune genes polymorphism in the malaria mosquito Anopheles sinensis (Diptera: Culicidae)[D]. Shanghai: The Second Military Medical University, 2012. |
| [14] |
Jung J, Jung Y, Min GS, et al. Analysis of the population genetic structure of the malaria vector Anopheles sinensis in South Korea based on mitochondrial sequences[J]. Am J Trop Med Hyg, 2007, 77(2): 310-315. DOI:10.4269/ajtmh.2007.77.310 |
 2021, Vol. 32
2021, Vol. 32