扩展功能
文章信息
- 何志伟, 董起钰, 刘锐, 李欣, 刘欣, 徐从武, 赵鑫祺, 万晴, 张忠
- HE Zhi-wei, DONG Qi-yu, LIU Rui, LI Xin, LIU Xin, XU Cong-wu, ZHAO Xin-qi, WAN Qing, ZHANG Zhong
- 白斑蛾蚋幼虫肠道可培养细菌的分离鉴定与产消化酶活性分析
- Isolation and identification of culturable intestinal bacteria from Clogmia albipunctata larvae and analysis of their digestive enzyme-producing activities
- 中国媒介生物学及控制杂志, 2021, 32(2): 224-229
- Chin J Vector Biol & Control, 2021, 32(2): 224-229
- 10.11853/j.issn.1003.8280.2021.02.021
-
文章历史
- 收稿日期: 2020-03-10
2 山东省新发传染病溯源与防控协同创新中心, 山东 泰安 271016
2 Shandong Collaborative Innovation Center for the Origin and Control of Emerging Infectious Diseases, Tai'an, Shandong 271016, China
昆虫体内存在多种细菌,能调控寄主生长发育、代谢和健康、协助寄主消化食物,影响寄主免疫功能强弱等[1-3]。一些微生物可以产生消化酶[4],促进食物的消化吸收,如家蚕体内一些细菌可以产纤维素酶、淀粉酶、蛋白酶、脂肪酶,促进家蚕对食物的消化吸收,提高对食物营养的利用[5];但同种昆虫在不同条件下生活其肠道菌群结构及功能不同[6],如取食人工饲料和不同寄主植物的小菜蛾幼虫肠道细菌多样性和群落构成存在显著差异[7]。白斑蛾蚋(Clogmia albipunctata)是蛾蠓科中最常见的种类,与人类生活密切相关,属于城市昆虫。有研究表明,白斑蛾蚋幼虫能感染人体泌尿生殖系统或消化道,引起肠道蝇蛆病[8-12]。
本实验所用的白斑蛾蚋来自室内自然孳生的成虫,且在实验室内已完成1个世代的繁衍。在封闭恶劣的环境和食物有限情况下,白斑蛾蚋依然能够完成个体发育和种群繁衍,有很强的环境适应能力和食物消化能力,可能与其肠道中的共生细菌有关。但有关白斑蛾蚋肠道细菌组成及其产消化酶活性及耐药性的研究仍未有报道。有鉴于此,本文在对白斑蛾蚋肠道细菌进行分离培养的基础上,研究其肠道细菌的产消化酶活性和耐药性,探讨白斑蛾蚋对食物的高效转化及对外部恶劣环境良好适应的微生态学机制,为后续白斑蛾蚋的饲养及生物学适应性等重要问题奠定基础。
1 材料与方法 1.1 材料与分子鉴定实验所用虫体均为本实验室培养的蛾蚋幼虫,自2019年饲养至今。本实验所用的蛾蚋来自室内自然孳生的成虫,且在实验室内已完成1个世代的繁衍,未接触过抗生素。
1.2 主要试剂及仪器牛肉浸膏(天津市英博生化试剂有限公司,批号:2016年11月29日),琼脂粉(北京索来宝科技有限公司Lot.No.923H024),可溶性淀粉(天津市凯通化学试剂有限公司,批号:2017年1月12日),SW-CJ-2D型净化工作台(苏州净化设备有限公司Lot.No.1009004),恒温水浴锅(常州智博仪器制造有限公司,产品编号:20448)、YXQ-LS-立式压力蒸汽灭菌器(上海博迅-实业有限公司医疗设备厂,产品编号:4602)等。
1.3 产消化酶细菌的筛选培养基配制肠道可培养细菌产消化酶筛选培养基的配制参照黄振东等[13]的方法,具体配制过程如下。
1.3.1 产淀粉酶细菌的筛选培养基在营养琼脂(NA)培养基的基础上加入2 g淀粉作为筛选底物,另加0.005%的台盼蓝作为指示剂,121 ℃高压灭菌20 min,均匀倒入无菌ϕ9 cm培养皿内,厚度约4 mm,冷却凝固后,存放于4 ℃冰箱,备用。
1.3.2 产蛋白酶细菌的筛选培养基称取酪蛋白20 g,琼脂18 g,加蒸馏水定容至1 000 ml,用5 mol/L NaOH调节pH值至7.0~7.5,121 ℃高压灭菌20 min,均匀倒入无菌ϕ9 cm培养皿内,厚度约4 mm,冷却凝固后,存放于4 ℃冰箱,备用。
1.3.3 产纤维素酶细菌的筛选培养基在NA培养基内加入10 g羧甲基纤维素钠作为筛选底物,0.005%刚果红作为指示剂后,121 ℃高压灭菌20 min,均匀倒入无菌ϕ9 cm培养皿内,厚度约4 mm,冷却凝固后,存放于4 ℃冰箱,备用。
1.3.4 产脂肪酶细菌的筛选培养基在NA培养基中加入12%橄榄油乳化液、0.005%溴甲酚紫,调节pH值至8.0后,121 ℃高压灭菌20 min,均匀倒入无菌ϕ9 cm培养皿内,厚度约4 mm,冷却凝固后,存放于4 ℃冰箱,备用。橄榄油乳化液的配制∶橄榄油和0.02 g/ml的聚乙烯醇(PVA)以体积比1∶3的比例混合,震荡混匀5~10 min,得乳化液。
1.4 方法 1.4.1 蛾蚋的分子鉴定取1只蛾蚋幼虫,加入1.5 ml无菌离心管中,用研磨器研磨充分,然后使用血液/组织/细胞通用基因组DNA提取试剂盒(北京康为世纪生物科技有限公司),按照说明书提取蛾蚋幼虫基因组DNA,提取到的基因组DNA置于-20 ℃冰箱保存备用。利用线粒体细胞色素C氧化酶亚基Ⅰ基因(COⅠ基因)序列进行聚合酶链式反应(PCR)扩增,PCR反应体系如下。模板DNA 3 μl,dNTP 2.4 μl,EasyTaq buffer 3 μl,HCO2198 0.8 μl,LCO1490 0.8 μl,Taq DNA聚合酶0.4 μl,ddH2O补足至30 μl。引物浓度:10 μmol/L,Taq DNA聚合酶浓度:5 U/μl,dNTP浓度:2.5 mol/L。PCR反应条件为:94 ℃预变性5 min;94 ℃变性30 s,45 ℃退火50 s,72 ℃延伸60 s,35个循环;循环结束后72 ℃延伸10 min。扩增后的PCR产物用1 %的琼脂糖凝胶电泳进行检测,目的条带约为598 bp。PCR产物送往北京睿博兴科生物技术有限公司进行测序分析。测序结果在美国国家生物信息中心(NCBI)网站上进行BLAST比对分析。
1.4.2 样品制备取饥饿处理24 h后的白斑蛾蚋幼虫,3头为1组,置于无菌离心管内,用75 %乙醇溶液浸泡1 min后,用无菌水漂洗,重复3次,去除体表细菌,然后再进行研磨取样,并设置3组重复实验。
1.4.3 白斑蛾蚋幼虫肠道细菌的培养取充分研磨的样品,加入100 μl的无菌水混匀,取50 μl混合液稀释成10-2、10-4、10-6 3个不同浓度梯度,各取50 μl均匀涂布在NA培养基上置于培养箱37 ℃培养24 h。待菌生长后,分离纯化得到单个菌株,去除重复菌株。
1.4.4 白斑蛾蚋幼虫肠道可培养细菌的鉴定将白斑蛾蚋肠道细菌已分离到的单菌落,接种到LB液体培养基后置于37 ℃,120 r/min的摇床中培养24 h。然后将菌液放入无菌离心管内送往北京睿博兴科生物技术有限公司青岛测序部进行序列测定,测序目标为昆虫线粒体COⅠ基因。测定结果在NCBI网站的GenBank上进行BLAST比对分析。一般认为比对结果相似率 > 99%视为同种,95%~99%为同属,< 95%为同科。
1.4.5 白斑蛾蚋幼虫肠道细菌产酶菌的筛选将肠道细菌接种在相应的筛选培养基上,每种细菌在不同的筛选平板上接种于3个不同位置,37 ℃培养48 h,观察培养基是否出现水解圈,测量并记录水解圈的直径(D)和菌落的直径(d),通过D/d的比值来比较各菌产酶能力的大小。蛋白酶、淀粉酶和纤维素酶阳性会出现透明水解圈,脂肪酶阳性培养基上会出现黄色水解圈。
1.5 统计学分析采用SPSS 20.0软件分别对筛选平板上D/d比值进行比较,经单因素方差分析后,当方差齐时用SNK多重比较方法,方差不齐时用Dunnett's T3进行显著性分析,P < 0.05为差异有统计学意义。
1.6 药敏试验根据美国临床和实验室标准协会(Clinical and Laboratory Standards Institute,CLSI)推荐的K-B纸片扩散法进行操作,用无菌棉棒蘸取适量菌液涂布整个NA培养基表面,每次将平板旋转60°,涂抹3次,最后沿周边绕擦2圈,以保证菌液涂抹均匀。待平板水分被琼脂完全吸收后贴含药纸片,用无菌镊子取药敏片贴于平板表面,每个平板贴5张药敏片,每种药敏片设3组重复。把平板放在37 ℃电热恒温培养箱中正置培养24 h后,测量抑菌圈直径并依据CLSI的标准判定实验结果。
2 结果 2.1 蛾蚋的分子鉴定经过对目的片段进行测序,并在NCBI网站上经BLAST同源性比对发现,蛾蚋的COⅠ基因序列M1与白斑蛾蚋的相似度为100%,覆盖度为95%,鉴定其为白斑蛾蚋。
2.2 白斑蛾蚋幼虫肠道细菌分离与鉴定在白斑蛾蚋肠道中分离到可培养细菌有5属12种(表 1)。其中芽孢杆菌属(Bacillus)7种,分别为越南芽孢杆菌(B. vietnamensis)、枯草芽孢杆菌枯草亚种(B. subtilis subsp.)、苏云金芽孢杆菌(B. thuringiensis)、阿氏芽孢杆菌(B. aryabhattai)、蜡状芽孢杆菌(B. cereus)、纺锤形赖氨酸芽孢杆菌(Lysinibacillus fusiformis)和巴基斯坦短小芽孢杆菌(L. pakistanensis);肠球菌属(Enterococcus)2种,分别为铅黄肠球菌(E. casseliflavus)、鹑鸡肠球菌(E. gallinarum);微小杆菌属(Exiguobacterium)、白色杆菌属(Leucobacter)和葡萄球菌属(Staphylococcus)各1种,分别为深海微小杆菌(E. profundum)、L. celer subsp.和松鼠葡萄球菌(S. sciuri)。
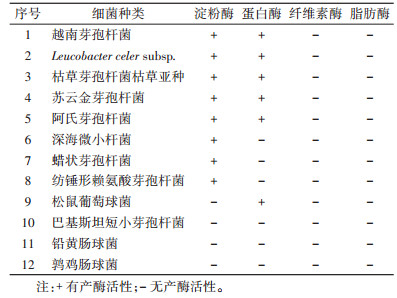
|
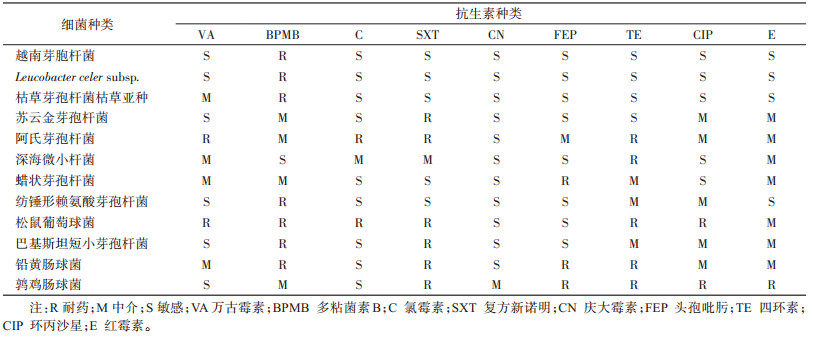
在分离到的白斑蛾蚋幼虫肠道细菌中,筛选出产淀粉酶的细菌有8种,占菌株总数的66.67%,分别为越南芽孢杆菌、L.celer subsp.、枯草芽孢杆菌枯草亚种、苏云金芽孢杆菌、阿氏芽孢杆菌、深海微小杆菌、蜡状芽孢杆菌、纺锤形赖氨酸芽孢杆菌;产蛋白酶的细菌有6种,占菌株总数的50.00%,分别为越南芽孢杆菌、L.celer subsp.、枯草芽孢杆菌枯草亚种、苏云金芽孢杆菌、阿氏芽孢杆菌、松鼠葡萄球菌;未筛选到产纤维素酶和产脂肪酶的细菌。其中,越南芽孢杆菌、L.celer subsp.、枯草芽孢杆菌枯草亚种、苏云金芽孢杆菌、阿氏芽孢杆菌可同时产蛋白酶及淀粉酶。见图 1。
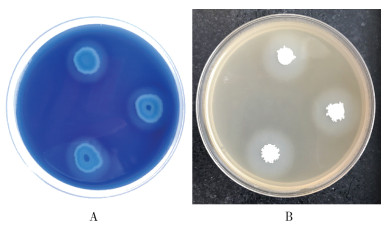
|
| 图 1 白斑蛾蚋幼虫产淀粉酶(A)和蛋白酶(B)细菌在选择培养基上的水解圈 Figure 1 Transparent circles of the bacteria from Clogmia albipunctata larvae which produced amylase (A) and protease (B) on a selective medium |
| |
8种白斑蛾蚋幼虫肠道可培养细菌的产消化酶活性差异有统计学意义(F=8.779,P < 0.001)。其中枯草芽孢杆菌枯草亚种的产淀粉酶活性最强,其在产淀粉酶选择培养基上的D和d值分别为(22.33±1.25)和(10.33±2.88)mm,D/d的值为2.30±0.53,其次为越南芽孢杆菌和深海微小杆菌。见表 2。
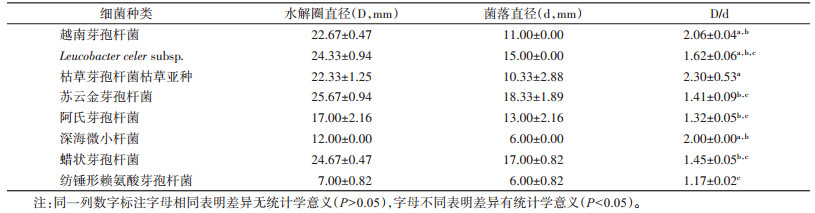
|
在分离到的白斑蛾蚋肠道可培养细菌中,6种菌产蛋白酶活性细菌的产酶活性差异有统计学意义(F=23.980,P < 0.001),其中枯草芽孢杆菌枯草亚种产蛋白酶活性最强,其在产蛋白酶选择培养基上的D和d值分别为(21.00±1.63)和(8.33±0.47)mm,D/d的值为2.52±0.11。其次为越南芽孢杆菌,松鼠葡萄球菌、阿氏芽孢杆菌和L. celer subsp.较弱,而苏云金芽孢杆菌产蛋白酶活性最弱。见表 3。
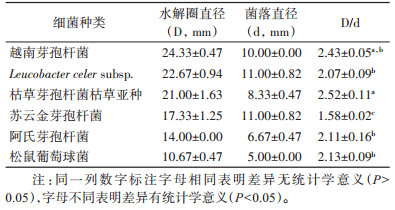
|
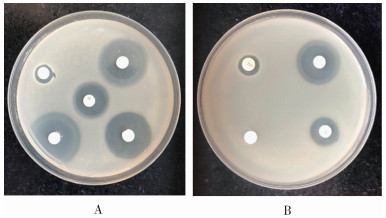
根据CLSI抗微生物药物敏感性实验的执行标准,对9种抗生素进行敏感性判定。松鼠葡萄球菌对万古霉素、多粘菌素B、氯霉素、复方新诺明、四环素、环丙沙星6种抗生素耐药;鹑鸡肠球菌对复方新诺明、头孢吡肟、四环素、环丙沙星、红霉素5种抗生素耐药;铅黄肠球菌对多粘菌素B、复方新诺明、头孢吡肟、四环素4种抗生素耐药;阿氏芽孢杆菌对万古霉素、氯霉素、复方新诺明、四环素4种抗生素耐药。就抗生素而言,对多粘菌素B、复方新诺明、四环素和头孢吡肟耐药的细菌分别有7、6、5和3种,而对庆大霉素均敏感。见表 4、图 2。
|
|
| 图 2 白斑蛾蚋幼虫肠道细菌药敏实验形成的透明圈 Figure 2 Transparent circles in drug susceptibility testing of intestinal bacteria from Clogmia albipunctata larvae |
| |
白斑蛾蚋幼虫取自生活污水或其他污水中,以污水中的腐败食物为生,对营养条件要求低,生存能力极强。白斑蛾蚋幼虫在污水中可取食含淀粉和可溶性蛋白的食物,本文在白斑蛾蚋肠道分离到的可培养细菌中,产淀粉酶活性的细菌有8种,产蛋白酶活性的细菌有6种,与白斑蛾蚋幼虫的取食习性相一致。白斑蛾蚋幼虫为刮吸式口器,不能取食纤维素,且在油脂含量高的环境中幼虫呼吸受限,因此其肠道细菌无产脂肪酶和纤维素酶活性。在长期的进化过程中,白斑蛾蚋幼虫肠道细菌产消化酶活性与其食性相一致,表明部分肠道细菌可能有协助其消化食物的功能,其肠道细菌对环境水体中的营养利用率高,可能也是白斑蛾蚋幼虫对营养需求少、分布广泛的重要原因。
本文在白斑蛾蚋肠道分离到的可培养细菌均具有多重耐药性,对多粘菌素B、复方新诺明、四环素耐药的肠道细菌种类分别有7、6和5种,推测其生长环境中可能有这3种抗生素的存在,其耐药可能来自于环境中的抗生素暴露,致使肠道细菌产生对多种抗生素的耐药。而白斑蛾蚋幼虫肠道可培养细菌产生的耐药性,有助于其抵抗环境中的抗生素胁迫,从而维持肠道细菌的稳态,有利于白斑蛾蚋幼虫的生存。肠道细菌对庆大霉素和头孢吡肟耐药性敏感,可能与2种抗生素在环境中残存的量少有关。有文献表明,白斑蛾蚋会作为医院细菌的机械携带者,并引起医院感染[14-15]。白斑蛾蚋幼虫肠道细菌产消化酶的特点,也可用于指导其人工饲料的配方,可在饲养白斑蛾蚋幼虫时适当添加蛋白、淀粉或糖类物质,可促进其生长。
本研究仅就实验室白斑蛾蚋幼虫的肠道细菌进行了研究,尚不能反映不同来源的白斑蛾蚋肠道细菌的多样性,可进一步对不同发育阶段,不同来源的虫体进行实验,以探究其肠道细菌的变化及其对生长发育和生存状况的影响。另外,白斑蛾蚋幼虫体内的厌氧细菌和不可培养细菌的研究也未开展,由于其生存环境多样,其体内细菌组成存在诸多不确定因素。因此,今后可着力利用多种技术(如宏基因组高通量测序技术、细菌厌氧培养技术等)研究不同来源白斑蛾蚋肠道细菌的多样性,更加客观全面地了解白斑蛾蚋幼虫肠道细菌的种类。
利益冲突 无
| [1] |
任世恩, 南小宁, 许淼, 等. 野生和人工饲喂条件下甘肃鼢鼠肠道细菌多样性比较[J]. 微生物学报, 2020, 60(4): 826-838. Ren SN, Nan XN, Xu M, et al. Comparison of intestinal bacterial diversity of Gansu zokor under wild and artificial feeding conditions[J]. Acta Microbiol Sin, 2020, 60(4): 826-838. DOI:10.13343/j.cnki.wsxb.20190342 |
| [2] |
张科, 苏智鹏, 许阳, 等. 蟋蟀后肠纤维素降解细菌的分离与鉴定[J]. 生物资源, 2020, 42(2): 228-233. Zhang K, Su ZP, Xu Y, et al. Isolation and identification of cellulose-degrading bacteria in the posterior intestine[J]. Biol Resour, 2020, 42(2): 228-233. DOI:10.14188/j.ajsh.2020.02.010 |
| [3] |
高欢欢, 覃冬云, 代晓彦, 等. 肠道细菌弗氏柠檬酸杆菌和产酸克雷伯氏菌对斑翅果蝇生长发育和物质代谢的影响[J]. 昆虫学报, 2020, 63(4): 462-469. Gao HH, Qin DY, Dai XY, et al. Effects of intestinal bacteria Citrobacter freundi and Klebsiella oxytoca on the development and substance metabolism of Drosophila suzukii (Diptera: Drosophilidae)[J]. Acta Entomol Sin, 2020, 63(4): 462-469. DOI:10.16380/j.kcxb.2020.04.009 |
| [4] |
丰硕, 谢晓晨, 黄振东, 等. 小菌虫肠道可培养细菌的分离鉴定及产消化酶活性分析[J]. 中国微生态学杂志, 2019, 31(11): 1255-1259. Feng S, Xie XC, Huang ZD, et al. The activities of digestive enzymes in culturable bacteria isolated from intestinal tract of Alphitobius laevigatus[J]. Chin J Microecol, 2019, 31(11): 1255-1259. DOI:10.13381/j.cnki.cjm.201911004 |
| [5] |
高绘菊, 路国兵, 查传勇, 等. 家蚕肠道产酶菌的分离与筛选[J]. 蚕业科学, 2007, 33(2): 228-233. Gao HJ, Lu GB, Cha CY, et al. Isolation and screening of the enzyme-producing bacteria in the intestine of silkworm[J]. Acta Sericol Sin, 2007, 33(2): 228-233. DOI:10.3969/j.issn.0257-4799.2007.02.011 |
| [6] |
Bing XL, Gerlach J, Loeb G, et al. Nutrient-dependent impact of microbes on Drosophila suzukii development[J]. mBio, 2018, 9(2): e02199-17. DOI:10.1128/mBio.02199-17 |
| [7] |
吴晓露, 夏晓峰, 陈俊晖, 等. 取食不同食物对小菜蛾幼虫肠道细菌多样性的影响[J]. 昆虫学报, 2019, 62(10): 1172-1185. Wu XL, Xia XF, Chen JH, et al. Effects of different diets on the diversity of larval gut bacteria of the diamondback moth, Plutella xylostella (Lepidoptera: Plutellidae)[J]. Acta Entomol Sin, 2019, 62(10): 1172-1185. DOI:10.16380/j.kcxb.2019.10.006 |
| [8] |
朱名超, 朱娅, 许正敏, 等. 泌尿生殖道发现毛蠓幼虫1例[J]. 中国热带医学, 2019, 19(2): 195-196. Zhu MC, Zhu Y, Xu ZM, et al. One case of Psychoda larvae found in the urogenital tract[J]. China Trop Med, 2019, 19(2): 195-196. DOI:10.13604/j.cnki.46-1064/r.2019.02.23 |
| [9] |
El-Dib NA, Ali MI, Hamdy DA, et al. Human intestinal myiasis caused by Clogmia albipunctata larvae (Diptera: Psychodidae): first report in Egypt[J]. J Infect Public Health, 2020, 13(4): 661-663. DOI:10.1016/j.jiph.2019.07.023 |
| [10] |
Hjaija D, Sawalha SS, Amr ZS, et al. Urinary myiasis caused by Clogmia albipunctata from the Palestinian Territories[J]. Bull Soc Pathol Exot, 2018, 111(3): 148-151. DOI:10.3166/bspe-2018-0037 |
| [11] |
El-Dib NA, El Wahab WMA, Hamdy DA, et al. Case report of human urinary myiasis caused by Clogmia albipunctata (Diptera: Psychodidae) with morphological description of larva and pupa[J]. J Arthropod Borne Dis, 2017, 11(4): 533-538. |
| [12] |
Mokhtar AS, Braima KAO, Chin HP, et al. Intestinal myiasis in a malaysian patient caused by larvae of Clogmia albipunctatus (Diptera: Psychodidae)[J]. J Med Entomol, 2016, 53(4): 957-960. DOI:10.1093/jme/tjw014 |
| [13] |
黄振东, 万晴, 薛志静, 等. 德国小蠊肠道可培养非厌氧细菌的分离、鉴定与产消化酶活性分析[J]. 中国媒介生物学及控制杂志, 2019, 30(4): 409-413. Huang ZD, Wan Q, Xue ZJ, et al. Isolation and identification of culturable aerobic bacteria from the intestines of Blattella germanica and the activity of digestive enzymes produced by these bacteria[J]. Chin J Vector Biol Control, 2019, 30(4): 409-413. DOI:10.11853/j.issn.1003.8280.2019.04.012 |
| [14] |
Faulde M, Spiesberger M. Role of the moth fly Clogmia albipunctata (Diptera: Psychodinae) as a mechanical vector of bacterial pathogens in German hospitals[J]. J Hosp Infect, 2013, 83(1): 51-60. DOI:10.1016/j.jhin.2012.09.019 |
| [15] |
Faulde M, Spiesberger M. Hospital infestations by the moth fly, Clogmia albipunctata (Diptera: Psychodinae), in Germany[J]. J Hosp Infect, 2012, 81(2): 134-136. DOI:10.1016/j.jhin.2012.04.006 |
 2021, Vol. 32
2021, Vol. 32


