扩展功能
文章信息
- 张爱萍, 徐立青, 马丽, 李积权, 薛红梅, 王建玲, 杨旭欣, 谢辉, 赵元博, 于守鸿
- ZHANG Ai-ping, XU Li-qing, MA Li, LI Ji-quan, XUE Hong-mei, WANG Jian-ling, YANG Xu-xin, XIE Hui, ZHAO Yuan-bo, YU Shou-hong
- 青海省1株分离自青藏高原喜马拉雅旱獭的布鲁氏菌株的种属鉴定
- Identification of a Brucella strain isolated from Marmota himalayana in Qinghai province, China
- 中国媒介生物学及控制杂志, 2021, 32(2): 217-220
- Chin J Vector Biol & Control, 2021, 32(2): 217-220
- 10.11853/j.issn.1003.8280.2021.02.019
-
文章历史
- 收稿日期: 2020-04-14
布鲁氏菌病(布病)是由布鲁氏菌侵犯机体后引发的传染-变态反应性的人畜共患传染病,也是自然疫源性疾病。我国将其列为二类动物疫病,主要通过消化道、呼吸道、生殖道等传播,布病已经严重危害人类及家畜的健康[1-3]。很多野生动物都能感染布鲁氏菌,包括喜马拉雅旱獭(Marmota himalayana)[4]。青海省自20世纪80年代就调查过喜马拉雅旱獭感染布病的情况,调查结果表明针对布病抗体的血清学检查结果阳性,阳性率达到2.50%,但未分离到布鲁氏菌。本试验将2016年在青海省全省范围内收集的245份喜马拉雅旱獭全血,分离血清进行布病虎红平板凝集试验和试管凝集试验,把试验结果均阳性的7份全血利用血培养法进行细菌培养,分离纯化出1株疑似布鲁氏菌,提取DNA,制备模板后利用BCSP31-PCR和AMOS-PCR 2种方法进行属种鉴定。
1 材料与方法 1.1 材料 1.1.1 仪器恒温金属浴购自艾卡(广州)仪器设备有限公司,水平电泳仪DYCP-32C购自中国六一生物科技有限公司,超纯水仪SMART-N购自力新仪器(上海)有限公司,凝胶成像分析系统GeIDCCXR+IR+lmager购自美国伯乐公司,恒温混匀仪ThermoMixer C、生物安全高速离心机、各量程移液器均购自德国艾本德股份公司。
1.1.2 试剂2×Taq PCR Master Mix、5×TBE、Ezup柱式细菌基因组DNA抽提试剂盒、灭菌去离子水、纯水、琼脂糖均由生工生物工程(上海)股份有限公司提供。
1.1.3 耗材2 ml离心管、各量程枪头、封口膜。
1.2 方法 1.2.1 样本来源2016年收集的245份青海省喜马拉雅旱獭全血作为检测样本。
1.2.2 细菌分离培养经虎红平板凝集试验和试管凝集试验检测均为阳性的血清所对应的全血注入双向培养瓶中,置于37 ℃培养箱中培养。选取单个疑似布鲁氏菌菌落接种于布氏琼脂平板上,37 ℃培养18~24 h,取培养物制备模板,同时进行涂片镜检、噬菌体裂解试验。
1.2.3 非布鲁氏菌对照菌株的选择布鲁氏菌疫苗株S2、M5作为阳性对照菌株,大肠埃希菌、鼠疫耶尔森菌(鼠疫菌)弱毒株EV76作为阴性对照菌株。
1.2.4 模板的制备将分离自喜马拉雅旱獭全血的疑似布鲁氏菌培养18~24 h后,勾取适量菌放入加有灭菌去离子水的2 ml离心管,研磨制成菌悬液,8 000×g离心5 min,弃去上清液,利用Ezup柱式细菌基因组DNA抽提试剂盒按操作流程提取核酸。取模板总量的1/10做无菌实验,无菌实验结果阴性后方可拿出实验室用于其他实验。同时制备对照菌株的模板并做无菌实验,方法同上。
1.2.5 引物 1.2.5.1 BCSP31-PCR试验鉴定布鲁氏菌属采用布鲁氏菌属特异性基因BCSP31作为种属基因,按照参考文献[5]提供的B4和B5引物序列合成引物,B4和B5引物序列及产物大小见表 1。
采用参考文献[6]提供的布鲁氏菌属IS711插入序列为基础建立的AMOS-PCR法鉴别布鲁氏菌种/型,引物序列见表 2。
采用25 μl反应体系:2×Taq PCR Master Mix 12.5 μl,primer B4/B5各1 μl,模板1 μl,ddH2O 9.5 μl。反应条件:94 ℃预变性4 min;94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸1 min,扩增30个循环;最后72 ℃延伸10 min。PCR产物在4 ℃保存。
1.2.6.2 AMOS-PCR反应体系及反应条件采用25 μl反应体系:2×Taq PCR Master Mix 12.5 μl,primer A、M、O、S各0.4 μl,primer IS711 1 μl,模板1 μl,ddH2O 8.9 μl。反应条件:95 ℃预变性5 min;95 ℃变性30 s,63 ℃退火30 s,72 ℃延伸30 s,扩增35个循环;最后72 ℃延伸5 min。PCR产物在4 ℃保存。
1.2.7 结果判定噬菌体裂解试验、BCSP31-PCR、AMOS-PCR的结果判定按照布鲁氏菌病诊断标准(WS 269-2019)[7]进行判断。
2 结果 2.1 血清学检验结果经虎红平板凝集试验、试管凝集试验检测均阳性的全血共7份,其中试管凝集试验布病抗体阳性滴度在1∶50~1∶1 600。
2.2 细菌分离结果分离出1株疑似布鲁氏菌(待测菌株),镜下观察,待测菌株的形态及染色特征为革兰阴性小杆菌,培养特性与布鲁氏菌相同[7]。
2.3 噬菌体裂解试验结果待测菌株噬菌体裂解试验BK2裂解,Tb不裂解,可与单相特异性血清A、M凝集,确定为羊种生物Ⅲ型布鲁氏菌[7]。
2.4 PCR结果 2.4.1 BCSP31-PCR试验结果将提取的大肠埃希菌、EV76、S2、M5和待测菌株的核酸作为模板进行BCSP31-PCR扩增,扩增产物进行琼脂糖凝胶电泳,待测菌株、阳性对照菌株S2、M5均在223 bp处出现特异条带,空白对照、阴性对照菌株大肠埃希菌、EV76未出现条带,待测菌株属于布鲁氏菌属。见图 1。
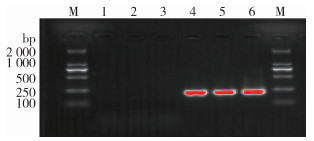
|
| 注:M表示DNA分子质量标准;1空白对照;2大肠埃希菌;3鼠疫菌弱毒株EV76;4布鲁氏菌疫苗株S2;5布鲁氏菌疫苗株M5;6待测菌株。 图 1 不同菌株BCSP31-PCR扩增结果 Figure 1 BCSP3l-PCR amplification results of different strains |
| |
将提取的大肠埃希菌、EV76、S2、M5、待测菌株的核酸作为模板进行AMOS-PCR扩增,将扩增产物进行琼脂糖凝胶电泳,待测菌株在731 bp处出现特异条带,待测菌株为羊种布鲁氏菌。见图 2。
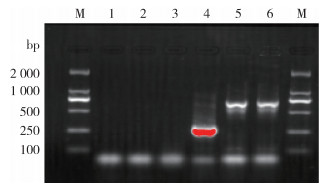
|
| 注:M表示DNA分子质量标准;1空白对照;2大肠埃希菌;3鼠疫菌弱毒株EV76;4布鲁氏菌疫苗株S2;5布鲁氏菌疫苗株M5;6待测菌株。 图 2 不同菌株AMOS-PCR扩增结果 Figure 2 AMOS-PCR amplification results of different strains |
| |
布鲁氏菌是布病的病原体,属革兰阴性小杆菌,可以感染多种家养和野生的动物。受布病影响较大的有牛、羊、鹿等,它们与我国畜牧业的发展戚戚相关,此外还包括马鹿、狐狸、野兔、黄鼠、旱獭等野生动物[4],甚至是海洋哺乳动物环斑海豹和海象等[8]。随着研究的深入,越来越多的野生动物体内分离出了布鲁氏菌。青海省自1983首次从野生岩羊中分离到3株布鲁氏菌后,又陆续从野生岩羊中分离出5株布鲁氏菌[9],从藏绵羊中分出1株布鲁氏菌[10]。贵州省也从山羊中分离到布鲁氏菌[11]。青海省全境属于青藏高原喜马拉雅旱獭鼠疫疫源地,对于喜马拉雅旱獭的研究自20世纪50代至今从未停止过,但仅从喜马拉雅旱獭血清中检测到布病抗体阳性,未分离到布鲁氏菌。
本实验利用2016年随机抽取的245份喜马拉雅旱獭全血,经虎红平板凝集试验和试管凝集试验筛查出7份布病抗体阳性全血,利用血培养的方法从这7份血液中分离出1株布鲁氏菌,并通过PCR技术鉴定出该株菌是羊种布鲁氏菌,与噬菌体裂解试验结果一致。PCR技术较之传统布病检测技术,特异性强、耗时短、操作简单[12-13],可用于布鲁氏菌的快速鉴定,而且与噬菌体裂解试验等传统布鲁氏菌鉴定方法的符合率非常高[6],在国内外的应用很广泛[13-16]。BCSP31-PCR的引物是针对布鲁氏菌特异性的外膜蛋白BCSP31设计的引物序列,可在属的水平上鉴定布鲁氏菌属。AMOS-PCR则是根据布鲁氏菌插入序列IS711在不同种布鲁氏菌上位置的不同设计的引物,根据IS711基因在每一种布鲁氏菌拷贝数的不同,在不同的布鲁氏菌中能够得到不同的扩增片段,可以鉴定出牛种生物Ⅰ、Ⅱ、Ⅳ型布鲁氏菌,羊种、猪Ⅰ型、绵羊附睾种。这2种PCR方法都是鉴别布鲁氏菌最常用的方法,操作简单,结果可靠。
研究表明,海洋哺乳动物海象布病的感染率为8.47%[8]。1991年新疆野生动物布病感染情况调查结果旱獭感染率为0.92%[4],而青海省2016年随机抽取的245份喜马拉雅旱獭全血,经检测布病感染率为2.86%(7/245)。虽然很多动物都能感染布病,但布病在不同物种之间的传播机制还有待研究。Nielsen等[8]认为环斑海豹感染布病的机制可能是随机发生的散发性感染,可能在发现布病抗体阳性地区发生了有限的动物流行病,而海象可能和环斑海豹是同一途径感染的布病。喜马拉雅旱獭感染布病机制,是否和海象一样是偶然感染,即一种动物流行病在另一种物种中散发性感染,这还需要我们进一步的研究。值得注意的是喜马拉雅旱獭作为鼠疫菌的保菌宿主,如果其既带有鼠疫菌又带有布鲁氏菌,在传播鼠疫的同时也会传播布病,那么专业技术人员在检测鼠疫样本的同时还要做好预防布病的准备,否则有感染布病和鼠疫的双重风险。
利益冲突 无
| [1] |
刘志国, 王妙, 崔步云, 等. 布鲁氏菌病并发症及治疗研究进展[J]. 中国人兽共患病学报, 2019, 35(5): 447-454. Liu ZG, Wang M, Cui BY, et al. Research progress on the complications of brucellosis and treatment[J]. Chin J Zoonoses, 2019, 35(5): 447-454. DOI:10.3969/j.issn.1002-2694.2019.00.045 |
| [2] |
林元清. 青海省牛羊布鲁氏菌病流行病学调查分析[J]. 山东畜牧兽医, 2017, 38(5): 45-46. Lin YQ. Epidemiological investigation and analysis of brucellosis in cattle and sheep in Qinghai province[J]. Shandong J Anim Sci Vet Med, 2017, 38(5): 45-46. DOI:10.3969/j.issn.1007-1733.2017.05.035 |
| [3] |
葛丽萍, 张崇志. 布病的流行现状及防治进展[J]. 当代畜禽养殖业, 2019(5): 3-6. Ge LP, Zhang CZ. Epidemic situation and control progress of brucellosis[J]. Mod Livest Poult Breed Ind, 2019(5): 3-6. DOI:10.3969/j.issn.1005-5959.2019.06.002 |
| [4] |
金根源, 李全, 热合曼, 等. 新疆野生动物布鲁氏菌感染情况调查[J]. 地方病通报, 1993(4): 72. Jin GY, Li Q, Re HM, et al. Investigation on Brucella infection of wild animals in Xinjiang[J]. Bull Dis Control Prev, 1993(4): 72. DOI:10.13215/j.cnki.jbyfkztb.1993.04.023 |
| [5] |
李兰玉, 邱海燕, 尚德秋. 牛种布鲁氏菌31KDa蛋白基因引物的PCR试验(Ⅰ)[J]. 中国地方病防治杂志, 2000, 15(4): 196-198. Li LY, Qiu HY, Shang DQ. PCR test of 31KDa protein gene primer of Brucella bovis[J]. Chin J Control Endem Dis, 2000, 15(4): 196-198. DOI:10.3969/j.issn.1001-1889.2000.04.002 |
| [6] |
姜海, 崔步云, 赵鸿雁, 等. AMOS-PCR对布鲁氏菌种型鉴定的应用[J]. 中国人兽共患病学报, 2009, 25(2): 107-109. Jiang H, Cui BY, Zhao HY, et al. Use of AMOS-PCR assay for the species identification of Brucella[J]. Chin J Zoonoses, 2009, 25(2): 107-109. DOI:10.3969/j.issn.1002-2694.2009.02.004 |
| [7] |
中华人民共和国国家卫生健康委员会. 布鲁氏菌病诊断标准: WS 269-2019[Z]. 北京: 中华人民共和国国家卫生健康委员会, 2019: 18-22. National Health Commission, People's Republic of China. Diagnostic criteria of brucellosis: WS 269-2019[Z]. Beijing: National Health Commission, People's Republic of China, 2019: 18-22. |
| [8] |
Nielsen O, Nielsen K, Stewart REA. Serologic evidence of Brucella spp. exposure in Atlantic walruses (Odobenus rosmarusrosmarus) and ringed seals (Phoca hispida) of Arctic Canada[J]. Arctic, 1996, 49(4): 383-386. DOI:10.14430/arctic1214 |
| [9] |
李元凯, 陈尧章, 鲁齐发, 等. 从野生动物岩羊体中分离到的布鲁氏菌的鉴定报告[J]. 中国人兽共患病杂志, 1990, 6(3): 13-15. Li YK, Chen YZ, Lu QF, et al. A study of identification of Brucella strains isolated from wild animals (Pseudois nayaur)[J]. Chin J Zoonoses, 1990, 6(3): 13-15. |
| [10] |
陈玶. 在青海藏绵羊体内分离出一株牛3型布鲁氏菌[J]. 中国人兽共患病杂志, 1998, 14(4): 89, 86. Chen P. A strain of Brucella bovis type 3 was isolated from Qinghai Tibetan sheep[J]. Chin J Zoonoses, 1998, 14(4): 89, 86. |
| [11] |
李世军, 王月, 陈红, 等. 贵州省首次从山羊分离到布鲁氏菌及其种型鉴定[J]. 中国人兽共患病学报, 2011, 27(6): 515-518. Li SJ, Wang Y, Chen H, et al. Isolation and identification of Brucella melitensis firstly isolated from goat in Guizhou province[J]. Chin J Zoonoses, 2011, 27(6): 515-518. DOI:10.3969/j.issn.1002-2694.2011.06.013 |
| [12] |
姚馨月, 郑文艳. 布鲁氏菌病PCR检测的临床意义[J]. 内蒙古医学杂志, 2016, 48(2): 189-192. Yao XY, Zheng WY. Clinical significance of PCR detection of brucellosis[J]. Inner Mongolia Med J, 2016, 48(2): 189-192. DOI:10.16096/J.cnki.nmgyxzz.2016.48.02.021 |
| [13] |
陈宝宝, 吕文, 安翠红, 等. PCR检测方法在陕西省布鲁氏菌种型鉴定中的应用[J]. 现代预防医学, 2018, 45(12): 2249-2253. Chen BB, Lyu W, An CH, et al. Application of PCR detection method in identification of Brucella strains in Shaanxi province[J]. Mod Prev Med, 2018, 45(12): 2249-2253. |
| [14] |
秦立得, 南文龙, 陈义平. PCR技术在布鲁氏菌检测与鉴别中的应用[J]. 中国动物检疫, 2018, 35(10): 63-67. Qin LD, Nan WL, Chen YP. Application of PCR method in detection and identification of Brucella[J]. China Anim Health Inspect, 2018, 35(10): 63-67. DOI:10.3969/j.issn.1005-944X.2018.10.018 |
| [15] |
王季秋, 张少先, 孙宁. PCR检测技术诊断布鲁杆菌病的研究进展[J]. 中国地方病防治杂志, 2018, 33(5): 489, 512. Wang JQ, Zhang SX, Sun N. Research progress in diagnosis of brucellosis by PCR detection technology[J]. Chin J Control Endem Dis, 2018, 33(5): 489, 512. |
| [16] |
Ren H, Yang MJ, Zhang GX, et al. Development of a rapid recombinase polymerase amplification assay for detection of Brucella in blood samples[J]. Mol Cell Probes, 2016, 30(2): 122-124. DOI:10.1016/j.mcp.2016.02.007 |
 2021, Vol. 32
2021, Vol. 32