扩展功能
文章信息
- 栗冬梅, 徐爱玲, 宋秀平, 李庆多, 康央, 刘起勇
- LI Dong-mei, XU Ai-ling, SONG Xiu-ping, LI Qing-duo, KANG Yang, LIU Qi-yong
- 巴尔通体在自然感染的啮齿动物组织中的分布
- Bartonella distribution in naturally infected rodent tissues
- 中国媒介生物学及控制杂志, 2021, 32(2): 181-187
- Chin J Vector Biol & Control, 2021, 32(2): 181-187
- 10.11853/j.issn.1003.8280.2021.02.012
-
文章历史
- 收稿日期: 2020-10-28
巴尔通体(Bartonella spp.)是一群由吸血节肢动物传播的细菌,在原核生物标准命名列表(List of prokaryotic names with standing in nomenclature,https://lpsn.dsmz.de)中公布的有效巴尔通体命名种类有37种,其中60%以上宿主来源于啮齿动物,其他宿主来源还有猫科、犬科、反刍动物和人类等。引发人类疾病的巴尔通体病原体常来源于与人类接触密切的动物,如猫、犬、鼠类等[1-3]。巴尔通体可以引起全身多系统急慢性疾病,较为常见的是猫抓病(cat-scratch disease,CSD),其他还有卡瑞恩病(Carrion disease)、战壕热(trench fever)、心内膜炎、神经根炎、脑膜炎和淋巴结炎等[4]。由于复杂的临床表现和该病原体自身的特性使得目前对此病原体引发的感染诊断较为困难[5]。
巴尔通体增殖于宿主的红细胞和血管内皮细胞中,触发血管内皮细胞增生形成血管瘤,属于兼性胞内寄生、革兰阴性需氧杆菌[6-7]。巴尔通体生长缓慢,体外原代培养通常需要数周时间,分类鉴定方法只能用核酸扩增测序分析,操作较为复杂[8-9]。巴尔通体可引起全身性疾病的表现与其在宿主体内的寄殖机制密切相关,有些动物实验,如鼠类、猫和灵长类动物的人工感染可建立持续性的菌血症模型,揭示菌血症可能是该菌体内播散的机制之一[8]。在对各种动物感染率的调查研究中,通常采用抗凝血和肝脾组织进行体外培养,阳性率较高。Deng等[10]的实验研究显示巴尔通体在人工感染的小鼠血液和肝脾组织中持续存在,淋巴结、骨髓和脑组织中未分离到巴尔通体。有人在蝙蝠的心脏中检测到巴尔通体的基因(6/435)[11],有些研究在患者、病犬的心瓣膜和淋巴结组织中也可以观察和检测出巴尔通体[12-15]。Kordick等[16]通过人工接种巴尔通体建立猫(SPF级)的感染模型,在其血液、脑、淋巴结、心肌、肝和肾组织中均检测出巴尔通体的DNA。通过这些研究推断巴尔通体可以侵袭宿主的多种组织,甚至突破血脑屏障,这与巴尔通体引起多种组织病变的临床表现相一致。研究自然感染状态下巴尔通体对各种组织的亲嗜性,有利于理解巴尔通体致病机制、指导诊断与治疗以及相关调查研究、病原体检测时的组织样品取材。为调查自然感染状态下巴尔通体在啮齿动物体内不同组织中的分布情况,本研究对捕获自黑龙江密山口岸周边的啮齿动物,对其心、肝和脾等5种主要组织进行巴尔通体体外分离培养,检测组织带菌状态和感染率差异。
1 材料与方法 1.1 主要仪器和试剂G100高通量组织研磨仪(北京卡尤迪生物科技有限公司),371型CO2培养箱(美国Thermo公司),NU-425-600E生物安全柜(美国NUAIRE公司),LabCycler PCR仪(德国SensoQuest公司);胰酶大豆肉汤(TSB)、胰酶大豆琼脂(TSA)和脑心浸液(BHI)培养基(美国BD公司),无菌脱纤维羊血(北京三牧畜牧养殖场),Wizard Genomic DNA puritication Kit(美国promega公司),2×Trans Taq-T PCR Easy Mix(北京全式金生物技术有限公司),Y-G0126研磨珠(上海净信公司)。
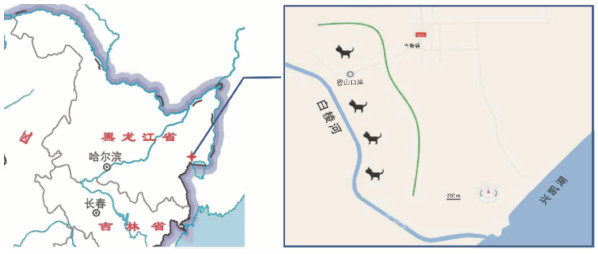
1.2 样品来源在黑龙江密山口岸(131°59'24' E,45°16'12' N)周边沿白棱河放置鼠夹捕获啮齿动物(图 1)。根据啮齿动物的生活习性,采用中号捕鼠夹,以花生米为诱饵在不同生境放置鼠夹,晚放晨取。将捕获动物“一兽一袋”放入白色布袋,扎紧袋口,带回实验室鉴定种类后进行无菌解剖。将采集的心、肝、脾、肺和肾编号分装于2 ml的灭菌冻存管中,-80 ℃保存待检。
|
注:左侧黑龙江省地图中 标识为密山口岸采样区域;右侧白棱河沿岸 标识为密山口岸采样区域;右侧白棱河沿岸 标识为采样点。
图 1 黑龙江密山口岸采样地点
Figure 1 Sampling sites at Mishan port in Heilongjiang province 标识为采样点。
图 1 黑龙江密山口岸采样地点
Figure 1 Sampling sites at Mishan port in Heilongjiang province
|
| |
在无菌条件下,分别剪取心、肝、脾、肺和肾20~25 mg放于灭菌2 ml离心管中,含100 μl TSB和适量研磨珠,用组织研磨仪匀浆后接种在含有5%脱纤维羊血的TSA上,置于含5% CO2培养箱中,潮湿环境中37 ℃培养20 d。挑取单个疑似巴尔通体菌落进行纯化分离传代2~4次,将纯菌培养物收集于含30%甘油-脑心浸液中,-80 ℃保存。
1.3.2 核酸提取及扩增挑取单个巴尔通体疑似菌落,放置于100 μl ddH2O中,100℃加热30 min,6 000×g离心5 min,取上清液作为DNA模板。应用引物BhCS.781p-BhCS.1137n扩增巴尔通体属的特异性基因枸橼酸合成酶基因(Citrate synthase gene,gltA)[17]。PCR的反应体系为25 μl,模板DNA加3 μl,10 μmol/L引物各1 μl,2×TransTaq-T PCR Easy Mix 12.5 μl,加ddH2O 7.5 μl补足。扩增参数:94 ℃预变性2 min;94 ℃变性30 s,50 ℃退火30 s,72 ℃延伸2 min,共30个循环。72 ℃延伸5 min。扩增仪为LabCycler Standard P PCR仪。1%琼脂糖凝胶电泳观察扩增产物,长度为379 bp。将阳性PCR产物送至北京擎科新业生物技术有限公司双向测序。
1.3.3 序列分析及系统发育树构建应用DNAStar Lasergene软件包中SeqMan程序进行序列拼接,将手工校对后的序列进行BLAST搜索(https://blast.ncbi.nlm.nih.gov/Blast.cgi),获取序列相似性值。应用Mega_X_10.1.8软件中MUSLE程序对基因序列进行比对。应用TOPALi 2.5软件中Model selection程序选择最适核苷酸替代模型,应用贝叶斯(MrBayes)分析法(GTR+G+I模型,2 Runs,8 000 000 generations,10 Sample Freq,25% Burnin)构建系统发育树。选择与巴尔通体近缘的布鲁氏菌(Brucella)作为外群。应用iTOL 5.6.3(https://itol.embl.de/)修饰系统发育树,添加宿主和组织菌株分离结果的注释。
1.3.4 提交序列本研究的序列已提交至GenBank,各菌株的序列号为MW161085~MW161129。
1.4 统计学分析应用SPSS 24.0软件进行统计学分析,率的比较采用χ2检验和Fisher's确切概率法,非参数检验采用Friedman M检验,检验水准为α=0.05。
2 结果 2.1 啮齿动物捕获情况共计捕获啮齿动物81只。其中,黑线姬鼠(Apodemus agrarius)68只、棕背䶄(Myodes rufocanus)4只、大仓鼠(Tscherskia triton)1只、东方田鼠(Microtus fortis)3只、莫氏田鼠(Microtus maximowiczii)2只、北花松鼠(Tamias sibiricus)2只和小家鼠(Mus musculus)1只,分别占84.0%、4.9%、1.2%、3.7%、2.5%、2.5%和1.2%。
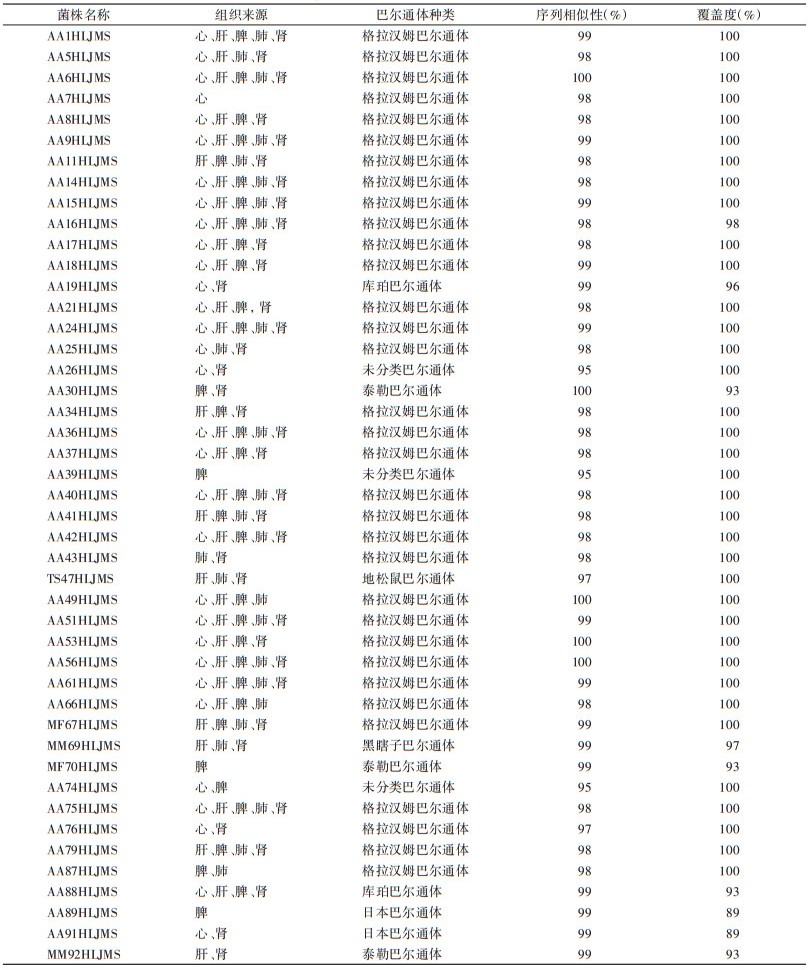
2.2 巴尔通体菌株鉴定和宿主构成分析 2.2.1 菌株分离与鉴定81只动物中45只分离出巴尔通体,总阳性率为55.6%。共计分离菌株160株,其中32只(71.1%)动物有3种以上组织分离到菌株(表 1、图 2)。经鉴定从每只阳性动物不同组织中分离的巴尔通体菌株种类一致,取脾组织分离的菌株用于序列分析和菌种保存。
|
|
| 注:1~45 代表 45株菌株。 图 2 巴尔通体菌株在啮齿动物不同组织中的分布情况 Figure 2 Distribution of Bartonella strains in various tissues of naturally infected rodents |
| |
将测序结果与GenBank序列进行比对,gltA基因初步鉴定种类有格拉汉姆巴尔通体(B. grahamii)33株、日本巴尔通体(B. japonica)2株、库珀巴尔通体(B. coopersplainsensis)2株、泰勒巴尔通体(B. taylorii)3株、黑瞎子巴尔通体(B. heixiaziensis)1株、地松鼠巴尔通体(B. washoensis)1株、类伊丽莎白巴尔通体(B. elizabethae)3株(表 1、2)。
|
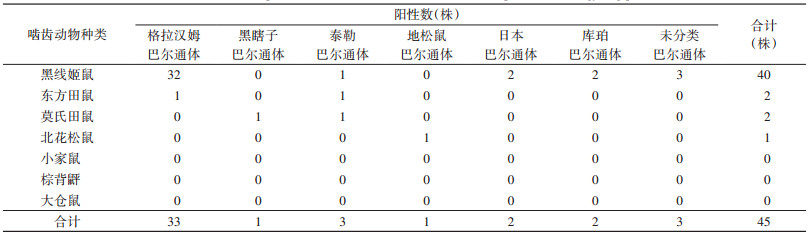
gltA基因的系统发育树显示(图 3),42株分离菌株被分布到6个明确的分支中,包括格拉汉姆巴尔通体分支33株、黑瞎子巴尔通体分支1株、泰勒巴尔通体3株、地松鼠巴尔通体1株、库珀巴尔通体2株、日本巴尔通体分支2株,3株与伊丽莎白巴尔通体相似值为95%的分离菌株单独聚集为一个分支,与已知巴尔通体无明确近缘关系,在整个系统发育树中拓扑结构不稳定,属于分类地位不清的新种。
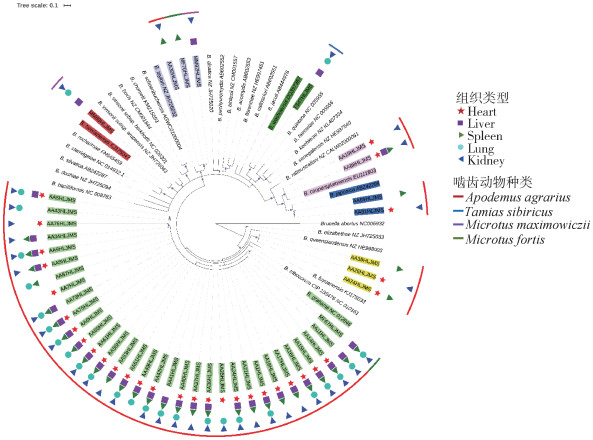
|
注:组织类型 表示各菌株在不同组织中的分离情况;系统树中的 、 、 、 、 、 、 和 和 符号表示在对应的组织中分离到此菌株;啮齿动物种类表示菌株来源的啮齿动物种类,在系统树中最外圈以红、蓝、紫和绿不同颜色的线段表示。
图 3 应用贝叶斯法基于巴尔通体分离菌株及参考菌株的gltA(335 bp)序列构建的系统发育树
Figure 3 Phylogenetic tree based on Bayesian inference of 335 bp gltA gene sequences of Bartonella isolates and reference species 符号表示在对应的组织中分离到此菌株;啮齿动物种类表示菌株来源的啮齿动物种类,在系统树中最外圈以红、蓝、紫和绿不同颜色的线段表示。
图 3 应用贝叶斯法基于巴尔通体分离菌株及参考菌株的gltA(335 bp)序列构建的系统发育树
Figure 3 Phylogenetic tree based on Bayesian inference of 335 bp gltA gene sequences of Bartonella isolates and reference species
|
| |
在带菌阳性啮齿动物中,以黑线姬鼠为主要宿主,共计40只,携带5种巴尔通体,最多为格拉汉姆巴尔通体32株,占全部菌株的80.0%,具有绝对优势,其他还有日本巴尔通体2株、泰勒巴尔通体1株、库珀巴尔通体2株和未分类巴尔通体3株(表 2、图 4)。除此,东方田鼠、莫氏田鼠和北花松鼠中还分离到格拉汉姆巴尔通体、泰勒巴尔通体、黑瞎子巴尔通体、地松鼠巴尔通体。经Fisher's确切概率法检验,不同鼠种的巴尔通体感染率差异无统计学意义(χ2=9.041,P=0.062)。
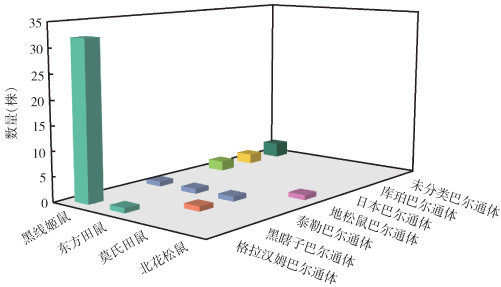
|
| 图 4 黑龙江密山口岸啮齿动物携带的巴尔通体种类分布 Figure 4 Diversity of Bartonella species in rodents at Mishan port in Heilongjiang province |
| |
黑线姬鼠、东方田鼠、莫氏田鼠、北花松鼠均分别从心、肝、脾、肺和肾组织中分离到数量不等的巴尔通体菌株,以黑线姬鼠为主(表 3)。在全部分离菌株中,心、肝、脾、肺和肾组织分离培养出的菌株数量分别为31、32、34、26和37株,阳性率依次为38.3%、39.5%、42.0%、32.1%和45.7%(表 3)。经Friedman M检验,不同组织巴尔通体培养阳性率的差异无统计学意义(χ2=5.623,P=0.229)。
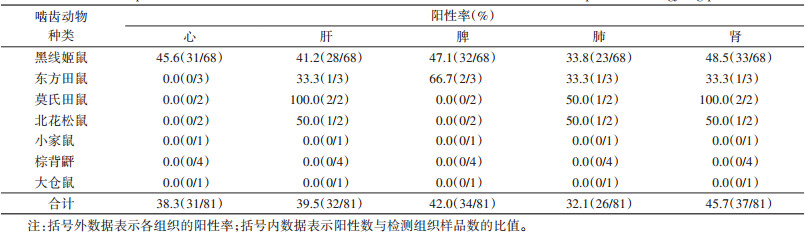
|
7种巴尔通体均不同程度的出现在心、肝、脾、肺和肾组织中,比例是1.2∶1.2∶1.3∶1.0∶1.4。根据表 4应用Friedman M检验,每种巴尔通体在不同组织中的数量分布差异无统计学意义(χ2=7.492,P=0.112)。其中,格拉汉姆巴尔通体的菌株数量最多,均匀分布在各种组织中,比例是1.1∶1.2∶1.2∶1.0∶1.2。
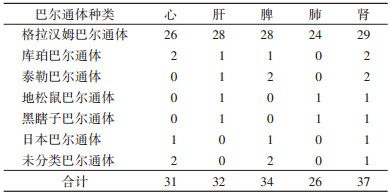
|
巴尔通体引起的猫抓病典型临床表现是皮肤脓肿和淋巴腺炎,有些病例可发展为脑膜炎、骨髓炎、脑炎和心内膜炎等[18-19]。此外,有些巴尔通体还可以引发严重的溶血性贫血、肝脾紫癜、杆菌性血管瘤和组织肉芽肿等,这与患者的免疫力和细菌的血行播散(嗜红细胞)特性密切相关[20]。在野外调查的自然感染动物中,多组织感染巴尔通体的证据尚少。因此,本研究对野外采集的啮齿动物心、肝、脾等主要组织进行了系统检测,分离活菌,旨在了解自然状态下,巴尔通体对这些组织的侵袭浸润。在本研究中,啮齿动物心、肝、脾、肺和肾组织主要体内组织普遍受到侵袭,各组织中均可分离到巴尔通体菌株,不同组织巴尔通体培养阳性率没有差异,提示巴尔通体无明显的组织特异性亲嗜性。实验共检出7种巴尔通体,每种在心、肝、脾、肺和肾组织中均有检出,除格拉汉姆巴尔通体外,其他6种巴尔通体数量过少,只能初步提示巴尔通体的种类差异对其在组织中的分布没有影响,需要更多其他种类巴尔通体的调查研究证实这一推论。
本研究还发现在密山口岸捕获的啮齿动物中巴尔通体有较高的感染率,与中国东北地区[21-22]及其他地区的调查结果一致[3],其中,黑线姬鼠是优势种,占捕获动物的83.0%(68/81),88.9%(40/45)巴尔通体菌株来源于这一鼠种,并且所含巴尔通体种类最多(5/7),表明黑线姬鼠是这一地区巴尔通体的最主要啮齿动物宿主。其中菌株数量较多的格拉汉姆巴尔通体为绝对优势种〔Berger-Parker优势度指数(D)= Nmax/N,D=0.733〕,是一种致病性巴尔通体[23-24],虽然在国内尚无相关疾病报道,但应引起重视。黑线姬鼠是东北地区的优势鼠种,分布广泛,作为巴尔通体主要宿主动物,为其保存和传播起到重要作用。
通过对黑龙江密山口岸捕获的野外啮齿动物的巴尔通体带菌情况分析,可以确定自然感染状态下,心、肝等机体主要组织均可受到巴尔通体感染。研究结果可用以指导现场调查和监测过程中的样品取材,为巴尔通体病原体监测和其他相关研究提供依据。
利益冲突 无
| [1] |
Gutiérrez R, Krasnov B, Morick D, et al. Bartonella infection in rodents and their flea ectoparasites: an overview[J]. Vector Borne Zoonotic Dis, 2015, 15(1): 27-39. DOI:10.1089/vbz.2014.1606 |
| [2] |
Buffet JP, Kosoy M, Vayssier-Taussat M. Natural history of Bartonella-infecting rodents in light of new knowledge on genomics, diversity and evolution[J]. Future Microbiol, 2013, 8(9): 1117-1128. DOI:10.2217/fmb.13.77 |
| [3] |
马洁琼, 栗冬梅, 陈忠科, 等. 鼠传巴尔通体流行概况[J]. 疾病监测, 2018, 33(1): 7-14. Ma JQ, Li DM, Chen ZK, et al. Epidemiological characteristics of rodent-borne Bartonella[J]. Dis Surveill, 2018, 33(1): 7-14. DOI:10.3784/j.issn.1003-9961.2018.01.004 |
| [4] |
Greub G, Raoult D. Bartonella: new explanations for old diseases[J]. J Med Microbiol, 2002, 51(11): 915-923. DOI:10.1099/0022-1317-51-11-915 |
| [5] |
Iannino F, Salucci S, Di Provvido A, et al. Bartonella infections in humans dogs and cats[J]. Vet Ital, 2018, 54(1): 63-72. DOI:10.12834/VetIt.398.1883.2 |
| [6] |
Eicher SC, Dehio C. Bartonella entry mechanisms into mammalian host cells[J]. Cell Microbiol, 2012, 14(8): 1166-1173. DOI:10.1111/j.1462-5822.2012.01806.x |
| [7] |
Dehio C. Bartonella-host-cell interactions and vascular tumour formation[J]. Nat Rev Microbiol, 2005, 3(8): 621-631. DOI:10.1038/nrmicro1209 |
| [8] |
Okaro U, Addisu A, Casanas B, et al. Bartonella Species, an emerging cause of Blood-Culture-Negative endocarditis[J]. Clin Microbiol Rev, 2017, 30(3): 709-746. DOI:10.1128/CMR.00013-17 |
| [9] |
Gutiérrez R, Vayssier-Taussat M, Buffet JP, et al. Guidelines for the isolation, molecular detection, and characterization of Bartonella species[J]. Vector Borne Zoonotic Dis, 2017, 17(1): 42-50. DOI:10.1089/vbz.2016.1956 |
| [10] |
Deng HK, Le Rhun D, Lecuelle B, et al. Role of the spleen in Bartonella spp. infection[J]. FEMS Immunol Med Microbiol, 2012, 64(4): 143-145. DOI:10.1111/j.1574-695X.2011.00908.x |
| [11] |
Corduneanu A, Sándor AD, Ionică AM, et al. Bartonella DNA in heart tissues of bats in central and eastern Europe and a review of phylogenetic relations of bat-associated Bartonellae[J]. Parasit Vectors, 2018, 11(1): 489. DOI:10.1186/s13071-018-3070-7 |
| [12] |
Kehoe SP, Chomel BB, Stuckey MJ, et al. Zoonotic Bartonella species in cardiac valves of healthy coyotes, California, USA[J]. Emerg Infect Dis, 2014, 20(12): 2133-2136. DOI:10.3201/eid2012.140578 |
| [13] |
Chomel BB, Kasten RW, Williams C, et al. Bartonella endocarditis: a pathology shared by animal reservoirs and patients[J]. Ann N Y Acad Sci, 2009, 1166: 120-126. DOI:10.1111/j.1749-6632.2009.04523.x |
| [14] |
Melenotte C, Edouard S, Lepidi H, et al. Diagnosis of infectious lymphadenitis[J]. Rev Med Interne, 2015, 36(10): 668-676. DOI:10.1016/j.revmed.2015.04.004 |
| [15] |
Lin YY, Hsiao CH, Hsu YH, et al. Immunohistochemical study of lymph nodes in patients with cat scratch disease[J]. J Formos Med Assoc, 2006, 105(11): 911-917. DOI:10.1016/S0929-6646(09)60176-5 |
| [16] |
Kordick DL, Brown TT, Shin K, et al. Clinical and pathologic evaluation of chronic Bartonella henselae or Bartonella clarridgeiae infection in cats[J]. J Clin Microbiol, 1999, 37(5): 1536-1547. DOI:10.1128/JCM.37.5.1536-1547.1999 |
| [17] |
Norman AF, Regnery R, Jameson P, et al. Differentiation of Bartonella-like isolates at the species level by PCR-restriction fragment length polymorphism in the citrate synthase gene[J]. J Clin Microbiol, 1995, 33(7): 1797-1803. DOI:10.1128/JCM.33.7.1797-1803.1995 |
| [18] |
Florin TA, Zaoutis TE, Zaoutis LB. Beyond cat scratch disease: widening spectrum of Bartonella henselae infection[J]. Pediatrics, 2008, 121(5): e1413-e1425. DOI:10.1542/peds.2007-1897 |
| [19] |
Nelson CA, Saha S, Mead PS. Cat-scratch disease in the United States, 2005-2013[J]. Emerg Infect Dis, 2016, 22(10): 1741-1746. DOI:10.3201/eid2210.160115 |
| [20] |
Gouriet F, Lepidi H, Habib G, et al. From cat scratch disease to endocarditis, the possible natural history of Bartonella henselae infection[J]. BMC Infect Dis, 2007, 7: 30. DOI:10.1186/1471-2334-7-30 |
| [21] |
Li DM, Hou Y, Song XP, et al. High prevalence and genetic heterogeneity of rodent-borne Bartonella species on Heixiazi Island, China[J]. Appl Environ Microbiol, 2015, 81(23): 7981-7992. DOI:10.1128/AEM.02041-15 |
| [22] |
左双燕. 我国黑龙江林区鼠型动物巴尔通体感染调查与分离鉴定[D]. 长沙: 中南大学, 2012. Zuo SY. Detection and Isolation of Bartonella spp. in rodents in Helongjiang province of China[D]. Changsha: Central South University, 2012. |
| [23] |
Kerkhoff FT, Bergmans AMC, van der Zee A, et al. Demonstration of Bartonella grahamii DNA in ocular fluids of a patient with neuroretinitis[J]. J Clin Microbiol, 1999, 37(12): 4034-4038. DOI:10.1128/JCM.37.12.4034-4038.1999 |
| [24] |
Oksi J, Rantala S, Kilpinen S, et al. Cat scratch disease caused by Bartonella grahamii in an immunocompromised patient[J]. J Clin Microbiol, 2013, 51(8): 2781-2784. DOI:10.1128/JCM.00910-13 |
 2021, Vol. 32
2021, Vol. 32


