扩展功能
文章信息
- 李基旭, 朴文, 金光俊
- LI Ji-xu, PIAO Wen, JIN Guang-jun
- 长角血蜱经卵传播斑点热群立克次体新基因型Candidatus Rickettsia longicornii的研究
- Transovarial transmission of a new genotype Candidatus Rickettsia longicornii of spotted fever group Rickettsia in Haemaphysalis longicornis
- 中国媒介生物学及控制杂志, 2021, 32(2): 139-143
- Chin J Vector Biol & Control, 2021, 32(2): 139-143
- 10.11853/j.issn.1003.8280.2021.02.004
-
文章历史
- 收稿日期: 2020-02-04
2 珲春市疾病预防控制中心, 吉林 珲春 133300
2 Hunchun Center for Disease Control and Prevention, Hunchun, Jilin 133300, China
蜱是广泛存在于自然界中的非常重要的医学媒介生物,可以传播病毒、细菌、立克次体、螺旋体、原虫等多种病原体。蜱主要寄生于脊椎动物(除鱼类)[1],通过叮咬方式传播疾病,人是其偶然宿主。据文献报道,全世界约10%的蜱类携带各种病原体[2-3]。蜱可以引起人兽共患病,对野生动物和家畜以及人类健康带来严重影响。目前,在世界范围内不断出现新的蜱传疾病,如发热伴血小板综合征(severe fever with thrombocytopenia syndrome,SFTS),新塔拉塞维奇立克次体(Candidatus Rickettsia tarasevichiae)病等[4-11]。2018年,韩国学者采用立克次体分类标准[12],在长角血蜱(Haemaphysalis longicornis)体内又发现了新的斑点热群立克次体(spotted fever group rickettsia,SFGR)基因型,命名为“Candidatus Rickettsia longicornii”[13]。尽管尚未见到Candidatus R. longicornii引起病例的报道,但其基因序列与从韩国鼠脾组织和中国人血中检测到的未命名立克次体基因序列高度同源[13],提示该基因型可能对哺乳动物和人类具有感染性。据研究,SFGR可以在蜱和哺乳动物之间形成持久的感染循环[14-16],并可以通过蜱卵进行垂直传播[17-18]。为确认Candidatus R. longicornii是否可以通过蜱卵传播,并了解长角血蜱的传播能力,我们开展了此次研究,现报告如下。
1 材料与方法 1.1 样本来源饱血长角血蜱共55只,均为雌性成蜱,于2019年5-6月采集于吉林省珲春市杨泡乡红旗河村牛体表。按照《中国重要医学昆虫分类学与鉴别》[19]和《Ticks of Japan,Korea and the Ryukyu Islands》[20]对蜱虫分类。
1.2 饱血蜱产卵前处理在采集的饱血蜱中选择虫体未受损伤的活蜱,用足量磷酸盐缓冲溶液(phosphate buffered saline,PBS)冲洗3次,放入室温密封的平皿中,每天观察产卵情况。平皿底部事先放置高压灭菌后的过滤纸,加入适量高压灭菌水。
1.3 蜱卵采集和蜱虫母体处理饱血成蜱一般在室温环境下3~4 d开始产卵,待产卵量达到一定数量后,开始采集蜱卵。每只饱血蜱采集10组卵,每组采集约50只卵。蜱虫母体不产卵或产卵量明显下降时,回收蜱虫母体。采集蜱卵时,采集工具用75%乙醇溶液进行严格消毒。每次采集完,在平皿中补足高压灭菌水,并重新密封后在室温放置。每组蜱卵和蜱虫母体分别放入不同的1.5 ml离心管中,再加入适量75%乙醇溶液浸泡20 min,用足量PBS冲洗3次。所有待检样品均保存在-80 ℃低温冰箱。对未产卵、产卵量不够的母体仅做核酸检测。如母体产卵后出现腐败现象,与其蜱卵一同作废弃物处理。
1.4 蜱虫母体和蜱卵核酸提取每个蜱虫母体和每组蜱卵样品加入600 μl PBS,使用德国凯杰公司(Qiagen)生产的组织破碎仪(型号:TissueLyser Ⅱ)进行研磨。研磨后使用硕世生物科技(江苏)股份有限公司生产的组织核酸提取盒参照使用说明提取核酸。
1.5 Candidatus R.longicornii核酸检测设计SFGR Candidatus R. longicornii基因型特异性引物H-L16S-F:TGCAAGTCGAACGGACTAATTGG,H-L16S-R:AATGAGGGTTGCGCTCGTTG;用聚合酶链式反应(PCR)扩增其基因片段,扩增片段长度大小为976 bp。试剂使用PCR预混试剂(Promega Gotaq@Colorless Master Mix,USA)。扩增体系为正、反向引物(浓度:10 μmol/L)各1 μl,DNA模板5 μl,配制25 μl体系。反应条件为95 ℃变性2 min;95 ℃ 35 s,65 ℃ 35 s,72 ℃ 1 min 20 s,共35个循环;72 ℃延伸5 min。反应结束后,使用德国凯杰公司(Qiagen)的毛细管电泳系统(QIAxcel screen Gel)检测特异条带。
1.6 基因测序和遗传进化分析由生工生物工程(上海)股份有限公司对阳性扩增产物进行测序,并使用DNAStar软件进行基因序列拼接和校正,与美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)DNA序列数据库中默认序列进行一致性分析,并用MEGA 5.0软件构建系统进化树。
1.7 统计学分析使用Excel 2007表格进行数据处理与统计分析。蜱成虫计算阳性率,蜱卵计算最低感染率(minimum infection rate per 100 ticks,MIR)。
MIR=阳性组数/蜱卵总数×100%[21]
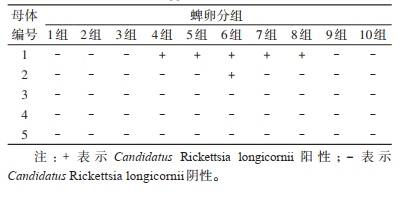
2 结果 2.1 长角血蜱母体检测结果55只饱血长角血蜱经实验室诱导产卵后均未产生腐败现象,经Candidatus R. longicornii核酸检测,21只阳性,阳性率为38.18%,其阳性样品均扩增出特异性条带。见图 1。

|
| 注:M表示DNA Marker;NC阴性对照;S1~S5表示样本。 图 1 部分长角血蜱母体样本Candidatus Rickettsia longicornii PCR扩增产物电泳结果 Figure 1 Electrophoresis results of PCR amplification products from Candidatus Rickettsia longicornii in some mothers of Haemaphysalis longicornis |
| |
55只长角血蜱母体中有47只产卵量达到要求。从21只阳性母体样本中选择产卵量达到要求,且核酸检测达到“强阳性”标准的5个样本,对其所有蜱卵样本进行检测,共50组,约2 500只蜱卵。2只母体的6组蜱卵样本中检出Candidatus R. longicornii阳性,其蜱卵MIR为0.24%,阳性样品均扩增出特异性条带。见表 1、图 2。
|
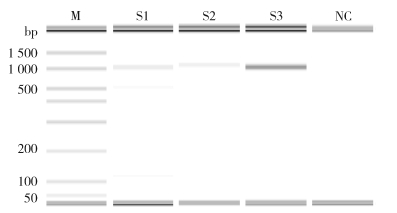
|
| 注:M表示DNA Marker;NC阴性对照;S1~S3表示样本。 图 2 部分长角血蜱蜱卵样品PCR扩增产物电泳结果 Figure 2 Electrophoresis results of PCR amplification products from Candidatus Rickettsia longicornii in some eggs of Haemaphysalis longicornis |
| |
对5只长角血蜱母体样品的PCR扩增产物进行基因测序,成功获得5个基因序列,大小为967~968 bp。经同源性分析,与首次在韩国发现的蜱源ROK-HL727株Candidatus R. longicornii基因序列(NCBI GenBank登录号:MG906672)同源性均达到99.79%以上;6组Candidatus R. longicornii阳性蜱卵样品中只有1组显示“强阳性”,对其PCR扩增产物进行基因测序,获得967 bp基因序列,与韩国ROK-HL727株基因序列同源性达到99.79%;蜱卵的Candidatus R. longicornii基因序列(NCBI GenBank登录号:MN997108)和其母体Candidatus R. longicornii基因序列(NCBI GenBank登录号:MN994280)间同源性达到99.69%。
2.4 遗传进化分析把长角血蜱母体中发现的5个SFGR Candidatus R. longicornii基因序列和蜱卵中发现的1个Candidatus R. longicornii基因序列与NCBI DNA数据库中其他SFGR基因型和Candidatus R. longicornii基因序列构建系统进化树。结果发现,在此次研究中获得的所有Candidatus R. longicornii序列与韩国ROK-HL727株基因序列以及笔者在2017和2018年本研究区域采集的长角血蜱中检测到的YBHC-T32/2017和YBHC424/2018株Candidatus R. longicornii基因序列均形成一簇。在遗传进化关系上,此次研究中发现的长角血蜱母体和蜱卵Candidatus R. longicornii基因序列与韩国ROK-HL727株Candidatus R. longicornii基因序列具有较近遗传进化关系,且明显与其他SFGR种和基因型不同,所有Candidatus R. longicornii序列共同形成另一个独立分支。见图 3。

|
| 注:●本研究中发现的基因序列。 图 3 基于Candidatus Rickettsia longicornii基因序列构建的遗传进化树 Figure 3 Phylogenetic tree based on the sequencing results of Candidatus Rickettsia longicornii |
| |
SFGR属于立克次体目(Rickettsiales)、立克次体科(Rickettsiaceae)、立克次体属,是一类原核生物型、短小棒状或球形状、革兰阴性专性细胞内繁殖的微生物。蜱是传播SFGR的重要媒介,蜱在SFGR传播过程中起到媒介和储存宿主的双重作用。SFGR可以通过蜱叮咬形成水平传播,又可以经蜱卵进行垂直传播[18]。近年来,世界范围内不断发现SFGR的新种或新基因型,而且绝大部分种类致病性尚不清楚[15]。
Candidatus R. longicornii为韩国学者首次在长角血蜱中确认的新的SFGR基因型[13]。据笔者调查,长角血蜱携带Candidatus R. longicornii基因型存在种特异性,其感染率明显高于其他蜱种[22]。为进一步了解长角血蜱的Candidatus R. longicornii传播过程,本研究在实验室环境下对饱血长角血蜱诱导产卵,采集蜱卵并检测其中的Candidatus R. longicornii,以掌握感染情况,通过测序分析长角血蜱母体和蜱卵中Candidatus R. longicornii基因序列来验证长角血蜱的垂直传播能力。结果,本研究在受Candidatus R. longicornii感染的饱血长角血蜱蜱卵中检测到Candidatus R. longicornii,同时,发现长角血蜱的Candidatus R. longicornii感染率较高。对从长角血蜱母体和蜱卵中获得的Candidatus R. longicornii基因序列进行同源性和遗传进化分析发现,其基因序列与首次在韩国发现的蜱源ROK-HL727株基因序列同源性均达到了99.79%以上,并共同形成1簇,处于同一个分支上,所有Candidatus R. longicornii基因序列明显区别于其他种和基因型的SFGR基因序列,形成独立分支。这些现象表明,Candidatus R. longicornii在SFGR遗传进化关系上属于新的分支,属于新的基因型,而且与SFGR一样,同样具有通过蜱卵垂直传播能力。结合前期的研究结果[22],我们还进一步明确了长角血蜱在Candidatus R. longicornii感染循环中可起到媒介和储存宿主的双重作用。此外,长角血蜱还具有非常明显的聚集性地理分布特征[23-25]。这种长角血蜱所具有的病原体垂直传播特征和聚集性地理分布特征可能容易引起与之相关蜱媒传染病在特定地区暴发和流行。因此,我们必须加强针对长角血蜱的监测力度,积极防控人和动物相关传染病在当地流行。
综上,本研究为长角血蜱的病原体传播机制方面提供了一定的实验依据。今后,我们还可以继续对感染长角血蜱的SFGR Candidatus R. longicornii基因型经期传播方面进行研究,以便进一步确定长角血蜱不同成长阶段的病原体传播能力。
利益冲突 无
| [1] |
Klompen JSH, Black WC, Keirans JE, et al. Evolution of ticks[J]. Annu Rev Entomol, 1996, 41: 141-161. DOI:10.1146/annurev.en.41.010196.001041 |
| [2] |
Oliver Jr JH. Biology and systematics of ticks (Acari:Ixodida)[J]. Annu Rev Ecol Syst, 1989, 20: 397-430. DOI:10.1146/annurev.es.20.110189.002145 |
| [3] |
Jongejan F, Uilenberg G. The global importance of ticks[J]. Parasitology, 2004, 129(Suppl 1): s3-14. DOI:10.1017/s0031182004005967 |
| [4] |
李德新. 发热伴血小板减少综合征布尼亚病毒概述[J]. 中华实验和临床病毒学杂志, 2011, 25(2): 81-84. Li DX. Fever with thormbocytopenia associated with a novel Bunyavirus in China[J]. Chin J Exp Clin Virol, 2011, 25(2): 81-84. DOI:10.3760/cma.j.issn.1003-9279.2011.02.001 |
| [5] |
Zhang YZ, Zhou DJ, Xiong YW, et al. Hemorrhagic fever caused by a novel tick-borne Bunyavirus in Huaiyangshan, China[J]. Chin J Epidemiol, 2011, 32(3): 209-220. DOI:10.3760/cma.j.issn.0254-6450.2011.03.001 |
| [6] |
李昱, 周航, 牟笛, 等. 中国2011-2014年发热伴血小板减少综合征流行特征分析[J]. 中华流行病学杂志, 2015, 36(6): 598-602. Li Y, Zhou H, Mu D, et al. Epidemiological analysis on severe fever with thrombocytopenia syndrome under the national surveillance data from 2011 to 2014, China[J]. Chin J Epidemiol, 2015, 36(6): 598-602. DOI:10.3760/cma.j.issn.0254-6450.2015.06.013 |
| [7] |
Jiao YJ, Zeng XY, Guo XL, et al. Preparation and evaluation of recombinant severe fever with thrombocytopenia syndrome virus nucleocapsid protein for detection of total antibodies in human and animal sera by double-antigen sandwich enzyme-linked immunosorbent assay[J]. J Clin Microbiol, 2012, 50(2): 372-377. DOI:10.1128/JCM.01319-11 |
| [8] |
Zhao L, Zhai SY, Wen HL, et al. Severe fever with thrombocytopenia syndrome virus, Shandong province, China[J]. Emerg Infect Dis, 2012, 18(6): 963-965. DOI:10.3201/eid1806.111345 |
| [9] |
刘力, 官旭华, 邢学森, 等. 2010年湖北省发热伴血小板减少综合征的流行病学分析[J]. 中华流行病学杂志, 2012, 33(2): 168-172. Liu L, Guan XH, Xing XS, et al. Epidemiologic analysis on severe fever with thrombocytopenia syndrome in Hubei province, 2010[J]. Chin J Epidemiol, 2012, 33(2): 168-172. DOI:10.3760/cma.j.issn.0254-6450.2012.02.009 |
| [10] |
Cui F, Cao HX, Wang L, et al. Clinical and epidemiological study on severe fever with thrombocytopenia syndrome in Yiyuan county, Shandong province, China[J]. Am Soc Trop Med Hyg, 2013, 88(3): 510-512. DOI:10.4269/ajtmh.11-0760 |
| [11] |
Jia N, Zheng YC, Jiang JF, et al. Human infection with Candidatus rickettsia tarasevichiae[J]. N Engl J Med, 2013, 369(12): 1178-1180. DOI:10.1056/NEJMc1303004 |
| [12] |
Fournier PE, Dumler JS, Greub G, et al. Gene sequence-based criteria for identification of new Rickettsia isolates and description of Rickettsia heilongjiangensissp. nov[J]. J Clin Microbiol, 2003, 41(12): 5456-5456. DOI:10.1128/jcm.41.12.5456-5465.2003 |
| [13] |
Jiang J, An HJ, Lee JS, et al. Molecular characterization of Haemaphysalis longicornis-borne rickettsiae, Republic of Korea and China[J]. Ticks Tick Borne Dis, 2018, 9(6): 1606-1613. DOI:10.1016/j.ttbdis.2018.07.013 |
| [14] |
Grasperge BJ, Wolfson W, Macaluso KR. Rickettsia parkeri infection in domestic dogs, Southern Louisiana, USA, 2011[J]. Emerg Infect Dis, 2012, 18(6): 995-997. DOI:10.3201/eid1806.120165 |
| [15] |
王卓, 王建伟, 于淼, 等. 东北地区蜱传斑点热群立克次体的分子流行病学研究[J]. 中国媒介生物学及控制杂志, 2018, 29(4): 344-347. Wang Z, Wang JW, Yu M, et al. Molecular epidemiological studies on spotted fever group rickettsia in ticks from Northeastern China[J]. Chin J Vect Biol Control, 2018, 29(4): 344-347. DOI:10.11853/j.issn.1003.8280.2018.04.005 |
| [16] |
张健之, 范明远. 中国斑点热的研究成就[J]. 中华流行病学杂志, 1999, 20(2): 71-73. Zhang JZ, Fan MY. Research achievements of spotted fever in China[J]. Chin J Epidemiol, 1999, 20(2): 71-73. DOI:10.3760/j.issn:0254-6450.1999.02.002 |
| [17] |
Zhang JZ, Fan MY, Yu XJ, et al. Phylogenetic analysis of the Chinese Rickettsia isolate BJ-90[J]. Emerg Infect Dis, 2000, 6(4): 432-433. DOI:10.3201/eid0604.000426 |
| [18] |
Parola P, Paddock CD, Raoult D. Tick⁃borne rickettsioses around the world:emerging diseases challenging old concepts[J]. Clin Microbiol Rev, 2005, 18(4): 719-756. DOI:10.1128/CMR.18.4.719-756.2005 |
| [19] |
陆宝麟, 吴厚永. 中国重要医学昆虫分类与鉴别[M]. 郑州: 河南科学技术出版社, 2003: 652-713. Lu BL, Wu HY. Classification and identification of important medical insects of China[M]. Zhengzhou: Henan Science and Technology Press, 2003: 652-713. |
| [20] |
Yamaguti N, Tipton VJ, Keegan HL, et al. Ticks of Japan, Korea, and the Ryukyu islands[J]. Brigham Young Univ Sci Bull Biol Ser, 1971, 15(1): 1. |
| [21] |
Yun SM, Lee YJ, Choi W, et al. Molecular detection of severe fever with thrombocytopenia syndrome and tick-borne encephalitis viruses in ixodid ticks collected from vegetation, Republic of Korea, 2014[J]. Ticks Tick Borne Dis, 2016, 7(5): 970-978. DOI:10.1016/j.ttbdis.2016.05.003 |
| [22] |
李基旭, RohJY, ParkWI, 等. 图们江流域边境地区蜱携带斑点热群立克次体调查研究[J]. 中华预防医学杂志, 2019, 53(11): 1130-1135. Li JX, Roh JY, Park WI, et al. Investigation and research on ticks carrying spotted fever group rickettsia in the border area of Tumen River Basin[J]. Chin J Prev Med, 2019, 53(11): 1130-1135. DOI:10.3760/cma.j.issn.0253-9624.2019.11.011 |
| [23] |
李基旭, YunSM, KimSY, 等. 吉林省延边地区蜱类分布及其携带发热伴血小板减少综合征病毒调查[J]. 寄生虫与医学昆虫学报, 2017, 24(2): 132-140. Li JX, Yun SM, Kim SY, et al. Ticks and their potential infection with severe fever with thrombocytopenia syndromes virus in Yanbian, Jilin[J]. Acta Parasitol Med Entomol Sin, 2017, 24(2): 132-140. DOI:10.3969/j.issn.1005-0507.2017.02.010 |
| [24] |
李基旭, ChoSH, 朴文, 等. 图们江流域中朝俄边境地区长角血蜱中SFTS病毒监测分析[J]. 中华疾病控制杂志, 2019, 23(2): 201-205, 211. Li JX, Cho SH, Piao W, et al. Surveillance and analysis of Haemaphysalis Iongicornis with SFTS virus in Tumen river basin located in the frontiers of Russia, Korea and Northeast China[J]. Chin J Dis Control Prev, 2019, 23(2): 201-205, 211. DOI:10.16462/j.cnki.zhjbkz.2019.02.016 |
| [25] |
李基旭, ChoSH, KimSY, 等. 吉林省图们江流域常见蜱类调查研究[J]. 中国媒介生物学及控制杂志, 2020, 31(4): 446-450. Li JX, Cho SH, Kim SY, et al. An investigation of common ticks in the Tumen River basin, Jilin province, China[J]. Chin J Vector Biol Control, 2020, 31(4): 446-450. DOI:10.11853/j.issn.1003.8280.2020.04.014 |
 2021, Vol. 32
2021, Vol. 32

