扩展功能
文章信息
- 薛志静, 赵宁, 王君, 宋秀平, 孟凤霞, 梁文琴, 周敬祝, 王丹, 张忠, 刘起勇
- XUE Zhi-jing, ZHAO Ning, WANG Jun, SONG Xiu-ping, MENG Feng-xia, LIANG Wen-qin, ZHOU Jing-zhu, WANG Dan, ZHANG Zhong, LIU Qi-yong
- 蚊媒甲病毒属病毒半巢式PCR方法的建立及应用
- Establishment and application of RT-hemi-nested PCR assay for detection of mosquito-borne alphaviruses
- 中国媒介生物学及控制杂志, 2021, 32(2): 132-138
- Chin J Vector Biol & Control, 2021, 32(2): 132-138
- 10.11853/j.issn.1003.8280.2021.02.003
-
文章历史
- 收稿日期: 2020-11-06
2 山东第一医科大学基础医学院, 山东 泰安 271000;
3 贵州省疾病预防控制中心, 贵州 贵阳 550004;
4 山东省新发传染病溯源与防控协同创新中心, 山东 泰安 271000
2 Department of Pathogenic Biology, Shandong First Medical University, Tai'an, Shandong 271000, China;
3 Guizhou Center for Disease Control and Prevention, Guiyang, Guizhou 550004, China;
4 Collaborative Innovation Center for the Origin and Control of Emerging Infectious Diseases, Tai'an, Shandong 271000, China
甲病毒属病毒是最重要的蚊媒病毒之一,与人类疾病密切相关的甲病毒属病毒主要有基孔肯雅病毒、辛德毕斯病毒、东方马脑炎病毒、西方马脑炎病毒等[1],引起以发热为主要症状的疾病,严重者可导致人类死亡,蚊媒甲病毒属病毒的感染已成为世界范围内严重的公共卫生问题[2]。甲病毒属病毒多流行于美洲大陆,但仍然是国际上严密监控的人兽共患传染病病毒,因此甲病毒属病毒的研究也受到越来越多的重视[3]。近年来,随着全球气候变暖、国内外人口流动频繁及蚊虫防控措施不当等,蚊媒病毒分布区域不断扩大,蚊媒病的发病率不断升高[4]。因此,对蚊媒病毒和蚊媒传染病进行快速有效的检测和诊断,是迅速做好切断传播途径、控制疾病蔓延的重要前提。高效检测蚊虫携带的病毒对预防和控制蚊媒传染病的传播具有重要的意义[5-6]。本研究旨在建立一种快速灵敏适合于蚊虫甲病毒属病毒检测的方法。
1 材料与方法 1.1 材料 1.1.1 毒株和菌株辛德毕斯病毒(Sindbis virus,SINV)、基孔肯雅病毒(Chikungunya virus,CHIKV)、流行性乙型脑炎病毒(Japanese encephalitis virus,JEV)、登革Ⅱ型病毒(Dengue type-2 virus,DENVⅡ)、黄热病毒(Yellow fever virus,YFV)和西尼罗病毒(West Nile virus,WNV)的RNA均由中国疾病预防控制中心(CDC)病毒病预防控制所提供,由本实验室保存。大肠埃希菌(Escherichia coli,E. coli DH5α)购自北京全式金生物技术有限公司。
1.1.2 蚊虫 1.1.2.1 白纹伊蚊(Aedes albopictus)为本实验室饲养品系,养殖条件:温度(26±1)℃,相对湿度(75±5)%,光照周期(L:D)=14 h:10 h。幼蚊饲养在含有脱氯水的方形塑料盆内,幼蚊饲料配方为猪肝/发面馒头=1/1磨碎过筛后的粉末。成虫饲喂10%的蔗糖水。
1.1.2.2 野外蚊虫采集2018年7-8月由贵州省CDC协助在贵州省黎平及从江县、花溪和乌当区4个不同地理位置设立采集点采集蚊虫(图 1)。采集点为居民区、距离污水池或稻田较近地点以及与人兽共患病关系密切的猪圈、牛圈、羊圈等牲畜棚,采集时间为20:00到次日08:00,使用紫外诱蚊灯法进行蚊虫采集。共捕获蚊虫17 018只,其中骚扰阿蚊(Armigeres subalbatus)6 636只,占捕获总数的39.00%(6 636/17 018),三带喙库蚊(Culex tritaeniorhynchus)占34.02%(5 790/17 018),中华按蚊(Anopheles sinensis)占24.68%(4 201/17 018),其他蚊种占2.30%(391/17 018)。由于白纹伊蚊主要是白天活动的蚊种,本次未捕获到该蚊。蚊虫种类鉴定后分装至冻存管,置于液氮罐暂时保存,最后使用干冰将蚊虫标本运输至中国CDC传染病预防控制所媒介生物控制室,保存于实验室的液氮罐中备用。
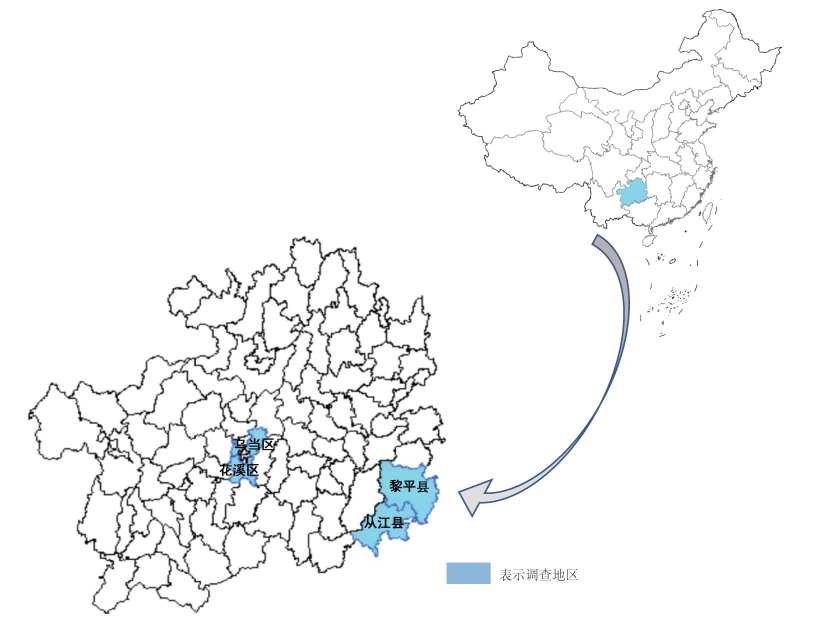
|
| 图 1 蚊虫标本采集地分布(示意图) Figure 1 Distribution of locations for mosquito collection(Illustration) |
| |
RNA提取试剂盒(RNeasy Mini Kit)、cDNA第一链合成试剂盒(QuantiNovaTM Reverse Transcription Kit)、凝胶回收试剂盒(EasyPureR Quick Gel Extraction Kit)、质粒连接试剂盒(pEASYR-T1 Simple Cloning Kit)、质粒提取试剂盒(EasyPureR Plasmid MiniPrep Kit)、Go TaqR Green Master Mix、DL2000 DNA Marker、Gold-View染色液等;PCR扩增仪(Applied Biosystems公司)、Cel Doc XR4凝胶成像仪(美国BIO-RAD公司)、EPS301电泳仪(美国GE公司)、Arium 61/VFD超纯水仪(美国Sartorius公司)、G100高通量组织研磨仪(北京卡尤迪生物科技有限公司)、NanoDrop-1000微量核酸浓度测定仪(美国Thermo Fisher Scientific公司)等。
1.2 方法 1.2.1 RNA提取和cDNA合成将本实验室饲养的白纹伊蚊置于1.5 ml离心管中用研磨仪将蚊虫完全磨碎,按照Rneasy Mini Kit(QIAGEN,Germany公司)试剂盒操作说明提取蚊虫RNA,得到的RNA核酸-40 ℃保存备用。使用QuantiNovaTM Reverse Transcription Kit(QIAGEN,Germany公司)制备蚊虫及病毒cDNA。
1.2.2 引物设计及合成根据GenBank数据库中已公布的蚊媒甲病毒序列,运用MEGA 7软件在其保守区设计了3条通用引物,不保守的核苷酸位点进行简并,序列见表 1,引物由北京擎科新业生物技术有限公司合成。
以SINV、CHIKV cDNA为模板优化半巢式PCR扩增体系。第一轮PCR反应体系为25 µl,包括2× Go TaqR Green Master Mix 12.5 µl,XA-F1(10 µmol/L)1 µl,XA-R(10 µmol/L)1 µl,以SINV和CHIKV cDNA各1 µl为模板,用ddH2O补足体积至25 µl。PCR反应条件为:95 ℃ 2 min;95 ℃ 1 min,54 ℃ 1 min,72 ℃ 10 s,共30个循环;72 ℃延伸5 min。第二轮PCR反应体系为25 µl,包括2× Go TaqR Green Master Mix 12.5 µl,XA-F2(10 µmol/L)1 µl,XA-R(10µmol/L)1 µl,第一轮PCR产物为模板,用ddH2O补足体积至25 µl。PCR反应条件为:95 ℃ 2 min;95 ℃ 1 min,60 ℃ 1 min,72 ℃ 10 s,共30个循环;72 ℃延伸5 min。将得到的PCR产物用1.5%的琼脂糖凝胶电泳进行检测。
1.2.4 标准品的制备按照EasyPureR Quick Gel Extraction Kit试剂盒操作说明回收PCR阳性产物,应用pEASYR-T1 Simple Cloning Kit试剂盒将回收的目的片段与pEASYR-T1 Simple Cloning Vector连接,构建重组质粒。将质粒转化至大肠埃希菌DH5α,阳性菌落进行测序。应用EasyPureR Plasmid MiniPrep Kit试剂盒提取重组质粒DNA,用核酸浓度测定仪分别测定其浓度,计算各自的拷贝数:
Y(拷贝/µl)=〔(Xg/µl)/(重组质粒碱基数×660)〕×6.02×1023。
1.2.5 半巢式PCR方法的评价 1.2.5.1 敏感性测定使用核酸定量仪测定SINV、CHIKV的核酸浓度并换算成拷贝数。用蒸馏水10倍递次稀释至3×100拷贝/µl,从3×109拷贝/µl开始每个稀释度取1 µl为模板,采用半巢式PCR进行检测。
1.2.5.2 特异性测定以SINV、CHIKV、SINV+蚊虫cDNA、CHIKV+蚊虫cDNA、蚊虫cDNA、JEV、DENVⅡ、YFV、WNV为模板,用建立的半巢式PCR体系进行扩增,以检测体系的特异性。
1.2.6 半巢式PCR方法检测野外采集蚊虫样本取野外采集的蚊虫样本每组30~50只进行研磨处理,按照RNA提取试剂盒提取RNA并进行半巢式PCR扩增。经1.5%琼脂糖凝胶电泳,将阳性扩增产物送北京擎科新业生物技术有限公司测序。
2 结果 2.1 通用引物的设计通过基因组序列比对,在甲病毒属病毒的保守区设计XA-F1、XA-F2和XA-R 3条引物,其中XA-F1和XA-R在病毒基因中的起始位点分别为186和585位碱基,XA-F2和XA-R在病毒基因中的起始位点分别为309和585位碱基,XA-F2位于XA-F1引物的内侧。序列比对结果见表 2,不保守的核苷酸位点较多,通过比对进行了碱基的简并。
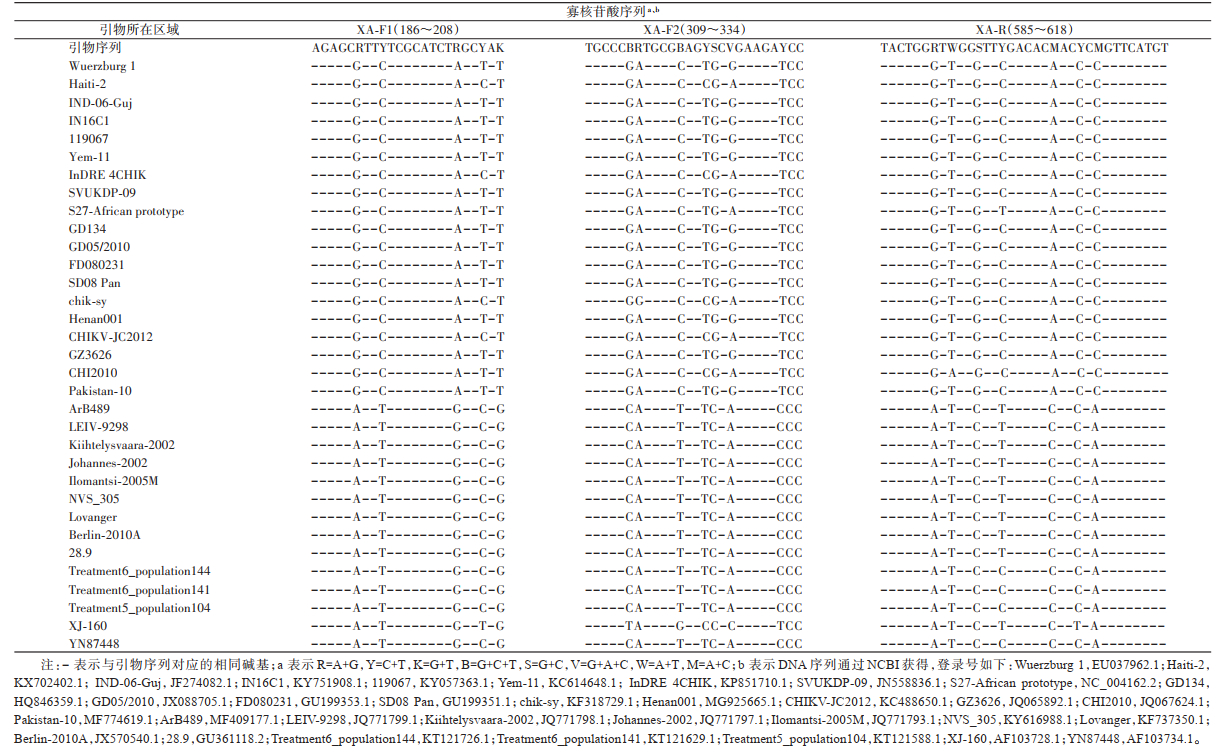
|
以SINV、CHIKV cDNA为模板进行半巢式PCR扩增,扩增产物经1.5%琼脂糖凝胶电泳,均见约310 bp的扩增条带,大小与目的基因片段一致。见图 2。
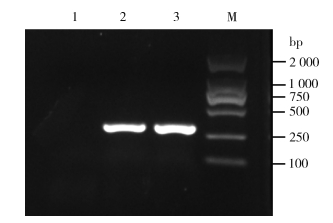
|
| 注:1表示空白对照(ddH2O);2表示辛德毕斯病毒cDNA;3表示基孔肯雅病毒cDNA;M表示DL 2000 DNA Marker。 图 2 半巢式PCR扩增辛德毕斯病毒和基孔肯雅病毒结果 Figure 2 Amplification results of Sindbis virus and Chikungunya virus using RT-hemi-nested PCR |
| |
以质粒标准品为模板,10倍递次稀释后进行半巢式PCR扩增,1.5%琼脂糖凝胶电泳结果见图 3、4。半巢式PCR检测SINV、CHIKV的下限值分别为3×103和3×104拷贝/µl。
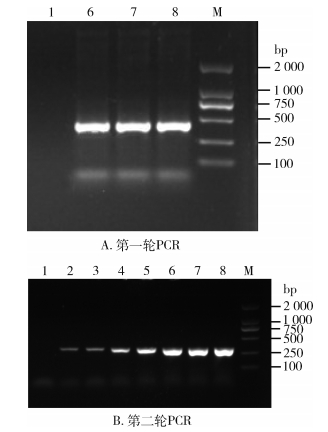
|
| 注:1表示空白对照(ddH2O);2~8表示辛德毕斯病毒模板浓度依次为3×103~3×109拷贝/µl;M表示DL 2000 DNA Marker。 图 3 半巢式PCR检测辛德毕斯病毒敏感性实验结果 Figure 3 Results of sensitivity test of RT-hemi-nested PCR for Sindbis virus |
| |
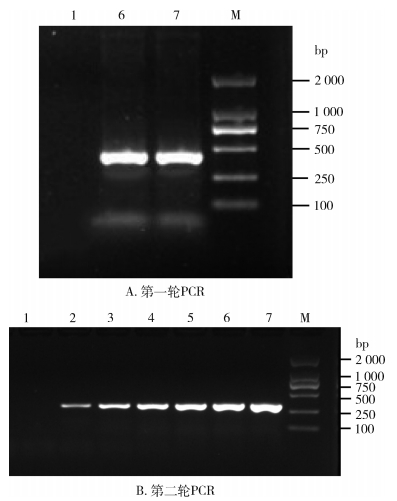
|
| 注:1表示空白对照(ddH2O);2~7表示基孔肯雅病毒模板浓度依次为3×104~3×109拷贝/µl;M表示DL 2000 DNA Marker。 图 4 半巢式PCR检测基孔肯雅病毒敏感性实验结果 Figure 4 Results of sensitivity test of RT-hemi-nested PCR for Chikungunya virus |
| |
应用建立的半巢式PCR反应体系对蚊媒甲病毒属病毒(SINV、CHIKV)、蚊媒甲病毒属病毒与蚊虫cDNA的混合物(SINV+蚊虫cDNA、CHIKV+蚊虫cDNA)及对照组(蚊虫cDNA、JEV、DENVⅡ、YFV、WNV)在相同条件下进行扩增,以检测体系的特异性。结果显示,蚊媒甲病毒属病毒(SINV、CHIKV)及甲病毒属病毒与蚊虫cDNA的混合物(SINV+蚊虫cDNA、CHIKV+蚊虫cDNA)的半巢式PCR扩增片段为310 bp,与预计相符,而对照组均无条带出现。见图 5。
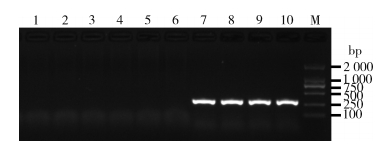
|
| 注:1表示空白对照(ddH2O);2表示流行性乙型脑炎病毒;3表示登革Ⅱ型病毒;4表示黄热病毒;5表示西尼罗病毒;6表示蚊虫cDNA;7表示辛德毕斯病毒;8表示基孔肯雅病毒;9表示辛德毕斯病毒+蚊虫cDNA;10表示基孔肯雅病毒+蚊虫cDNA;M表示DL 2000 DNA Marker。 图 5 半巢式PCR特异性实验结果 Figure 5 Results of specificity tests of RT-hemi-nested PCR |
| |
用建立的甲病毒属病毒半巢式PCR方法检测野外采集的蚊虫样本,将得到的PCR产物用1.5%的琼脂糖凝胶电泳进行检测,均未发现有甲病毒属病毒阳性扩增条带。
3 讨论蚊媒甲病毒属病毒属于披膜病毒科甲病毒属,种类繁多,分布广泛,在全球多个国家发生过人间流行,导致人类疾病,严重者可以导致死亡。目前已发现的甲病毒属病毒有20多种,蚊虫为主要的传播媒介。蚊媒病在全球很多国家均有分布,由于国际间的频繁合作以及我国复杂多样的生态环境,蚊媒病毒的传播风险大大增加,使原来已经得到有效控制的蚊媒病又重新出现并呈现不同程度的流行,对我国的公共卫生安全带来极大挑战[7-9]。目前,在我国大陆人群中已经检测到甲病毒抗体并分离到甲病毒毒株[10]。因此,早期快速的检测该病毒尤为重要。目前,用于甲病毒属病毒的检测方法主要包括细胞分离培养法、血清学检测及分子生物学检测等[11-13]。病毒分离培养法是诊断的金标准,但对实验技术及设备要求高,不能用于早期诊断且敏感性低。血清学检测受病毒之间的交叉反应影响,缺乏特异性。传统的种特异性RT-PCR(reverse transcription-PCR)和qPCR(Real-time fluorescent quantitative PCR)快速灵敏、特异性好,但通常只能检测单种病原体,在蚊媒甲病毒属病毒中较多用于CHIKV、SINV的检测[14-15]。而采用多重RT-PCR和多重实时定量RT-PCR可广谱检测甲病毒属病毒[16-18],多重PCR可以在一个反应体系中同时对多种病毒进行检测,但多重PCR体系中引物设计难度大,容易导致实验失败和假阳性结果。
本研究建立了一种快速准确检测蚊媒甲病毒属病毒的实验方法,使用MEGA 7软件针对基因保守区域设计引物,通过优化实验反应体系,取得了较满意的结果。实验显示,本方法具有较好的特异性,与甲病毒属病毒传播途径类似的黄病毒属病毒未发生交叉反应;灵敏度高,该方法检测SINV、CHIKV的敏感性分别为3×103 和3×104拷贝/µl。Wu等[19]建立了四重实时RT-PCR,该方法对CHIKV的检测下限为11拷贝/µl。方巧云等[20]建立的实时荧光定量PCR方法敏感性达405拷贝/µl。何丽芳等[21]基于SYBR GreenⅠ探针的实时RT-PCR检测SINV的下限为0.1 PFU/ml。因此实时定量RT-PCR方法的灵敏性比半巢式PCR稍高,但实时定量RT-PCR需要专业的仪器设备,成本较高,不适合大规模流行病学调查。本研究建立的半巢式PCR是在RT-PCR的基础上,利用3条引物在保持较好特异性和敏感性的前提下,降低了引物设计难度和成本,继续扩增出比普通PCR更小的目的片段,具有较强的实用价值。XA-F1、XA-F2和XA-R 3条引物都是在比对了多条有代表性的甲病毒属病毒保守区序列后确定的。利用本研究建立的方法对野外采集的蚊虫标本进行检测,结果均未检测到CHIKV和SINV等甲病毒属病毒,其原因可能与采集的蚊虫种类有关,CHIKV和SINV的主要传播媒介为白纹伊蚊和埃及伊蚊(Ae. aegypti),而本研究中所采集的蚊虫以骚扰阿蚊和三带喙库蚊为主。虽然本研究未检测到甲病毒属病毒,但应注意此类病毒在我国潜在流行的风险。
目前CHIKV和SINV等甲病毒属病毒疫苗的研究尚处于实验研究阶段,也无有效的治疗手段,因此有必要加强我国蚊媒病毒及蚊媒病毒病的基础调查,完善蚊媒病的监测体系和检测手段,建立检测蚊媒病毒的新技术新方法,做好蚊媒病的早期防控工作。本研究所建立的方法具有较高的敏感性和特异性,并且可以同时检测多种病毒,可有效用于甲病毒属病毒感染的早期检测。由于蚊媒甲病毒属病毒种类繁多,具有高度的遗传多样性,而本研究中只检测了甲病毒属中的SINV和CHIKV,因此本研究建立的半巢式PCR方法也存在一定的局限性,下一步有必要用其他的黄病毒属毒株和甲病毒属毒株进一步验证引物的扩增效果。由于不同蚊媒病毒的传播媒介不同,因此,野外采集蚊虫标本时,所采集的蚊虫应覆盖不同时间不同地点不同生境不同采集方法所采集的蚊虫,以提高检测的阳性率。
利益冲突 无
| [1] |
Nunes MRT, Palacios G, Nunes KNB, et al. Evaluation of two molecular methods for the detection of Yellow fever virus genome[J]. J Virol Methods, 2011, 174(1/2): 29-34. DOI:10.1016/j.jviromet.2011.02.025 |
| [2] |
Feng Y, Fu SH, Zhang HL, et al. Distribution of mosquitoes and mosquito-borne viruses along the China-Myanmar border in Yunnan province[J]. Jpn J Infect Dis, 2012, 65(3): 215-221. DOI:10.7883/yoken.65.215 |
| [3] |
Kafetzopoulou LE, Efthymiadis K, Lewandowski K, et al. Assessment of metagenomic Nanopore and Illumina sequencing for recovering whole genome sequences of chikungunya and dengue viruses directly from clinical samples[J]. Euro Surveill, 2018, 23(50): 1800228. DOI:10.2807/1560-7917.ES.2018.23.50.1800228 |
| [4] |
Pollett S, Fauver JR, Berry IM, et al. Genomic epidemiology as a public health tool to combat mosquito-borne virus outbreaks[J]. J Infect Dis, 2020, 221(Suppl 3): S308-318. DOI:10.1093/infdis/jiz302 |
| [5] |
王英. 我国蚊媒防制策略及成就和挑战[J]. 中国热带医学, 2019, 19(9): 807-811. Wang Y. Strategies, achievements and challenges of mosquito control in China[J]. China Trop Med, 2019, 19(9): 807-811. DOI:10.13604/j.cnki.46-1064/r.2019.09.01 |
| [6] |
Dahmana H, Mediannikov O. Mosquito-borne diseases emergence/resurgence and how to effectively control it biologically[J]. Pathogens, 2020, 9(4): 310. DOI:10.3390/pathogens9040310 |
| [7] |
Kawashima KD, Suarez LAC, Labayo HKM, et al. Complete genome sequence of Chikungunya virus isolated in the Philippines[J]. Genome Announc, 2014, 2(3): e00336-14. DOI:10.1128/genomeA.00336-14 |
| [8] |
Zhai YG, Wang HY, Sun XH, et al. Complete sequence characterization of isolates of Getah virus (genus Alphavirus, family Togaviridae) from China[J]. J Gen Virol, 2008, 89(Pt 6): 1446-1453. DOI:10.1099/vir.0.83607-0 |
| [9] |
郑茂. 寨卡病毒检测技术的研究进展[J]. 国际检验医学杂志, 2020, 41(12): 1515-1519. Zheng M. Research progress of Zika virus detection technology[J]. Int J Lab Med, 2020, 41(12): 1515-1519. DOI:10.3969/j.issn.1673-4130.2020.12.026 |
| [10] |
宋颂, 付士红, 周兴余, 等. 四川省东南部地区蚊、蠓及相关虫媒病毒调查研究[J]. 中华流行病学杂志, 2018, 39(10): 1381-1386. Song S, Fu SH, Zhou XY, et al. Mosquitoes, midges and related arboviruses in southeast Sichuan province[J]. Chin J Epidemiol, 2018, 39(10): 1381-1386. DOI:10.3760/cma.j.issn.0254-6450.2018.10.017 |
| [11] |
方美玉, 林立辉, 任瑞文. 我国甲病毒的研究进展[J]. 中华流行病学杂志, 2003, 24(11): 1060-1063. Fang MY, Lin LH, Ren RW. Research progress of Alphavirus in China[J]. Chin J Epidemiol, 2003, 24(11): 1060-1063. DOI:10.3760/j.issn:0254-6450.2003.11.026 |
| [12] |
Kumar P, Pok KY, Tan LK, et al. Development and evaluation of baculovirus-expressed Chikungunya virus E1 envelope proteins for serodiagnosis of Chikungunya infection[J]. J Virol Methods, 2014, 206: 67-75. DOI:10.1016/j.jviromet.2014.05.014 |
| [13] |
Shukla J, Khan M, Tiwari M, et al. Development and evaluation of antigen capture ELISA for early clinical diagnosis of Chikungunya[J]. Diagn Microbiol Infect Dis, 2009, 65(2): 142-149. DOI:10.1016/j.diagmicrobio.2009.06.017 |
| [14] |
Mansuy JM, Lhomme S, Cazabat M, et al. Detection of Zika, dengue and Chikungunya viruses using single-reaction multiplex real-time RT-PCR[J]. Diagn Microbiol Infect Dis, 2018, 92(4): 284-287. DOI:10.1016/j.diagmicrobio.2018.06.019 |
| [15] |
Nix WA, Oberste MS, Pallansch MA. Sensitive, seminested PCR amplification of VP1 sequences for direct identification of all enterovirus serotypes from original clinical specimens[J]. J Clin Microbiol, 2006, 44(8): 2698-2704. DOI:10.1128/JCM.00542-06 |
| [16] |
蔡绪禹, 康晓平, 刘洪, 等. 5种脑炎人兽共患病病毒多重RT-PCR检测方法的建立[J]. 中国预防兽医学报, 2011, 33(2): 118-121. Cai XY, Kang XP, Liu H, et al. Establishment of multiplex PCR for the detection of five encephalitis zoonosis viruses[J]. Chin J Prev Vet Med, 2011, 33(2): 118-121. DOI:10.3969/j.issn.1008-0589.2011.02.09 |
| [17] |
Liu SQ, Li X, Deng CL, et al. Development and evaluation of one-step multiplex real-time RT-PCR assay for simultaneous detection of Zika virus and Chikungunya virus[J]. J Med Virol, 2018, 90(3): 389-396. DOI:10.1002/jmv.24970 |
| [18] |
Calvo EP, Sánchez-Quete F, Durán S, et al. Easy and inexpensive molecular detection of dengue, Chikungunya and Zika viruses in febrile patients[J]. Acta Trop, 2016, 163: 32-37. DOI:10.1016/j.actatropica.2016.07.021 |
| [19] |
Wu WH, Wang J, Yu N, et al. Development of multiplex real-time reverse-transcriptase polymerase chain reaction assay for simultaneous detection of Zika, dengue, yellow fever, and Chikungunya viruses in a single tube[J]. J Med Virol, 2018, 90(11): 1681-1686. DOI:10.1002/jmv.25253 |
| [20] |
方巧云, 琚雄飞, 刘特, 等. 实时荧光PCR检测基孔肯雅病毒方法的建立及初步应用[J]. 预防医学情报杂志, 2012, 28(9): 747-750. Fang QY, Ju XF, Liu T, et al. The establishment of real time fluorescent PCR detecting method and preliminary application on pathogenesis of Chikungunya virus[J]. J Prev Med Inf, 2012, 28(9): 747-750. |
| [21] |
何丽芳, 徐丽红, 曹玉玺, 等. 辛德毕斯病毒荧光PCR检测方法的建立[J]. 中华实验和临床病毒学杂志, 2005, 19(4): 347-352. He LF, Xu LH, Cao YX, et al. Detection of Sindbis virus-specific nucleic acid with SYBR GREEN Ι real time PCR assay[J]. Chin J Exp Clin Virol, 2005, 19(4): 347-352. DOI:10.3760/cma.j.issn.1003-9279.2005.04.010 |
 2021, Vol. 32
2021, Vol. 32



