扩展功能
文章信息
- 张雅明, 陈宏宇, 张文佳, 王玥, 于洋, 陈曲
- ZHANG Ya-ming, CHEN Hong-yu, ZHANG Wen-jia, WANG Yue, YU Yang, CHEN Qu
- 德国小蠊在低温胁迫下的转录组研究
- A transcriptome study of Blattella germanica in response to low-temperature stress
- 中国媒介生物学及控制杂志, 2021, 32(1): 34-37
- Chin J Vector Biol & Control, 2021, 32(1): 34-37
- 10.11853/j.issn.1003.8280.2021.01.006
-
文章历史
- 收稿日期: 2020-05-28
2 贵州中医药大学药学院, 贵州 贵阳 550025
2 College of Pharmacy, Guizhou University of Chinese Medicine, Guiyang, Guizhou 550025, China
温度适应能力是决定昆虫生长发育、分布和种群数量的关键因素[1]。不耐低温的昆虫在寒冷环境中无法保持细胞中离子和水的平衡,进而导致细胞死亡、组织损伤,甚至最终致死[2-3]。德国小蠊(Blattella germanica)是较难治理的卫生害虫,能传播多种疾病[4]。既往研究初步揭示了德国小蠊受高温胁迫后的基因表达变化,发现了数百个诱导或抑制表达基因[5]。为了揭示德国小蠊在低温下的适应分子机制,完善温度对虫体基因影响的分子机制,本实验用4 ℃模拟冷应激处理德国小蠊成虫,对虫体造成低温胁迫后采用RNA-Seq转录组学方法分析基因表达变化、基因功能富集和代谢通路,对比讨论了与高温应答分子机制的异同。
1 材料与方法 1.1 试虫饲养与处理德国小蠊试虫为本实验室长期饲养,为低温敏感品系。在25 ℃人工气候箱中饲养,随机选取个体大小相似且雌雄各半的20只成虫置于4 ℃人工气候箱作为低温处理组,2 h后迅速将试虫置于液氮速冻,之后保存在-80 ℃冰箱备用。
1.2 RNA提取与测序TRIzol试剂盒(Invitrogen)用于提取试虫总RNA,RQ1 DNase(Promega)用于去除DNA。SmartSpec Plus Spectrophotometer(BioRad)和1.5%琼脂糖凝胶电泳用于检查总RNA质量和纯度,合格后反转录纯化和扩增cDNA。对PCR产物(150~200 bp)进行高通量测序(Illumina Genome Analyzer Iix)。
1.3 测序数据分析对数据进行筛选,包括去除接头序列、去除5′或3′末端质量值低于20或含N碱基、去除“trim”、去除读序 < 75 bp的序列。HISAT2(v2.0.1)和BLAST程序用于基因组定位和注释,德国小蠊基因组共包含28 774个基因[6]。GO(Gene Ontology Database)和KEGG(Kyoto Encyclopedia of Genes and Genomes)用于基因功能富集和代谢通路分析。用RPKM值(reads per kilobase of exon model per million mapped reads)计算基因表达量[7]。DESeq2(V1.6.3)[8]和edgeR(V3.4.6)[9]软件用于识别差异表达基因(即低温应答基因)。
2 结果 2.1 测序与基因表达分析测序经筛选后,得到44 589 020个读序,平均长度为148.37 bp。读序比对德国小蠊基因组,比对到35 451 640个,约占79.51%,多比对位置占比为5.21%、唯一比对位置占比为74.30%。25 ℃对照组数据仍然采用之前的研究结果,计算RPKM值获得基因相对表达量。表达量差异 > 2倍且错误发现率 < 0.05列为显著差异表达基因。结果获得上调表达基因(即低温诱导表达基因)332个、下调表达基因(即低温抑制表达基因)371个。表 1列举了低温应答程度最大的5个诱导表达非假定基因和5个抑制表达非假定基因。
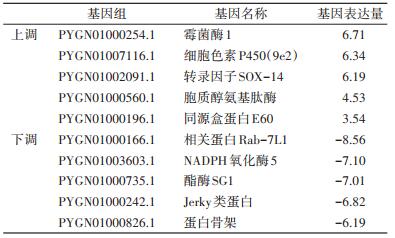
|
利用GO数据库进行功能富集分析,结果德国小蠊低温应答基因可分为27个小类。包括羧酸代谢、胁迫应答反应、碳水化合物代谢、神经递质分泌、碳酸盐脱水酶活性、氧化还原酶活性、裂解酶活性、丙酮酸脱氢酶活性、丙酮酸脱氢酶复合物、水运输、非生物胁迫反应、通道活性、多细胞组织过程、肌膜、质膜、类固醇激素反应、有机物质应答反应、外肽酶、蛋白质代谢、“P-P水解”驱动蛋白跨膜转运蛋白活性、ER靶向蛋白质、水解酶活性、营养储存活性、转移酶活性、金属羧肽酶活性、脂质转运蛋白活性、细胞分裂等,在表 2中列举了部分基因。胁迫应答类中包含2个上调的水通道蛋白tip3-1和热激蛋白70×103同源蛋白4,以及1个下调表达的热激蛋白68。丙酮酸脱氢酶活性类别中包含1个上调的丙酮酸脱氢酶E1成分亚单位β。碳水化合物代谢类别中包含4个上调的苹果酸脱氢酶、假定蛋白(PYGN01001788.1)、β-1和丙酮酸脱氢酶E1成分亚单位β。
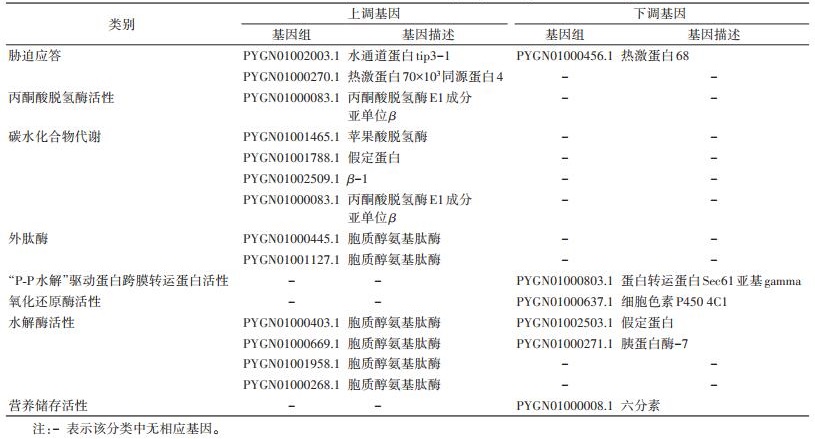
|
利用KEGG数据库进行代谢通路分析,结果共发现植物病原互作、蝇类光转导、脂肪细胞因子信号通路、半胱氨酸和蛋氨酸代谢、弓形虫病、苯丙醇生物合成、胰岛素分泌、缝隙连接、链霉素合成、谷胱甘肽代谢、催乳素信号、病毒性心肌炎、军团菌病、抗原应答、胰高血糖素信号通路、细胞凋亡、组氨酸代谢、寿命调节途径、氰氨酸代谢、甘油酯代谢、糖尿病、癌中心碳代谢、蛋白质消化吸收、甲型流感、半乳糖代谢、干细胞多能性调节信号通路、Ⅱ型糖尿病、新霉素等生物合成、麻疹、噬菌体、铁中毒、Hippo信号通路、淀粉和蔗糖代谢、紧密连接和致病性大肠埃希菌感染等35个代谢通路途径。
3 讨论2016年MacMillan等[2]利用高通量测序识别了果蝇低温应答基因,结果表明低温能诱导649个基因表达,同时抑制918个基因表达。2018年,单艳敏[10]识别了沙葱萤叶甲幼虫低温胁迫应答基因,结果4个低温(-10、-5、0、5 ℃)处理样本中,分别有718、865、1 142和1 474个基因为低温应答基因。本实验中,识别了德国小蠊低温应答上调基因332个和下调基因371个,说明低温使德国小蠊体内的基因表达发生了较强烈的变化,这与其他昆虫类似。利用GO数据库搜索基因数据能用于描述这些基因的功能。果蝇是重要的模式昆虫,研究发现果蝇低温应答上调基因和下调基因可以富集在31个和47个功能分类中[2]。小胸鳖甲的514个低温应答上调表达基因可以分为35个小类别,包括胁迫响应占比为9.10%、生物调节占比为7.10%、免疫系统过程占比5.50%等[10]。沙葱萤叶甲幼虫的4组低温应答基因则主要富集在氧化还原过程、脂质代谢、运输、表皮结构成分、结合、氧化还原酶活性、胞外区和隔膜等功能类别[10]。本实验中,德国小蠊低温应答基因的功能富集主要在羧酸代谢、胁迫应答反应、碳水化合物代谢、神经递质分泌等27个类别,说明德国小蠊可能在这些方面应对低温胁迫。
热激蛋白Hsp68、Hsp70和Hsp90等可作为分子伴侣来保护细胞免受温度变化造成的损伤。这类蛋白在原核生物和真核生物中都有,基因结构上非常保守[11]。本研究结果中,受低温环境影响,有3个热激蛋白Hsp70k类蛋白4、DnaJ蛋白亚家族B13和DnaJ蛋白亚家族C5B上调表达,1个热激蛋白Hsp68下调表达。说明德国小蠊与其他生物类似,可能利用表达生成热激蛋白来保护受损组织或细胞。与低温类似,在德国小蠊受到高温胁迫后,6个热激蛋白Hsp68-1、Hsp68-0、Hsp68-2、Hsp83、HSP90AA1和DnaJ蛋白上调表达。锌指蛋白以其空间结构与DNA分子相互作用进行转录调控,也在抗温度等逆境基因表达调控中起重要作用[12]。德国小蠊受低温影响后,锌指MYND结构域包含蛋白10基因上调表达,锌指蛋白OZF蛋白基因下调表达。在德国小蠊高温应答基因中,有6个锌指蛋白基因发生显著表达变化,说明锌指蛋白参与德国小蠊极端温度的适应调节。细胞色素P450(Cytochrome P450)数量庞大,成为1个基因家族[13]。细胞色素P450是一种解毒代谢酶,能参与有毒化学物的代谢和防御以及合成多种激素。本实验中,细胞色素P450-4C1(PYGN01001150.1)、细胞色素P450-9e2(PYGN01007116.1)和细胞色素P450-9e2(PYGN01007027.1)为低温上调表达基因,细胞色素P450-4C1(PYGN01000637.1)和细胞色素P450-6k1(PYGN01000017.1)为低温下调表达基因。德国小蠊低温应答基因中,包括9个细胞色素P450基因,推测很多细胞色素P450基因参与了德国小蠊在低温环境和高温环境的适应过程。此外,德国小蠊1个水通道蛋白tip3-1、1个丙酮酸脱氢酶E1成分亚单位β基因、1个苹果酸脱氢酶基因和1个转录因子SOX-14受低温诱导上调表达[14],但这些基因未受高温诱导表达,说明德国小蠊低温应答分子机制与高温应答分子机制相比有很多差别。
利益冲突 无
| [1] |
王艳敏, 仵均祥, 万方浩. 昆虫对极端高低温胁迫的响应研究[J]. 环境昆虫学报, 2010, 32(2): 250-255. Wang YM, Wu JX, Wan FH. Response of insects to extreme high and low temperature stresses[J]. J Environ Entomol, 2010, 32(2): 250-255. DOI:10.3969/j.issn.1674-0858.2010.02.018 |
| [2] |
MacMillan HA, Knee JM, Dennis AB, et al. Cold acclimation wholly reorganizes the Drosophila melanogaster transcriptome and metabolome[J]. Sci Rep, 2016, 30(6): 28999. DOI:10.1038/srep28999 |
| [3] |
Moskalev A, Zhikrivetskaya S, Krasnov G, et al. A comparison of the transcriptome of Drosophila melanogaster in response to entomopathogenic fungus, ionizing radiation, starvation and cold shock[J]. BMC Genomics, 2015, 16: S8. DOI:10.1186/1471-2164-16-S13-S8 |
| [4] |
齐欣, 孙耘芹. 德国小蠊生物学特性及综合治理[J]. 中国媒介生物学及控制杂志, 2004, 15(1): 73-75. Qi X, Sun YQ. Biological characteristics and comprehensive control of Blattella germanica[J]. Chin J Vector Biol Control, 2004, 15(1): 73-75. DOI:10.3969/j.issn.1003-4692.2004.01.031 |
| [5] |
陈宏宇, 张雅明, 张文佳, 等. 高温环境对德国小蠊基因表达的影响[J]. 中国媒介生物学及控制杂志, 2020, 31(1): 62-65. Chen HY, Zhang YM, Zhang WJ, et al. Effect of high temperature on gene expression of Blattella germanica[J]. Chin J Vector Biol Control, 2020, 31(1): 62-65. DOI:10.11853/j.issn.1003.8280.2020.01.013 |
| [6] |
Harrison MC, Jongepier E, Robertson HM, et al. Hemimetabolous genomes reveal molecular basis of termite eusociality[J]. Nat Ecol Evol, 2018, 2(3): 557-566. DOI:10.1038/s41559-017-0459-1 |
| [7] |
Mortazavi A, Williams BA, McCue K, et al. Mapping and quantifying mammalian transcriptomes by RNA-Seq[J]. Nat Methods, 2008, 5(7): 621-628. DOI:10.1038/nmeth.1226 |
| [8] |
Love MI, Anders S, Huber W. Differential analysis of count data-the DESeq2 package[J]. Genome Biol, 2014, 15: 550. DOI:10.1186/s13059-014-0550-8 |
| [9] |
Robinson MD, McCarthy DJ, Smyth GK. edgeR:a bioconductor package for differential expression analysis of digital gene expression data[J]. Bioinformatics, 2010, 26(1): 139-140. DOI:10.1093/bioinformatics/btp616 |
| [10] |
单艳敏.沙葱萤叶甲幼虫对温度胁迫响应的转录组学研究[D].呼和浩特: 内蒙古农业大学, 2018. Shan YM. Transcriptomal study on the Galeruca daurica larvae in response to thermal stress[D]. Hohhot: Inner Mongolia Agricultural University, 2018. |
| [11] |
张天浩, 张仙红. 昆虫热激蛋白的研究进展[J]. 山西农业大学学报:自然科学版, 2019, 39(1): 35-40. Zhang TH, Zhang XH. Research progress of heat shock protein in insect[J]. J Shanxi Agric Univ:Nat Sci Ed, 2019, 39(1): 35-40. DOI:10.13842/j.cnki.issn1671-8151.201806017 |
| [12] |
Nekludova L, Pabo CO. Distinctive DNA conformation with enlarged major groove is found in Zn-finger-DNA and other protein-DNA complexes[J]. Proc Natl Acad Sci USA, 1994, 91(15): 6948-6952. DOI:10.1073/pnas.91.15.6948 |
| [13] |
丰婧, 田凯, 侯鑫, 等. 家蝇细胞色素P450还原酶的原核表达与活性鉴定[J]. 中国媒介生物学及控制杂志, 2016, 27(2): 121-123. Feng Q, Tian K, Hou X, et al. Functional expression of NADPH-cytochrome P450 reductase of the house fly (Musca domestica) in Escherichia coli[J]. Chin J Vector Biol Control, 2016, 27(2): 121-123. DOI:10.11853/j.issn.1003.8280.2016.02.007 |
| [14] |
尹小平, 王安东, 田延河, 等. 阿拉山口口岸地区多房棘球蚴线粒体NADH脱氢酶亚基1基因序列分析[J]. 中国媒介生物学及控制杂志, 2016, 27(5): 481-483. Yin XP, Wang AD, Tian YH, et al. Analysis of the mitochondria gene NADH dehydrogenase 1 in Echinococcus multilocularis at Alataw pass, China-Kazakhstan[J]. Chin J Vector Biol Control, 2016, 27(5): 481-483. DOI:10.11853/j.issn.1003.8280.2016.05.015 |
 2021, Vol. 32
2021, Vol. 32


