扩展功能
文章信息
- 张海林
- ZHANG Hai-lin
- 云南省登革热和基孔肯雅热跨境传播、本地流行、发展趋势及对策
- Cross-border spread, indigenous transmission, development trend, and control strategy for dengue fever and chikungunya fever in Yunnan province, China
- 中国媒介生物学及控制杂志, 2021, 32(1): 12-20
- Chin J Vector Biol & Control, 2021, 32(1): 12-20
- 10.11853/j.issn.1003.8280.2021.01.002
-
文章历史
- 收稿日期: 2020-11-01
登革热(dengue fever)和基孔肯雅热(chikungunya fever,CHIKF)同属经伊蚊传播的虫媒病毒病,它们的主要临床表现均为发热、头痛、皮疹、淋巴腺肿大和关节疼痛等,均广泛流行于全球热带和亚热带地区[1-3]。埃及伊蚊(Aedes aegypti)和白纹伊蚊(Ae. albopictus)为主要传播媒介[4]。登革热的病原体为黄病毒科(Flaviviridae)黄病毒属(Flavivirus)登革病毒(Dengue virus,DENV),并分为4种血清型(DENV-1、2、3、4),每种血清型还可分为4~6种基因型。CHIKF的病原体为披膜病毒科(Togaviridae)甲病毒属(Alphavirus)基孔肯雅病毒(Chikungunya virus,CHIKV),该病毒为单一血清型,但可分为3种基因型,即西非型(West Africa genotype)、亚洲型(Asian genotype)和东/中/南非型(East Central and South Africa genotype,ECSA)。近几年,我国几乎所有省(直辖市、自治区)都有登革热病例报告,其中,2019年13个省(直辖市、自治区)有登革热本地流行[5],据专家推测,中国约有10亿人口受到登革热的威胁[6]。与云南省相邻的东南亚和南亚地区这2种蚊媒病毒病流行较为严重,不仅广泛存在4种血清型DENV的流行[7-9],还存在着CHIKV亚洲基因型和ECSA基因型的广泛流行[10-13]。近几年,我国南方一些省、自治区常发生登革热流行[5],2010年广东省和2017年浙江省还分别发生过CHIKF本地流行[14-15]。
云南省位于我国西南边陲,辖16个州(市)129个县(区、市),其中8个州(市)的25个县(市)与缅甸、老挝或越南接壤,边境线长4 060 km(中缅段1 997 km,中老段710 km,中越段1 353 km)。云南省边境地区设国家和省级口岸16个,并有数十个出入境通道,境内外人员和物资交流频繁,登革热和CHIKF均可通过输入性病例或携带病毒的媒介伊蚊跨境传播,对云南省构成威胁。近几年云南省登革热疫情日趋严重,还出现CHIKF流行,本文对云南省这2种蚊媒传染病的流行概况、跨境传播、本地流行和发展趋势进行分析,并对它们的公共卫生重要性进行探讨,提出防控工作建议。
1 云南省登革热流行病学及病原学特征 1.1 流行概况1974年从与越南相邻的云南省红河哈尼族彝族自治州(红河州)河口县白纹伊蚊中分离到DENV-4;1981-1983年从与缅甸、老挝毗邻的西双版纳傣族自治州(西双版纳州)白纹伊蚊中多次分离到DENV-3和DENV-4[16-17];1989年从与缅甸接壤的德宏傣族景颇族自治州(德宏州)盈江县拉邦地区白纹伊蚊中分离到DENV-4[18]。1980年代还从云南省边境地区发热病例、健康人群和动物血清中检测到DENV抗体[16]。这些结果表明,1970和1980年代,云南省局部边境地区曾发生过登革热流行,白纹伊蚊是主要传播媒介,但限于当时条件,未能引起防疫和医疗机构的关注,因而缺乏疫情资料,以致人群发病情况不太清楚。
随着传染病疫情监测的开展和诊断技术的提高,2000-2012年云南省每年都有来自境外的登革热输入性病例[19-22],其中2008年滇西南边境地区发生77例输入性病例,临沧市镇康县南伞镇、德宏州盈江县拉邦镇和芒市芒海镇还发生零星本地感染病例(12例),当地健康人群DENV IgG抗体和IgM抗体阳性率分别为10.95%(81/740)和5.68%(42/740),表明人群中存在既往和新近感染病例[23]。2013年滇西南边境地区暴发登革热本地疫情[24-26],随后每年都发生本地流行[27-33],因此,2013年成为云南省登革热流行史中的一个重要年份,从此,云南省边境地区登革热本地流行成为常态,2013-2019年不仅每年都有疫情发生,而且疫区范围不断扩大(图 1)。此外,2020年7月下旬至10月23日(本文截稿时)德宏州瑞丽市再次发生本病流行(瑞丽市疾病预防控制中心登革热监测资料),西双版纳、临沧、红河和昆明市(州)仅有零星输入病例。2020年中后期我国为防控境外通过陆路输入新型冠状病毒肺炎(新冠肺炎)病例,云南省边境口岸、通道关闭,登革热和CHIKF输入病例也得到控制,登革热本地流行地区和发病数与2019年相比明显减少。
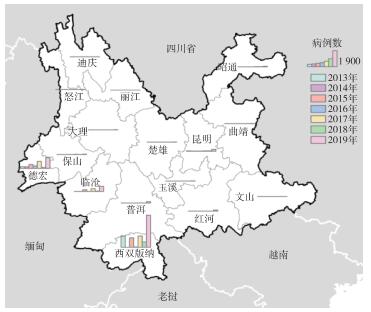
|
| 图 1 2013-2019年云南省登革热地区分布 Figure 1 Regional distribution of dengue fever cases in Yunnan province, China, 2013-2019 |
| |
2013-2019年云南省共发生登革热病例15 572例,全省16个州(市)中有15个州(市)有登革热病例报告(占93.75%),仅迪庆藏族自治州(迪庆州)无本病报告。图 1显示,与缅甸、老挝接壤的西双版纳州(2013、2015-2019年)、与缅甸接壤的德宏州(2013-2019年)和临沧市(2015、2017-2019年)以及与越南接壤的红河州河口县(2019年)均发生输入性病例与本地病例并存的暴发疫情。其中西双版纳州8 477例,包括输入病例568例(6.70%)和本地病例7 909例(93.30%);德宏州4 974例,包括输入病例2 504例(50.34%),本地病例2 470例(49.66%);临沧市1 169例,红河州142例。昆明、曲靖、玉溪、保山、昭通、丽江和普洱市以及楚雄彝族自治州(楚雄州)、大理白族自治州(大理州)、文山壮族自治州(文山州)和怒江傈僳族自治州(怒江州)均为登革热输入性病例,其中以昆明市报告的输入性病例最多(355例),其次为普洱市(163例)和保山市(83例),其他州(市)报告病例数在2~68例之间。云南省129个县(区、市)中有106个县(区、市)(82.17%)有登革热病例报告,23个县(区、市)(17.83%)无本病病例报告。昆明市14个县(区、市)都有输入病例报告,其中主城区的五华、盘龙、官渡和西山区病例占该市总病例数的84.51%(300/355)。云南省大多数边境县都有登革热输入病例报告,以中缅、中老、中越边境的瑞丽、耿马、景洪、勐腊、勐海、河口县(市)最多,是导致这些地区登革热本地流行的主要原因。各地输入病例来源国家:德宏州和临沧市主要为缅甸,西双版纳州主要为缅甸和老挝,红河州为越南,其他州、市除上述国家外还有泰国、柬埔寨等东南亚国家以及印度等南亚国家和非洲国家[24-33]。
1.2.2 时间分布2013-2019年每年云南省都有登革热疫情发生,发病数呈波浪式上升,隔年出现一次高峰,2019年达最高峰(图 2)。本地流行地区也在逐年增多,如2013年仅西双版纳(景洪市和勐腊县)和德宏州(瑞丽市)发生本地流行,2015年临沧市(耿马县)出现本地流行,2019年红河州(河口县)发生本地流行(图 1)。输入病例分布区也在不断扩大,如2013年输入病例主要分布在西双版纳、德宏州和昆明市,随后有输入病例报告的州(市、县)逐年增多,2019年几乎所有州、市和大多数县(区、市)都有输入病例报告。随着输入病例分布区的扩大,本地流行地区也在扩大,如红河州河口县2017年开始出现来自越南的登革热病例,2019年再次出现输入病例并导致本地流行。
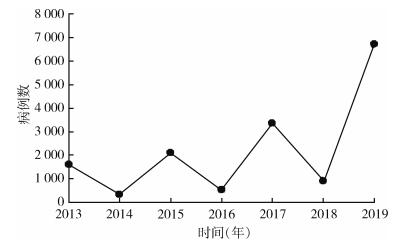
|
| 图 2 2013-2019年云南省登革热年度分布 Figure 2 Annual distribution of dengue fever cases in Yunnan province, China, 2013-2019 |
| |
云南省全年各月都有登革热病例报告,其中1-5月病例较少,6-7月开始逐渐上升,8月明显增多,9和10月为高峰,11月明显下降,12月病例较少(图 3)。一般在12月中、下旬疫情终止。输入病例和本地病例的月份分布存在差异,前者全年每月都有,但7-11月居多;后者流行期仅在6-12月,主要为7-11月,高峰为9-10月,6和12月较少。不同地区或年份的本地流行期、高峰期和终止日期略有差异,但差异约在1个月以内。
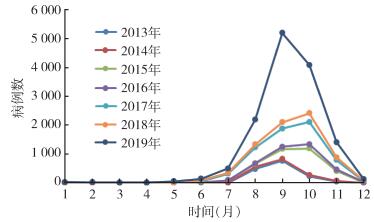
|
| 图 3 2013-2019年云南省登革热季节分布 Figure 3 Seasonal distribution of dengue fever cases in Yunnan province, China, 2013-2019 |
| |
根据德宏和西双版纳州及临沧市登革热病例资料统计,发病年龄最小为5月龄,最大为92岁,以20~54岁为主。病例的性别差异不大,一般为女性稍多于男性。各职业人群均有发病,主要为商业服务者、家务及待业者、农民、学生和离退人员,与工作和生活环境中容易被白天活动的伊蚊叮咬有关;但河口县主要为居住在县城周边的农场橡胶工人,与橡胶园白纹伊蚊密度高有关。
1.3 DENV流行株遗传进化及溯源研究近几年,一些疾病预防控制机构和科研机构在云南省登革热流行区采集患者血清标本进行病毒分离,并开展DENV全基因组序列或包膜蛋白(envelope protein,E)基因序列的进化分析。云南省DENV流行株包括4种血清型,其中每一种血清型有2~3种基因型[28-29, 34-37],具有血清型和基因型多样性特点。溯源研究还发现,云南省几乎所有DENV流行株均与缅甸、老挝或泰国等东南亚流行株具有较高的同源性和较近的亲缘关系,并从输入病例中证实了相邻国家流行株的进化特征[28-29, 34-37]。由此认为,云南省边境地区登革热本地流行的传播来源均为邻国登革热病例的跨境传播,如导致近几年德宏州和临沧市的本地流行株均来自缅甸的输入病例[24, 27, 30, 32];引起西双版纳州的本地流行株来自老挝、缅甸和泰国的输入病例(2013年主要为老挝输入病例[25-26],2015年主要为泰国输入病例[31],2017年为老挝和缅甸输入病例)[33];2019年红河州河口县本地流行与越南输入病例密切相关。此外,其他州(市)每年都有来自东南亚诸国的登革热输入性病例[19-23]。
2 云南省CHIKV流行病学特征 2.1 流行概况1980年代,云南省流行病防治研究所(现云南省地方病防治所)在云南省边境热带和亚热带地区开展虫媒病毒调查和研究,曾从发热病例、健康人群、白纹伊蚊、蝙蝠〔棕果蝠(Rousettus leschenaulti)〕、恒河猴(Macaca mullata)、猪和鸟类等标本中分离到CHIKV或检测到该病毒特异性抗体[16-17, 38-39],表明云南省局部边境地区曾发生过CHIKV流行,因限于当时条件而未能阐明人间发病情况。近几年,东南亚国家CHIKF流行较为严重[10-13],云南省具有引发本地CHIKF流行的风险。2018年云南省首次报告来自东南亚的2例CHIKF输入性病例(航空输入昆明市),2019年7月云南省腾冲市报告1例来自缅甸的CHIKF输入病例[40]。2019年德宏州瑞丽市发生1起输入和本地病例并存的CHIKF流行[41],此为云南省首次报告CHIKF本地暴发疫情。
2.2 2019年CHIKF流行特征2019年9-12月瑞丽市共发生CHIKF确诊病例121例(均为CHIKV核酸检测阳性病例),其中本地病例98例,缅甸输入病例23例(包括木姐11例、南坎6例、曼德勒3例、九谷2例和腊戌1例)[41]。临床上,患者除发热外,关节痛较常见(占90.08%),其次为头痛(44.63%)、皮疹(33.06%),少数病例有出血现象。本地感染病例主要发生在瑞丽市主城区、勐卯镇和姐告开发区。9月上旬出现首例输入病例,至12月每月都有来自缅甸的输入病例;本地流行始于9月下旬,止于11月下旬,高峰为10月(90/121,74.38%)。本次确诊病例中包括2例孕妇及其母婴传播的3例新生儿病例(2例双胞胎男婴和1例女婴均为出生后第4~5天发病,1周后痊愈)。病例年龄分布除母婴传播的这3例新生儿病例外,最小仅为3月龄,最大为72岁,以20~59岁的青壮年为主(94/121,77.69%)。男女性别比为1:1.28。职业分布以商业服务人员(33.06%)、家务及待业人员(21.49%)和离退人员(11.57%)居多[41]。经对本病患者血清标本的病毒分离和序列分析表明,瑞丽市CHIKV流行株均为ECSA基因型,来自缅甸的输入性病例是引起瑞丽市本地流行的主要原因。
3 云南省媒介伊蚊分布特点 3.1 白纹伊蚊1980和1990年代,云南省蚊类调查结果表明,白纹伊蚊在云南省广泛分布,尤其在边境热带亚热带地区属白天活动蚊虫群落中的优势蚊种[17, 42],构成比和密度均较高并与人居关系密切,近10多年的调查依然如此[19, 43-44]。
3.2 埃及伊蚊新中国建立以来,云南省开展了大量的蚊虫调查工作,但截止2001年云南省境内无埃及伊蚊记载。2002年首次在瑞丽市姐告口岸地区废旧轮胎积水中采集到埃及伊蚊幼蚊,随后,每年该地均能捕获埃及伊蚊幼蚊和成蚊。目前,埃及伊蚊已扩散至瑞丽市主城区、勐卯镇、姐告开发区、畹町和弄岛镇,并以主城区分布广、密度高。继瑞丽市发现埃及伊蚊之后,德宏州芒市(芒海和遮放镇)、陇川(章风镇)和盈江县(拉邦镇)等局部边境地区也发现该蚊;2009和2011年分别在西双版纳州勐腊县关累港和景洪市景洪港发现该蚊;2013和2015年景洪市登革热流行期间该蚊在景洪市主城区(允景洪镇)和嘎洒镇的构成比明显高于白纹伊蚊;勐腊县主城区埃及伊蚊分布也较广,勐海县打洛镇也有该蚊分布。2014年首次在临沧市耿马县孟定镇发现埃及伊蚊。目前,埃及伊蚊分布区包括德宏州(瑞丽市、芒市、盈江和陇川县)、西双版纳州(景洪市、勐腊和勐海县)、临沧市(耿马县)和怒江州(泸水县)[19, 43-44]。综合分析认为,云南省的埃及伊蚊为本世纪初从东南亚输入的蚊种,其入侵方式为陆路(如瑞丽市和耿马县的口岸地区)和水路(澜沧江关累港和景洪港),然后沿着边境地区快速扩散,其分布区域与云南省本地登革热流行区相一致,如瑞丽和景洪市的主城区埃及伊蚊为优势蚊种,构成比明显高于白纹伊蚊。这些结果提示,埃及伊蚊为近几年云南省中缅和中老边境地区登革热的主要传播媒介。
4 登革热和CHIKF疫情发展趋势 4.1 自然环境适于伊蚊传播病毒病的流行全球气候变暖、生态环境改变导致媒介蚊虫大量繁殖及其分布区不断扩大,这些都有利于DENV和CHIKV的生存、增殖和扩散并引起疾病暴发或大流行,如2014年广州市登革热暴发与环境改变尤其是城市表面水体分布区明显增多适于白纹伊蚊孳生密切相关[45]。近10多年来,非洲、美洲、亚洲以及印度洋、太平洋岛屿的登革热和CHIKF流行区不断扩大[1-3],甚至欧洲(法国和意大利)局部地区也因白纹伊蚊入侵而出现登革热和CHIKF流行[46]。此外,随着生态环境的改变,宿主媒介的变化,虫媒病毒对媒介蚊虫的敏感性及对人的致病性也会发生变异[10]。总之,从当前全球疫情形势看,无论登革热或CHIKF的流行均无减缓趋势,它们的发病数仍在上升,流行区还在继续扩大,尤其是与云南省相邻的南亚和东南亚地区不仅流行不断,并常常出现大规模流行。由于东南亚地区的蚊虫控制受到自然和社会因素双重影响,灭蚊防蚊困难重重,以致疫情越演越烈,每年都给云南省边境地区的防控工作带来较大压力。云南省边境地区自然环境与东南亚地区较为相似,大多属热带亚热带气候,气温高、雨量多、湿度大,适于媒介伊蚊的孳生繁殖,加之埃及伊蚊的入侵和快速扩散以及伊蚊城市化分布特点及其密度增高等都是引发这2种蚊媒病毒病不断流行的主要原因。
4.2 跨境传播是本地登革热和CHIKF流行不断发生的重要原因近几年航空旅行的不断增多促进了多种血清型DENV在亚洲的共同循环,也包括中国以及东南亚国家间的该病毒传播[47]。同样,CHIKV不同基因型在全球的传播扩散也与航空旅行有关,如我国近几年航空输入CHIKF病例越来越多并引发本地流行[14-15]。然而,云南省虽常有国际航空旅行输入的登革热和CHIKF病例,但更为突出的威胁是传染源或传播媒介经陆路边境的跨境传播。云南省边境线长而复杂,管理难度大,每年都有大量的输入病例(入境时有的可能处于隐性感染期,有的已发病)通过陆路边境口岸或各种通道进入云南省并引发本地流行。还可能存在携带病毒的伊蚊跨境传播,如近几年作为登革热和CHIKF疫区的缅甸木姐、九谷、南坎等城市及其乡村均紧邻我国瑞丽市(如姐告、畹町和弄岛等),两国间山水、田园、村寨相连,伊蚊成蚊包括带病毒伊蚊极易飞越边境进入我国栖息、叮咬吸血。还有陆路交通工具和澜沧江船舶也有可能将境外携带病毒伊蚊输入我国,如本世纪初期埃及伊蚊在云南省口岸地区(瑞丽口岸、勐腊关累港、景洪港)的发现均与来自境外的交通工具有关。
4.3 病毒对媒介蚊虫的适应性增强有利于疫情传播扩散虫媒病毒在不同宿主和媒介中传播扩散可能使其易感性和致病性得到增强,如2004年东非暴发CHIKF大流行并引起2005-2006年在印度洋岛屿的不断扩散,进而导致南亚和东南亚地区本病广泛流行,研究认为白纹伊蚊在上述地区CHIKV传播扩散中发挥了重要作用,因该病毒在印度洋地区流行期间对白纹伊蚊的适应性和复制能力得到明显增强[10]。从目前看,云南省登革热和CHIKF主要流行于埃及伊蚊分布地区,但无埃及伊蚊分布的白纹伊蚊分布区同样具有引发这2种蚊媒病毒的传播风险,需要高度关注。如云南省不仅存在对白纹伊蚊高度易感的4个血清型DENV的辗转流行,还存在印度洋大流行传播到东南亚的CHIKV的ECSA基因型流行,白纹伊蚊对该基因型同样具有较高的易感性[10]。
4.4 地方性流行的危险因素在上升东南亚地区属于登革热地方性流行区,1950年代以来,该地区一直存在4种血清型DENV的传播以及重症登革热的流行,属该地区发病率和病死率都较高的虫媒传染病[1]。重症登革热与多种血清型DENV的反复流行以及再次或多次感染所致的抗体依赖增强(antibody dependent enhancement,ADE)有关,也可能与病毒株毒力增强如DENV-2感染以及宿主遗传多态性等有关[48]。流行病学和病毒溯源研究表明,近几年云南省登革热本地流行仍属输入性病例引起的本地流行,但随着疫情的不断发展,形成地方性流行或者说自然疫源性的可能性较大。至今,云南省登革热已连续流行8年(2013-2020年),并发生过DENV-1、2、3、4的流行[34-37],其中德宏州瑞丽市和西双版纳州景洪市、勐腊县几乎每年都发生2种或3种血清型DENV流行[27-29, 33],瑞丽市2016年还发生4种血清型DENV共同流行[32]。鉴于近几年瑞丽、景洪、勐腊、耿马县(市)存在多种血清型DENV反复流行,很有可能发生重型病例的流行。
5 当前需要解决的科学问题 5.1 病毒溯源及疫源调查登革热和CHIKF均为自然疫源性疾病。为掌握云南省边境地区自然界中这2种病毒分布状况,很有必要从各地患者、不同季节伊蚊中分离病毒。除主要采集自然界雌性成蚊外,还可采集一些幼蚊及雄性成蚊做病毒分离(因伊蚊具有经卵传递DENV和CHIKV的能力[17, 49])。对不同来源分离株进行全基因组序列测定与遗传进化和溯源研究,以阐明该地区DENV和CHIKV的自然循环特点及其是否存在自然疫源地。
5.2 人群自然感染率调查掌握人群隐性感染状况和抗体水平,对预测疾病发展趋势有重要意义。在近几年登革热流行地区如瑞丽、耿马、景洪、勐腊、勐海和河口县(市)采集当地常住居民血清(包括曾患过登革热者),用中和试验检测DENV中和抗体,了解人群中各血清型抗体阳性率及其抗体滴度水平,为评估登革热流行趋势提供科学依据,还可为将来该地区使用DENV疫苗可能性的评估提供本底资料。同时在瑞丽市及其他部分边境县人群中开展CHIKV抗体调查,掌握不同地区人群自然感染率,作出CHIKF流行风险评估。
5.3 临床学研究与东南亚地区不同,近几年云南省流行的登革热为古典型登革热,属于自限性疾病,预后较好,无死亡病例,虽有少数DENV-2感染的重症病例但均能治愈[50]。今后应加强重症病例的全面临床学观察以及病毒分离、血清型、基因型和抗体水平研究,掌握他们的临床特征。据此制定行之有效的监测和防治研究方案以及具体控制策略并做好重症预警,为该地区有效控制本病、减少危害提供政策和技术支持。在登革热流行地区亦需加强CHIKF的监测和临床学研究,尤其要做好二者的鉴别诊断,避免将CHIKF病例误诊为登革热。
5.4 伊蚊监测及其抗药性研究蚊媒监测是搞好蚊媒传染病防控的基础。掌握各地埃及伊蚊和白纹伊蚊的分布特点及密度,对分析本地区登革热和CHIKF传播风险、疫情预测及防控均具重要价值。同样,经常或适时开展主要媒介蚊种的抗药性监测,为及时使用有效药物灭蚊和控制疫情提供科学依据。
5.5 蚊虫媒介效能评价埃及伊蚊和白纹伊蚊是公认的登革热和CHIKF的主要传播媒介,它们对DENV和CHIKV的媒介效能较高,但随着蚊种种群数量、分布环境的变化及病毒变异等,媒介作用也会有所变化。因此,开展这2种蚊虫及其不同地理株系对各型DENV和CHIKV的易感性、传播性研究,评估它们的媒介意义,对更好地防控这2种蚊媒疾病具有重要意义。
6 亟待加强的防控工作2015年全球首个DENV疫苗研制成功,并在部分国家使用[51],但仍然存在ADE风险而未能广泛应用,我国未使用该疫苗。目前,尚无可供使用的CHIKF疫苗[52]。因此,传染源管理和蚊媒控制仍然是登革热和CHIKF最重要的防控措施。近几年云南省这2种疾病的暴发疫情均与来自邻国的跨境传播及媒介伊蚊密度高密切相关,这是当前需要高度关注和切实解决的重要公共卫生问题。近几年,虽然云南省各地都采取了强有力的防控措施,如网格化管理灭蚊防蚊等取得一定成效[53],但输入病例的早期发现、早隔离及清除蚊媒孳生地等问题的解决并非易事,防控形势依然严峻,我们必须树立与这些疾病做长期斗争的思想。由于登革热与CHIKF具有相似的流行病学特征、媒介蚊种和临床表现,可采取相同防控措施,同步开展监测和防控工作。
6.1 清除蚊虫孳生地是防止发生上述2种疾病本地流行的关键措施云南省边境地区适于蚊虫常年孳生繁殖,开展经常性的防蚊灭蚊是预防或迅速控制疫情的关键措施。全年对各类工作场所、居住区室内外及其周围环境的一切积水容器进行清理,其中5-11月为清除蚊虫孳生地的重点时期。以此作为基层单位、社区、村寨以及市民、村民的日常活动,并继续以网格化管理予以监督、落实。如发生本地疫情,控制成蚊应采取清除蚊虫孳生地和化学防治相结合的方法。
6.2 早期发现病例是控制疫情扩散的重要措施蚊媒疾病控制成本较高,早期发现输入性病例或本地感染病例,及时对患者实施防蚊隔离是防止本地流行或进一步扩散极为重要的措施。在入境人员或当地居民中,凡具有相关流行病学史和发热等临床表现者,均应尽快进行实验室检测,做到早发现、早诊断、早隔离。
6.3 加强入境检疫是预防传染源跨境传播的重点措施东南亚地区全年都有登革热和CHIKF流行,云南省一年四季都有来自东南亚国家的输入性病例,这些病例大多为来我国就医的缅甸、老挝边民,中缅、中老、中越双方商务及务工人员,旅游者以及边境两侧边民探亲访友人员。因此,全年开展入境人员登革热和CHIKF检疫是防止传染源跨境传播的重要措施,尤其要做好那些入境就医的病例或疑似病例的监测和管理,从他们入境之时就要做好全程防蚊隔离。值得注意的是,有些人员在境外已被蚊虫叮咬感染,但入境时处在疾病潜伏期,此类人员具有重要流行病学意义,除加强入境检疫还需做好防疫宣传,提高他们的防病意识,一旦不适,及时就医。
6.4 加强交通工具检疫是防止携带病毒的蚊虫跨境传播的必要措施各口岸入境的汽车、轮船等交通工具可将境外蚊虫(成蚊、幼蚊、卵)输入我国,还可能将携带病毒的蚊虫输入我国并引起疾病流行。因此,交通工具的检疫和消毒杀虫对防止跨境传播同样重要。
6.5 加强与邻国联防联控今后应进一步加强中缅、中老、中越的国家间边境地区登革热和CHIKF等传染病的联防联控工作,尤其是双方边境地区疫情监测、信息交流和媒介伊蚊控制以及输入性病例的出入境检疫、管理等。
综上所述,2013-2020年云南省已连续8年发生登革热本地流行,2019年还发生CHIKF本地流行,来自相邻国家的输入性病例是引起本地疫情的主要原因,本地流行几乎都发生在人口集中、有埃及伊蚊分布、蚊密度高的边境城市及其近郊,提示与埃及伊蚊媒介效能高有关。然而,2019年河口县(为白纹伊蚊分布区,无埃及伊蚊)本地登革热流行表明,在橡胶树林中的白纹伊蚊分布广、密度高,对其媒介作用同样应给予高度关注。鉴于云南省边境地区仍然存在登革热和CHIKF再次流行或大流行的风险(其他地区同样也具有本地流行的风险),还有可能形成地方性流行区,需高度警惕。今后,各地仍需继续强化政府主导、全民参与的防控理念,特别要加强早期诊断与及时防控,全年开展常态化防范跨境传播和防蚊灭蚊为主的综合防控工作,并进一步加强中缅、中老和中越双方边境地区蚊媒传染病联防联控工作。
志谢 云南省疾病预防控制中心(CDC)及登革热本地流行的州、市、县CDC提供2013-2019年登革热疫情资料,特此志谢利益冲突 无
| [1] |
Gubler DJ. Dengue, urbanization and globalization:the unholy trinity of the 21(st) century[J]. Trop Med Health, 2011, 39(4 Suppl): 3-11. DOI:10.2149/tmh.2011-S05 |
| [2] |
Furuya-Kanamori L, Liang S, Milinovich G, et al. Co-distribution and co-infection of chikungunya and dengue viruses[J]. BMC Infect Dis, 2016, 16: 84. DOI:10.1186/s12879-016-1417-2 |
| [3] |
李杨, 张文宏. 全球登革热疫情态势、疫情警报[J]. 中华传染病杂志, 2019, 37(10): 619-621. Li Y, Zhang WH. Epidemic situation and alert of global dengue fever[J]. Chin J Infect Dis, 2019, 37(10): 619-621. DOI:10.3760/cma.J.issn.1000-6680.2019.10.008 |
| [4] |
Kraemer MU, Sinka ME, Duda KA, et al. The global distribution of the arbovirus vectors Aedes aegypti and Ae. albopictus[J]. eLife, 2015, 4: e08347. DOI:10.7554/eLife.08347.001 |
| [5] |
刘起勇. 我国登革热流行新趋势、防控挑战及策略分析[J]. 中国媒介生物学及控制杂志, 2020, 31(1): 1-6. Liu QY. Dengue fever in China:new epidemical trend, challenges and strategies for prevention and control[J]. Chin J Vector Biol Control, 2020, 31(1): 1-6. DOI:10.11853/j.issn.1003.8280.2020.01.001 |
| [6] |
Castro MC, Wilson ME, Bloom DE. Disease and economic burdens of dengue[J]. Lancet Infect Dis, 2017, 17(3): e70-78. DOI:10.1016/S1473-3099(16)30545-X |
| [7] |
Wang BH, Liang YB, Yang ST, et al. Co-circulation of 4 dengue virus serotypes among travelers entering China from Myanmar, 2017[J]. Emerg Infect Dis, 2018, 24(9): 1756-1758. DOI:10.3201/eid2409.180252 |
| [8] |
Thu HM, Lowry K, Myint TT, et al. Myanmar dengue outbreak associated with displacement of serotypes 2, 3, and 4 by dengue 1[J]. Emerg Infect Dis, 2004, 10(4): 593-597. DOI:10.3201/eid1004.030216 |
| [9] |
Thant KZ, Tun MMN, del Carmen Parquet M, et al. Molecular epidemiology of dengue viruses co-circulating in upper Myanmar in 2006[J]. Trop Med Health, 2015, 43(1): 21-27. DOI:10.2149/tmh.2014-27 |
| [10] |
Powers AM. Genomic evolution and phenotypic distinctions of Chikungunya viruses causing the Indian Ocean outbreak[J]. Exp Biol Med, 2011, 236(8): 909-914. DOI:10.1258/ebm.2011.011078 |
| [11] |
Tun MMN, Thant KZ, Inoue S, et al. Detection of East/Central/South African genotype of Chikungunya virus in Myanmar, 2010[J]. Emerg Infect Dis, 2014, 20(8): 1378-1381. DOI:10.3201/eid2008.131431 |
| [12] |
Duong V, Andries AC, Ngan C, et al. Reemergence of Chikungunya virus in Cambodia[J]. Emerg Infect Dis, 2012, 18(12): 2066-2069. DOI:10.3201/eid1812.120471 |
| [13] |
Rahman M, Yamagishi J, Rahim R, et al. East/Central/South African genotype in a Chikungunya outbreak, Dhaka, Bangladesh, 2017[J]. Emerg Infect Dis, 2019, 25(2): 370-372. DOI:10.3201/eid2502.180188 |
| [14] |
Wu D, Wu J, Zhang QL, et al. Chikungunya outbreak in Guangdong province, China, 2010[J]. Emerg Infect Dis, 2012, 18(3): 493-495. DOI:10.3201/eid1803.110034 |
| [15] |
Pan JH, Fang CF, Yan JY, et al. Chikungunya fever outbreak, Zhejiang province, China, 2017[J]. Emerg Infect Dis, 2019, 25(8): 1589-1591. DOI:10.3201/eid2508.181212 |
| [16] |
张海林, 陶三菊, 张云智. 云南省澜沧江下游地区虫媒病毒研究状况[J]. 中华实验和临床病毒学杂志, 2006, 20(1): 95-98. Zhang HL, Tao SJ, Zhang YZ. Research situation of arboviruses in Lancang river dowan-stream area in Yunnan province[J]. Chin J Exp Clin Virol, 2006, 20(1): 95-98. DOI:10.3760/cma.j.issn.1003-9279.2006.01.027 |
| [17] |
张海林, 自登云, 米竹青, 等. 云南省白纹伊蚊分布特点及与虫媒病毒的关系[J]. 中国媒介生物学及控制杂志, 2001, 12(2): 103-105. Zhang HL, Zi DY, Mi ZQ, et al. Characterized distribution of Aedes albopictus and their relation with arbovirus in Yunnan province[J]. Chin J Vector Biol Control, 2001, 12(2): 103-105. DOI:10.3969/j.issn.1003-4692.2001.02.007 |
| [18] |
王静林, 张海林, 孙肖红, 等. 云南登革4型病毒的鉴定及NS1和NS2a基因序列分析[J]. 中国人兽共患病学报, 2008, 24(7): 636-640. Wang JL, Zhang HL, Sun XH, et al. Identification and sequence analysis of NS1 and NS2a of two strains of dengue type-4 virus from mosquitoes in Yunnan province[J]. Chin J Zoonoses, 2008, 24(7): 636-640. DOI:10.3969/j.issn.1002-2694.2008.07.010 |
| [19] |
卫生部国际合作司, 云南省卫生厅, 云南省寄生虫病防治所.云南边境登革热防治手册[M].昆明: 云南科技出版社, 2011: 1-81. Bureau of International Cooperation, Health Department of the People's Republic of China, Health Department of Yunnan Province, and Yunnan Provincial Institute for Parasitic Diseases. Mannual for dengue fever control in Yunnan border areas[M]. Kunming: Yunnan Science and Technology Press, 2011: 1-81. |
| [20] |
张海林, 付士红, 邓掌, 等. 云南中缅边境一起输入性登革热暴发的分子流行病学研究[J]. 中华流行病学杂志, 2013, 34(5): 428-432. Zhang HL, Fu SH, Deng Z, et al. An outbreak of imported dengue fever from Myanmar to the border of China, with its viral molecular epidemiological features[J]. Chin J Epidemiol, 2013, 34(5): 428-432. DOI:10.3760/cma.j.issn.0254-6450.2013.05.004 |
| [21] |
杨卫红, 黄瑛, 冯云, 等. 昆明市登革热输入性病例的调查及C/PreM基因序列分析[J]. 国际病毒学杂志, 2015, 22(1): 11-16. Yang WH, Huang Y, Feng Y, et al. Investigation on dengue fever imported cases of Kunming city, Yunnan province in China and sequence analysis of C/PreM gene of dengue virus[J]. Int J Virol, 2015, 22(1): 11-16. DOI:10.3760/cma.j.issn.1673-4092.2015.01.003 |
| [22] |
姜进勇, 郭晓芳, 唐烨榕, 等. 云南省2004-2014年输入性登革热病例监测与防控对策分析[J]. 中国媒介生物学及控制杂志, 2016, 27(1): 5-8. Jiang JY, Guo XF, Tang YR, et al. Surveillance and control of imported dengue cases in Yunnan from 2004 to 2014[J]. Chin J Vector Biol Control, 2016, 27(1): 5-8. DOI:10.11853/j.issn.1003.4692.2016.01.002 |
| [23] |
郭晓芳, 吴超, 王丕玉, 等. 云南西部边境地区健康人群登革热血清学调查[J]. 中国人兽共患病学报, 2010, 26(5): 502-504, 507. Guo XF, Wu C, Wang PY, et al. Serological investigation of dengue in western Yunnan[J]. Chin J Zoonoses, 2010, 26(5): 502-504, 507. DOI:10.3969/j.issn.1002-2694.2010.05.025 |
| [24] |
冯云, 刘永华, 尹正留, 等. 云南省瑞丽市2013年登革热暴发的分子流行病学研究[J]. 中国病毒病杂志, 2014, 4(4): 306-311. Feng Y, Liu YH, Yin ZL, et al. Molecular epidemiologic analysis of an outbreak of dengue fever in 2013 at Ruili city, Yunnan province of China[J]. Chin J Viral Dis, 2014, 4(4): 306-311. |
| [25] |
冯云, 范建华, 朱进, 等. 云南省景洪市2013年登革热暴发的分子流行病学研究[J]. 中华流行病学杂志, 2014, 35(12): 1409-1411. Feng Y, Fan JH, Zhu J, et al. Molecular epidemiology of an outbreak of dengue fever in Jinghong city, Yunnan province, China, 2013[J]. Chin J Epidemiol, 2014, 35(12): 1409-1411. DOI:10.3760/cma.j.issn.0254-6450.2014.12.022 |
| [26] |
Guo XF, Yang HL, Wu C, et al. Molecular characterization and viral origin of the first dengue outbreak in Xishuangbanna, Yunnan province, China, 2013[J]. Am J Trop Med Hyg, 2015, 93(2): 390-393. DOI:10.4269/ajtmh.14-0044 |
| [27] |
刘永华, 冯云, 尹小雄, 等. 2014年云南省瑞丽市登革1和2型病毒流行的分子流行病学研究[J]. 疾病监测, 2016, 31(1): 8-13. Liu YH, Feng Y, Yin XX, et al. Molecular epidemiology of dengue virus types 1 and 2 in Ruili, Yunnan, 2014[J]. Dis Surveill, 2016, 31(1): 8-13. DOI:10.3784/j.issn.1003-9961.2016.01.004 |
| [28] |
Hu TS, Zhang HL, Feng Y, et al. Epidemiological and molecular characteristics of emergent dengue virus in Yunnan province near the China-Myanmar-Laos border, 2013-2015[J]. BMC Infect Dis, 2017, 17: 331. DOI:10.1186/s12879-017-2401-1 |
| [29] |
冯云, 张海林, 潘虹, 等. 云南省登革病毒血清型和基因型多样性及溯源研究[J]. 中华实验和临床病毒学杂志, 2017, 31(1): 24-30. Feng Y, Zhang HL, Pan H, et al. Diversity of serotypes and genotypes and molecular tracing of dengue viruses isolated from dengue fever cases in Yunnan[J]. Chin J Exp Clin Virol, 2017, 31(1): 24-30. DOI:10.3760/cma.j.issn.1003-9279.2017.01.005 |
| [30] |
李华昌, 潘虹, 冯云, 等. 2015年云南省临沧市登革热暴发的流行病学调查[J]. 疾病监测, 2016, 31(7): 561-565. Li HC, Pan H, Feng Y, et al. Epidemiological survey of an outbreak of dengue fever in Lincang, Yunnan, 2015[J]. Dis Surveill, 2016, 31(7): 561-565. DOI:10.3784/j.issn.1003-9961.2016.07.007 |
| [31] |
李园园, 冯云, 范建华, 等. 2015年云南省西双版纳州登革2型病毒暴发疫情的调查研究[J]. 中华实验和临床病毒学杂志, 2016, 30(4): 340-345. Li YY, Feng Y, Fan JH, et al. Investigation on an outbreak of dengue serotype 2 virus in Xishuangbanna prefecture of Yunnan province in 2015[J]. Chin J Exp Clin Virol, 2016, 30(4): 340-345. DOI:10.3760/cma.j.issn.1003-9279.2016.04.002 |
| [32] |
胡挺松, 刘永华, 张海林, 等. 云南省瑞丽市2016年登革病毒包膜蛋白基因进化特征分析[J]. 病毒学报, 2017, 33(6): 854-860. Hu TS, Liu YH, Zhang HL, et al. Phylogenetic analyses of the envelope protein genome of four serotypes of the dengue virus in Ruili city of Yunnan province, China in 2016[J]. Chin J Virol, 2017, 33(6): 854-860. |
| [33] |
范建华, 冯云, 朱进, 等. 2017年云南省西双版纳州登革1型病毒暴发疫情的调查研究[J]. 疾病监测, 2019, 34(5): 427-434. Fan JH, Feng Y, Zhu J, et al. An outbreak of dengue serotype 1 virus in Xishuangbanna prefecture of Yunnan province, China, 2017[J]. Dis Surveill, 2019, 34(5): 427-434. DOI:10.3784/j.issn.1003-9961.2019.05.013 |
| [34] |
胡挺松, 张海林, 刘永华, 等. 云南中缅边境登革1型病毒全基因组序列特征研究[J]. 中国人兽共患病学报, 2017, 33(6): 473-480. Hu TS, Zhang HL, Liu YH, et al. Molecular characteristics of the full-length genome of dengue serotype 1 virus strains isolated from dengue fever cases in Sino-Myanmar border region in Yunnan province, China[J]. Chin J Zoonoses, 2017, 33(6): 473-480. DOI:10.3969/j.issn.1002-2694.2017.06.001 |
| [35] |
胡挺松, 张海林, 范建华, 等. 云南省西南边境登革2型病毒全基因组序列特征研究[J]. 寄生虫与医学昆虫学报, 2017, 24(2): 109-117. Hu TS, Zhang HL, Fan JH, et al. Molecular characteristics of the full-length genome of dengue serotype 2 virus strains isolated from dengue fever cases in southwestern border region of Yunnan province, China[J]. Acta Parasitol Med Entomol Sin, 2017, 24(2): 109-117. DOI:10.3969/j.issn.1005-0507.2017.02.007 |
| [36] |
胡挺松, 张海林, 刘永华, 等. 云南省登革3型病毒全基因组序列特征研究[J]. 病毒学报, 2018, 34(1): 30-39. Hu TS, Zhang HL, Liu YH, et al. Molecular characteristics of the full-length genome of the dengue serotype 3 virus strains isolated from dengue fever cases in Yunnan province, China[J]. Chin J Virol, 2018, 34(1): 30-39. |
| [37] |
胡挺松, 张海林, 刘永华, 等. 云南省登革4型病毒全基因组序列特征研究[J]. 中国人兽共患病学报, 2017, 33(10): 859-867, 881. Hu TS, Zhang HL, Liu YH, et al. Molecular characteristics of the full-length genome of dengue serotype 4 virus strains isolated from dengue fever cases in Yunnan province, China[J]. Chin J Zoonoses, 2017, 33(10): 859-867, 881. DOI:10.3969/j.issn.1002-2694.2017.10.002 |
| [38] |
张海林, 施华芳, 米竹青, 等. 云南省基孔肯雅病流行病学调查[J]. 中华实验和临床病毒学杂志, 1994, 8(2): 161-162. Zhang HL, Shi HF, Mi ZQ, et al. Epidemiology investigation of Chikungunya in Yunnan province[J]. Chin J Exp Clin Virol, 1994, 8(2): 161-162. |
| [39] |
张海林, 施华芳, 刘丽华, 等. 从云南省蝙蝠中分离基孔肯雅病毒及血清抗体调查[J]. 病毒学报, 1989, 5(1): 31-36. Zhang HL, Shi HF, Liu LH, et al. Isolation of Chikungunya virus from bat in Yunnan province and serological investigations[J]. Chin J Virol, 1989, 5(1): 31-36. |
| [40] |
李希尚, 郭超, 康显虎, 等. 云南省腾冲市首例输入性基孔肯雅热病例的调查处置[J]. 中国热带医学, 2020, 20(1): 84-86. Li XS, Guo C, Kang XH, et al. Investigation and response of the first imported Chikungunya fever case in Tengchong, Yunnan[J]. Chin Trop Med, 2020, 20(1): 84-86. DOI:10.13604/j.cnki.46-1064/r.2020.01.20 |
| [41] |
尹小雄, 刘永华, 张海林, 等. 2019年云南中缅边境基孔肯雅热暴发疫情的流行病学特征[J]. 中华实验和临床病毒学杂志, 2020, 34(6): 600-604. Yin XX, Liu YH, Zhang HL, et al. An outbreak of Chikungunya fever in Yunnan province near the China-Myanmar border in 2019[J]. Chin J Exp Clin Virol, 2020, 34(6): 600-604. DOI:10.3760/cma.j.cn112866-20200609-00185 |
| [42] |
张云智, 张海林, 龚正达, 等. 云南边境地区蚊虫群落及地理生态位研究[J]. 中国媒介生物学及控制杂志, 2001, 12(1): 28-31. Zhang YZ, Zhang HL, Gong ZD, et al. Study on the mosquito communities and the geographical niche of border area in Yunnan province[J]. Chin J Vector Biol Control, 2001, 12(1): 28-31. DOI:10.3969/j.issn.1003-4692.2001.01.011 |
| [43] |
郑宇婷, 杨明东, 周克梅. 云南省边境地区2016年登革热媒介监测结果分析[J]. 中国媒介生物学及控制杂志, 2018, 29(2): 157-160. Zheng YT, Yang MD, Zhou KM. Analysis on the surveillance results of dengue fever vectors in border areas of Yunnan province, 2016[J]. Chin J Vector Biol Control, 2018, 29(2): 157-160. DOI:10.11853/j.issn.1003.8280.2018.02.010 |
| [44] |
杨明东, 姜进勇, 郑宇婷, 等. 云南省边境地区埃及伊蚊分布调查[J]. 中国媒介生物学及控制杂志, 2015, 26(4): 406-408. Yang MD, Jiang JY, Zheng YT, et al. Distribution survey on Aedes aegypti in the border areas of Yunnan province, China[J]. Chin J Vector Biol Control, 2015, 26(4): 406-408. DOI:10.11853/j.issn.1003.4692.2015.04.020 |
| [45] |
Tian HY, Huang SQ, Zhou S, et al. Surface water areas significantly impacted 2014 dengue outbreaks in Guangzhou, China[J]. Environ Res, 2016, 150: 299-305. DOI:10.1016/j.envres.2016.05.039 |
| [46] |
Riccardo F, Venturi G, Di Luca M, et al. Secondary autochthonous outbreak of Chikungunya, Southern Italy, 2017[J]. Emerg Infect Dis, 2019, 25(11): 2093-2095. DOI:10.3201/eid2511.180949 |
| [47] |
Tian HY, Sun Z, Faria NR, et al. Increasing airline travel may facilitate co-circulation of multiple dengue virus serotypes in Asia[J]. PLoS Negl Trop Dis, 2017, 11(8): e0005694. DOI:10.1371/journal.pntd.0005694 |
| [48] |
洪文昕, 张复春. 登革热防治研究进展[J]. 中华传染病杂志, 2019, 37(10): 635-640. Hong WX, Zhang FC. Research progress on dengue fever control[J]. Chin J Infect Dis, 2019, 37(10): 635-640. DOI:10.3760/cma.j.issn.1000-6680.2019.10.015 |
| [49] |
Bonilauri P, Bellini R, Calzolari M, et al. Chikungunya virus in Aedes albopictus, Italy[J]. Emerg Infect Dis, 2008, 14(5): 852-854. DOI:10.3201/eid1405.071144 |
| [50] |
崔新国, 李丽华, 周红宁, 等. 西双版纳傣族自治州登革病毒2型109例临床特征分析[J]. 中华传染病杂志, 2016, 34(12): 705-707. Cui XG, Li LH, Zhou HN, et al. Clinical characteristics of 109 dengue virus type 2 infected cases in Xishuangbanna[J]. Chin J Infect Dis, 2016, 34(12): 705-707. DOI:10.3760/cma.J.issn.1000-6680.2016.12.001 |
| [51] |
Wilder-Smith A, Vannice KS, Hombach J, et al. Population perspectives and World Health Organization recommendations for CYD-TDV dengue vaccine[J]. J Infect Dis, 2016, 214(12): 1796-1799. DOI:10.1093/infdis/jiw341 |
| [52] |
赵志敏, 谭文杰. 基孔肯雅病毒感染及疫苗研发最新进展[J]. 中华微生物学和免疫学杂志, 2020, 40(6): 470-476. Zhao ZM, Tan WJ. Recent progress in vaccine development against Chikungunya virus infection[J]. Chin J Microbiol Immunol, 2020, 40(6): 470-476. DOI:10.3760/cma.j.cn112309-20191012-00325 |
| [53] |
唐烨榕, 姜进勇, 杜龙飞, 等. 云南省景洪市城区登革热网格化管理效果评价[J]. 中国媒介生物学及控制杂志, 2020, 31(3): 254-258, 267. Tang YR, Jiang JY, Du LF, et al. Effectiveness evaluation of the gridding management of dengue fever in the urban area of Jinghong, Yunnan province, China[J]. Chin J Vector Biol Control, 2020, 31(3): 254-258, 267. DOI:10.11853/j.issn.1003.8280.2020.03.002 |
 2021, Vol. 32
2021, Vol. 32

