扩展功能
文章信息
- 张爱萍, 马丽, 谢辉, 杨旭欣, 薛红梅, 赵志军, 李积权, 于守鸿, 赵忠智, 徐立青
- ZHANG Ai-ping, MA Li, XIE Hui, YANG Xu-xin, XUE Hong-mei, ZHAO Zhi-jun, LI Ji-quan, YU Shou-hong, ZHAO Zhong-zhi, XU Li-qing
- SYBR GreenⅠ荧光定量PCR在布鲁氏菌快速检测中的应用研究
- Application of SYBR GreenⅠfluorescence quantitative PCR in the rapid detection of Brucella
- 中国媒介生物学及控制杂志, 2020, 31(6): 695-698
- Chin J Vector Biol & Control, 2020, 31(6): 695-698
- 10.11853/j.issn.1003.8280.2020.06.014
-
文章历史
- 收稿日期: 2020-06-19
布鲁氏菌病(布病)是由布鲁氏菌引起的一种以感染家畜为主的人畜共患-变态反应性疾病,是《中华人民共和国传染病防治法》规定的乙类传染病。人和动物普遍易感,人感染后多转为难以治愈的慢性疾病,动物感染后造成流产、死胎、不孕等,布病已经严重危害家畜及人类的健康,近年来布病在我国的流行范围还在不断扩大,布病的防治迫在眉睫[1]。布病的快速诊断对于布病的早发现,早治疗,以及布病大样本的筛查都具有重要的意义,然而传统布病的诊断以病原分离和血清学检验为主,无论是病原分离还是血清学检验,其特异性和敏感性都不高,容易造成漏诊[2-3],而且费时费力,与布病的快速诊断、大样本筛查及布病早发现的防治要求都相差甚远。SYBR GreenⅠ荧光定量PCR(SYBR GreenⅠfluorescence quantitative PCR)技术已经广泛应用于各种病毒及细菌的检测[4-6],研究表明SYBR GreenⅠ荧光定量PCR的特异性强,灵敏度高,无需专门设计探针,操作简单、耗时短、试剂价格便宜,能够快速鉴别布鲁氏菌,可为布病的快速诊断提供一种新方法。
1 材料与方法 1.1 材料 1.1.1 仪器恒温金属浴购自艾卡(广州)仪器设备有限公司,水平电泳仪DYCP-32C购自中国六一生物科技有限公司,超纯水仪SMART-N购自力新仪器(上海)有限公司,荧光定量PCR仪Lightcycler96购自瑞士罗氏公司,凝胶成像分析系统GeIDCCXR+IR+lmager购自美国伯乐公司,恒温混匀仪ThermoMixer C、生物安全高速离心机Eppendorf购自德国艾本德股份公司。
1.1.2 试剂噬菌体的裂解试验(TB/BK2)试剂由中国疾病预防控制中心传染病预防控制所布病室提供,2×ChamQ universal SYBR qPCR Master mix试剂盒由甘肃金博研生物科技有限公司提供,Ezup柱式细菌基因组DNA抽提试剂盒、5×TBE、灭菌去离子水、纯水、琼脂糖均由生工生物工程(上海)股份有限公司提供。
1.1.3 耗材2 ml离心管、各量程枪头、封口膜。
1.2 方法 1.2.1 样本来源收集10名布病患者全血10份,其中慢性期患者全血8份,急性期患者全血2份。患者有发热、多汗、乏力、肌肉和关节疼痛等明显的布病临床表现,其中2例是病程在3个月以内的急性期患者。10名布病患者均知情并签署知情同意书。采集某牧场羊全血12份。
1.2.2 分离培养将22份全血注入双向培养瓶中,置于37 ℃培养箱中培养。选取单个疑似布鲁氏菌菌落接种于布氏琼脂平板上,37 ℃培养18~24 h,取培养物制备模板,同时进行涂片镜检、噬菌体裂解试验。
1.2.3 对照菌株的选择选择鼠疫菌弱毒株EV76作为阴性对照菌株,选择布鲁氏菌疫苗株104M、M5作为阳性对照菌株。
1.2.4 模板制备将分离自人和动物全血的疑似布鲁氏菌培养24~48 h后,选取适量菌放入加有灭菌去离子水的2 ml离心管,研磨制成菌悬液,离心,弃上清液,利用Ezup柱式细菌基因组DNA抽提试剂盒按流程提取基因组DNA。取模板总量的1/10做无菌实验,无菌实验结果阴性后方可拿出实验室用于其他实验。同时制备其他菌株的模板并同时做无菌实验,方法同上。将提取的核酸进行10、20和50倍稀释后作为新模板进行荧光定量PCR反应。
1.2.5 反应体系及反应条件 1.2.5.1 引物序列本实验选用布鲁氏菌特异性基因BCSP31设计引物B4/B5,引物序列B4:5'-ATCCTATTGCCCCGATAAGG -3',B5:5'-GCTTCGC ATTTTCACTGTAGC -3',产物长度223 bp。
1.2.5.2 反应体系及条件20 μl体系,2×ChamQ universal SYBR qPCR Master mix 10 μl,正、反向引物B4/B5各1 μl,模板1 μl,DH2O 7 μl。反应条件:预变性:95 ℃ 30 s,三步扩增:95 ℃ 10 s;60 ℃ 60 s;72 ℃ 15 s,40个循环,熔解曲线:95 ℃ 30 s。
1.3 结果判定噬菌体裂解试验结果判定严格按照国家布病诊断标准进行判断(WS269-2007和GB/T 18646-2002)。SYBR Green Ⅰ荧光定量PCR试验结果判定:当样品扩增达到阈值的循环数(Ct)介于18~30之间,在熔解曲线中观察到特异性的吸收峰,可判定SYBR Green Ⅰ荧光定量PCR的结果为阳性。
2 结果 2.1 细菌分离培养共分离出4株疑似布鲁氏菌,编号为1~4号,镜下观察,4株菌的形态及染色特征为革兰阴性小杆菌,培养特性与布鲁氏菌相同。
2.2 噬菌体裂解试验结果1、2、3号菌株噬菌体裂解试验BK2裂解,Tb不裂解,确定为羊种布鲁氏菌,4号噬菌体裂解试验阴性。
2.3 SYBR GreenⅠ荧光定量PCR试验结果除4号待测菌株和阴性对照株EV76外,布鲁氏菌疫苗株104、M5,待测菌株1、2、3号均出现特异性扩增曲线,Ct值在18~21之间,熔解曲线波峰趋于一致,产物DNA双链解链50%的温度(Tm)约为88 ℃。见图 1~4。
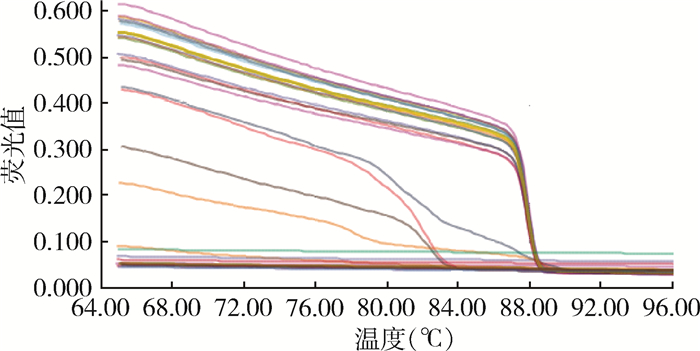
|
| 图 1 SYBR Green Ⅰ荧光定量PCR扩增曲线 Figure 1 Amplification curves of SYBR Green I fluorescence quantitative PCR |
| |
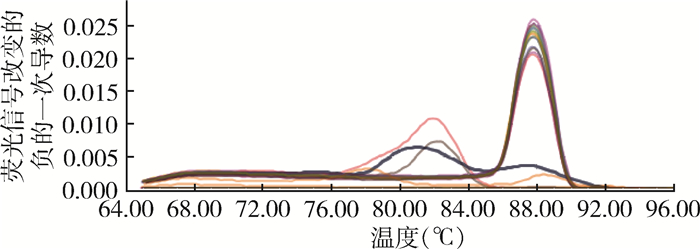
|
| 图 2 SYBR Green Ⅰ荧光定量PCR熔解曲线 Figure 2 Melting curves of SYBR Green I fluorescence quantitative PCR |
| |

|
| 图 3 1号待测菌株模板10倍稀释后SYBR Green Ⅰ荧光定量PCR熔解曲线 Figure 3 SYBR Green I fluorescence quantitative PCR melting curve of the template of No. 1 strain to be detected with 10-fold dilution |
| |
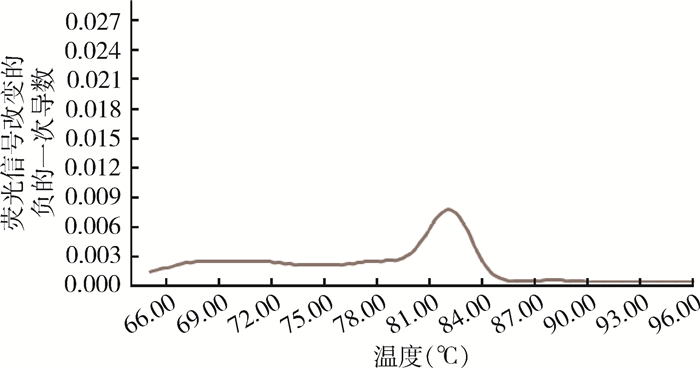
|
| 图 4 4号待测菌株模板10倍稀释后SYBR GreenⅠ荧光定量PCR熔解曲线 Figure 4 SYBR Green I fluorescence quantitative PCR melting curve of the template of No. 4 strain to be detected with 10-fold dilution |
| |
传统布鲁氏菌的鉴别首先要从全血或者动物脏器组织分离出疑似布鲁氏菌,然后进行染色镜检及噬菌体裂解试验,才能确定是否为布鲁氏菌。镜下确定布鲁氏菌,难度很大,即使是经验丰富的专业技术人员也难以辨认。布鲁氏菌的种型复杂多样,噬菌体裂解试验虽然能够确认布鲁氏菌的种属,但整个试验过程至少需要5~6 d的时间,耗时耗力,而且实验过程中产生的气溶胶可能会增加操作人员感染布病的风险。
本实验以分离自人和动物全血的疑似布鲁氏菌为样本,选取布鲁氏菌特异性的目的基因BCSP31合成引物B4/B5,利用SYBR Green Ⅰ荧光定量PCR技术在属的水平上快速鉴别布鲁氏菌,无需进行染色及噬菌体裂解试验,缩短了实验时间,减少了操作人员感染布病的风险。从实验结果看,阳性对照菌株M5、104M,1、2、3号待测菌株均出现特异性的熔解曲线,阴性对照菌株EV76、4号待测菌株未出现特异性的熔解曲线,说明除4号待测菌株外,其他3株待测菌株是布鲁氏菌。而将模板10、20和50倍稀释后,实验结果不变,说明该实验重复性很好。
荧光定量PCR是在普通PCR的基础上发展起来的一种定性检测布病的新方法,近年来发展迅速,尤其TaqMan探针荧光定量PCR的应用很广泛[7-11],而有关SYBR Green Ⅰ荧光定量PCR技术应用于布鲁氏菌的鉴别或者布病诊断方面的文献很少。与普通PCR相比,荧光定量PCR无需电泳、无需在凝胶成像仪上分析实验结果,而扩增效率是普通PCR的100倍[12]。与TaqMan探针荧光定量PCR相比,TaqMan探针荧光定量PCR的特异度高达100%[13]。而SYBR GreenⅠ荧光定量PCR的特异度达95.4%,灵敏度可达91.9%[14]。SYBR GreenⅠ荧光定量PCR的特异性虽不及TaqMan探针荧光定量PCR,但其无需设计探针,操作简单,试剂便宜,所以SYBR GreenⅠ荧光定量PCR在大样本快速检测布鲁氏菌方面比TaqMan探针荧光定量PCR更有优势,而且用SYBR GreenⅠ荧光定量PCR在属的水平上诊断布病,在布病早期诊断上具有重要意义[15]。SYBR GreenⅠ荧光定量PCR 1次最多可检测几百份样本,而且耗时短,2 h就可以出结果。该方法无需染色和镜检,减少了人员感染布病的风险,提高了鉴别布鲁氏菌的特异度和灵敏度,为布鲁氏菌的快速鉴定提供了一种新方法。
综上,SYBR GreenⅠ荧光定量PCR技术检测布鲁氏菌用时短,特异性强,实验的可重复性好,在布鲁氏菌的快速鉴别中具有较好的推广应用前景。
| [1] |
崔步云. 中国布鲁氏菌病疫情监测与控制[J]. 疾病监测, 2007, 22(10): 649-651. Cui BY. Epidemic surveilance and control of brucellosis in China[J]. Dis Surveill, 2007, 22(10): 649-651. DOI:10.3784/j.issn.1003-9961.2007.10.001 |
| [2] |
姚馨月, 郑文艳. 布鲁氏菌病PCR检测的临床意义[J]. 内蒙古医学杂志, 2016, 48(2): 189-192. Yao XY, Zheng WY. Clinical significance of PCR detection of brucellosis[J]. Inner Mongolia Med J, 2016, 48(2): 189-192. DOI:10.16096/J.cnki.nmgyxzz.2016.48.02.021 |
| [3] |
葛丽萍, 张崇志. 布病的流行现状及防治进展[J]. 当代畜禽养殖业, 2019(6): 5-8. Ge LP, Zhang CZ. Epidemic situation and control progress of brucellosis[J]. Mod Animal Husband, 2019(6): 5-8. DOI:10.14070/j.cnki.15-1150.2019.06.001 |
| [4] |
Chen J, Zhao ZJ, Chen YJ, et al. Development and application of a SYBR Green real-time PCR for detection of the emerging avian leukosis virus subgroup K[J]. Poultry Sci, 2018, 97(7): 2568-2574. DOI:10.3382/ps/pey086 |
| [5] |
何维娜, 吕东月, 刘和录, 等. 乙型肝炎病毒SYBR Green Ⅰ实时荧光定量PCR方法的建立及临床应用[J]. 现代检验医学杂志, 2016, 31(3): 104-107. He WN, Lyu DY, Liu HL, et al. Establishment and application of SYBR Green I real-time PCR assay for rapid detection of hepatitis B virus DNA[J]. Chin J Lab Med, 2016, 31(3): 104-107. DOI:10.3969/j.issn.1671-7414.2016.03.027 |
| [6] |
张玲, 翟俊辉, 周冬生, 等. 荧光定量PCR快速检测鼠疫耶尔森氏菌的实验研究[J]. 中国人兽共患病杂志, 2005, 21(3): 206-209. Zhang L, Zhai JH, Zhou DS, et al. Rapid detection of Yersinia pestis with real-time PCR assay[J]. Chin J Zoonoses, 2005, 21(3): 206-209. DOI:10.3969/J.ISSN.1002-2694.2005.03.004 |
| [7] |
李向阳, 霍晓伟, 武迎红, 等. 布鲁氏菌荧光定量PCR检测分析[J]. 基因组学与应用生物学, 2016, 35(10): 2730-2732. Li XY, Huo XW, Wu YH, et al. Detection and analysis of Brucella by fluorescence quantitative PCR[J]. Genom Appl Biol, 2016, 35(10): 2730-2732. DOI:10.13417/j.gab.035.002730 |
| [8] |
刘丽娅, 陆桂丽, 王杰, 等. 布鲁氏菌种荧光定量PCR快速检测方法的建立[J]. 中国动物检疫, 2017, 34(10): 65-71. Liu LY, Lu GL, Wang J, et al. Establishment on rapid detection method for quantitative PCR of Brucella strains[J]. China Animal Health Inspect, 2017, 34(10): 65-71. DOI:10.3969/j.issn.1005-944X.2017.10.019 |
| [9] |
郝俊伟, 张云, 杨宇航, 等. 鹿布鲁氏菌实时荧光定量PCR检测方法的建立[J]. 中国动物检疫, 2014, 11(2): 71-76. Hao JW, Zhang Y, Yang YH, et al. Establishment of a real-time fuorescent quantitative PCR assay for detection of Brucella of deer[J]. China Animal Health Inspect, 2014, 11(2): 71-76. DOI:10.3969/j.issn.1005-944X.2014.02.022 |
| [10] |
张利, 崔步云, 莫内. 荧光定量PCR方法应用于布鲁杆菌检测研究概述[J]. 中国地方病学杂志, 2012, 31(5): 347-350. Zhang L, Cui BY, Mo N. Overview of fluorescence quantitative PCR applied to detection of Brucella[J]. Chin J Endemiol, 2012, 31(5): 347-350. DOI:10.3760/cma.j.issn.1000-4955.2012.03.034 |
| [11] |
Gwida M, El-Ashker M, Melzer F, et al. Use of serology and real time PCR to control an outbreak of bovine brucellosis at a dairy cattle farm in the Nile Delta region, Egypt[J]. Ir Vet J, 2016, 69: 3. DOI:10.1186/s13620-016-0062-9 |
| [12] |
高正琴, 邢进, 冯预芳, 等. TaqMan MGB探针实时荧光定量PCR快速检测布鲁氏菌[J]. 中国人兽共患病学报, 2012, 27(11): 995-1000. Gao ZQ, Xing J, Feng YF, et al. Rapid detection of Brucella by TaqMan MGB-probe real-time fluorescence quantitative PCR assay[J]. Chin J Zoonoses, 2012, 27(11): 995-1000. DOI:10.3969/j.issn.1002-2694.2011.11.011 |
| [13] |
李向阳, 霍晓伟, 武迎红, 等. 布鲁氏菌荧光定量PCR检测分析[J]. 基因组学与应用生物学, 2016, 35(10): 2730-2732. Li XY, Huo XW, Wu YH, et al. Study on quantitative PCR detection of Brucella[J]. Genom Appl Biol, 2016, 35(10): 2730-2732. DOI:10.13417/j.gab.035.002730 |
| [14] |
Queipo-Ortuño MI, Colmenero JD, Reguera JM, et al. Rapid diagnosis of human brucellosis by SYBR Green I-based real-time PCR assay and melting curve analysis in serum samples[J]. Clin Microbiol Infect, 2005, 9(11): 713-718. DOI:10.1111/j.1469-0691.2005.01202.x |
| [15] |
Kattar MM, Zalloua PA, Araj GF, et al. Development and evaluation of real-time polymerase chain reaction assays on whole blood and paraffin-embeded tissues for rapid diagnosis of human brucellosis[J]. Diagn Microbiol Infect Dis, 2007, 59(1): 23-32. DOI:10.1016/j.diagmicrobio.2007.04.002 |
 2020, Vol. 31
2020, Vol. 31


