扩展功能
文章信息
- 姚丹丹, 姜洪雪, 隋晶晶, 冯志勇
- YAO Dan-dan, JIANG Hong-xue, SUI Jing-jing, FENG Zhi-yong
- 抗凝血杀鼠剂选择压力下黄毛鼠抗药性相关解毒酶的研究
- A study on detoxifying enzymes related to the resistance of Rattus losea to anticoagulant rodenticides under its selective pressure
- 中国媒介生物学及控制杂志, 2020, 31(6): 657-661
- Chin J Vector Biol & Control, 2020, 31(6): 657-661
- 10.11853/j.issn.1003.8280.2020.06.006
-
文章历史
- 收稿日期: 2020-07-08
鼠类的抗药性可分为行为抗性、生理抗性和遗传抗性。行为抗性是害鼠对药物食入量不足而不能呈现预期效果,并非严格意义上的抗性[1];遗传抗性的产生通常是由基因突变引起的[2-3];生理抗性也叫代谢抗性,其化学本质是杀鼠剂代谢活性的增强,归因于代谢相关酶在数量或质量上的改变。生物体对药剂的代谢抗性与羧酸酯酶(carboxylesterases,CarEs)、细胞色素P450酶系(cytochrome P450,Cyt-P450)和谷胱甘肽S-转移酶(glutathione S-transferase,GSTs)这3大类超基因家族密切相关[4]。Cyt-P450是主要存在于肝细胞内微粒体内质网膜上的氧化酶系,它是一个多酶复合体,主要由细胞色素P450(cytochrome P450,CYP450)、细胞色素b5(cytochrome b5,Cytb5)和NADPH-细胞色素P450还原酶(NADPH-cytochrome P450 reductase,CPR)组成,它们共同组成电子传递体系[5]。Cyt-P450是生物体内脂肪酸、生物碱、激素等内源化合物以及药物、植物毒素、杀虫剂、杀鼠药剂等外源性化合物的重要代谢系统,CYP450在其中起着中心作用[6]。Cytb5为Cyt-P450的组成部分之一,是一个具有多种重要生理功能的低自旋金属蛋白,作为呼吸链系统的主要电子传递体,Cytb5与CYP450紧密结合形成1:1的蛋白质复合物,诱导CYP450自旋状态由低到高的改变,并增加其与底物的亲和力,从而增加其代谢活性[7]。NAD(P)H醌氧化还原酶1〔NAD(P)H:quinone oxidoreductase 1,NQO1〕是真核细胞内普遍存在的一类黄素蛋白酶,它专性催化细胞内双电子还原反应,能够保护细胞不被自然界中的醌类等生物异源性物质所损伤。NQO1在哺乳动物的各个器官均有表达,以肝脏含量最为丰富[8]。
黄毛鼠(Rattus losea)是广东省重要的农业有害生物和病媒生物,占农田害鼠总数的40%~70%,可造成各种农作物减产10%~30%,局部的粮油作物甚至失收[9]。广东省从20世纪80年代开始大规模灭鼠,特别是珠江三角洲地区,每年灭鼠3~4次,由于抗凝血杀鼠剂的长期大量使用以及不科学的灭鼠方法,致使黄毛鼠对第一代抗凝血剂如杀鼠醚、敌鼠钠盐等普遍产生了抗药性[10],严重影响了治理效果。目前已针对该鼠的敏感基线、抗药性检测方法、抗药性发生动态和抗性机制等开展了较多的研究[11-14],但在抗药性解毒酶的研究方面仍是空白。本研究分别检测黄毛鼠血清和肝脏中抗药性相关解毒酶(CYP450、NQO1、Cytb5)的含量和活性,并进行不同类群间的比对分析,进一步分析这种差异和抗药性水平的相互关系,为阐明黄毛鼠抗药性的作用机制奠定基础。
1 材料与方法 1.1 材料黄毛鼠于2018年12月捕自广东省江门市野外农田,带回室内单笼饲养适应1周以上,选择健康、非孕、亚成年以上的试鼠供试。CYP450、NQO1和Cytb5的含量和活性测定试剂盒购自广州春畅生物技术开发有限公司。
1.2 方法 1.2.1 黄毛鼠血清和肝脏样品的采集每只试鼠称重、鉴定性别、编号,采用致死期食毒法(LFP)进行抗药性检测[10],将抗药性检测过程中出血症状明显、活动迟缓、濒临死亡的试鼠视为敏感鼠,处死后断头取血,室温静置一段时间后3 000 r/min(离心半径13.5 cm)离心20 min。收集上清液保存于-20 ℃冰箱备用,同时解剖取肝脏组织1 g以上,保存于-80 ℃冰箱备用;按同样方法采集抗药性检测后存活鼠的血清和肝脏,试验过程中共获得6只敏感鼠和10只抗药性鼠,分别采集了12份敏感鼠样品和20份抗药性鼠样品。
1.2.2 黄毛鼠血清和肝脏中抗药性相关解毒酶的含量和活性测定从冰箱取出肝脏样品,称量约1 g肝脏组织,加入9 ml磷酸盐缓冲液(PBS),同时加入液氮进行研磨,5 000 r/min(离心半径13.5 cm)离心15 min,取上清液按照试剂盒说明书的操作步骤进行操作,血清样品经解冻后直接按照试剂盒的使用说明进行操作,采用酶标仪测定血清和肝脏中抗药性相关酶的含量和活性,分析比较敏感和抗药性鼠酶的含量和活性差异。
1.3 统计学分析试验数据采用Excel 2007、SPSS 19.0软件进行处理和分析,采用独立样本t检验进行不同类群间黄毛鼠抗药性相关酶的含量和活性比较,P<0.05为差异有统计学意义。
2 结果 2.1 不同类群黄毛鼠CYP450的含量和活性测定敏感黄毛鼠血清和肝脏中CYP450的含量分别为(226.31±7.22)和(300.20±13.76) pmol/L,抗药性黄毛鼠血清和肝脏中CYP450的含量分别为(230.24±5.33)和(288.88±7.47) pmol/L,经检验,敏感与抗药性鼠血清和肝脏中CYP450的含量差异无统计学意义(t1=-0.437,P1=0.671;t2=0.723,P2=0.491)。见图 1。
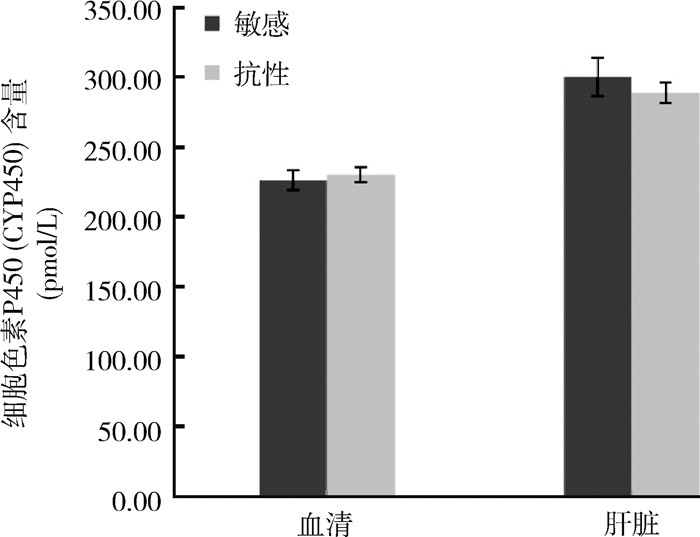
|
| 图 1 广东省江门市黄毛鼠细胞色素P450含量的测定结果 Figure 1 Test results of cytochrome P450 content in Rattus losea in Jiangmen, Guangdong province |
| |
在CYP450的活性方面,敏感黄毛鼠血清和肝脏中分别为(24.71±0.87)和(33.36±1.52) IU/L,抗药性黄毛鼠血清和肝脏中CYP450的活性分别为(24.57±0.78)和(32.24±0.48) IU/L,经检验,敏感和抗药性鼠血清及肝脏中CYP450的活性差异均无统计学意义(t1=0.122,P1=0.905;t2=0.699,P2=0.511)。见图 2。
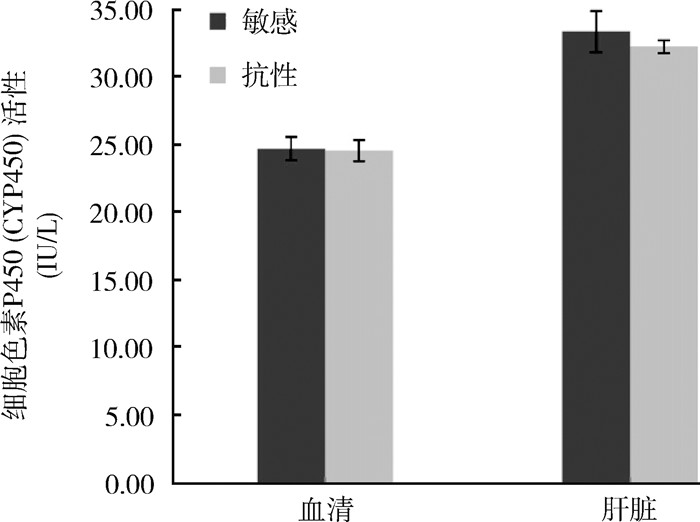
|
| 图 2 广东省江门市黄毛鼠细胞色素P450活性的测定结果 Figure 2 Test results of cytochrome P450 activity in Rattus losea in Jiangmen, Guangdong province |
| |
敏感黄毛鼠血清和肝脏中NQO1的含量分别为(81.13±2.56)和(107.06±3.09) ng/L,抗药性黄毛鼠血清和肝脏中NQO1的含量分别为(84.41±3.03)和(97.84±2.26) ng/L,经检验,敏感和抗药性黄毛鼠血清中NQO1的含量差异无统计学意义(t=-0.826,P=0.428),而肝脏中NQO1的含量差异有统计学意义(t=2.408,P=0.037)。见图 3。
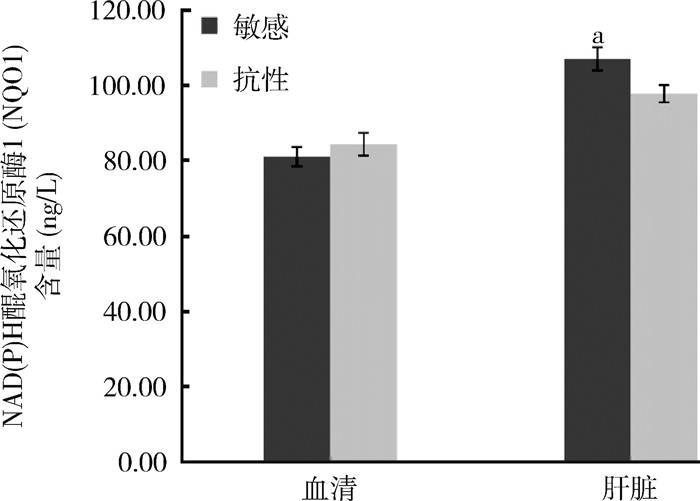
|
| 注:a. t=2.408, P=0.037。 图 3 广东省江门市黄毛鼠NAD(P)H醒氧化还原酶1含量的测定结果 Figure 3 Test results of NAD(P)H quinone oxidoreductase 1 content in Rattus losea in Jiangmen, Guangdongprovince |
| |
在NQO1的活性方面,敏感黄毛鼠血清和肝脏中NQO1的活性分别为(261.34±10.01)和(364.02±8.54) mIU/L,抗药性黄毛鼠血清和肝脏中NQO1的活性分别为(279.12±10.30)和(335.69±7.35) mIU/L,经检验,敏感和抗药性黄毛鼠血清中NQO1的活性差异无统计学意义(t=-1.238,P=0.244),而肝脏中NQO1的活性差异有统计学意义(t=2.515,P=0.031)。见图 4。
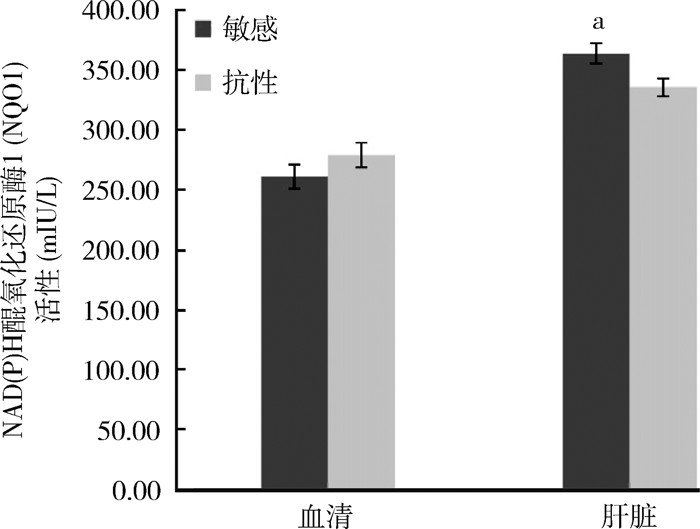
|
| 注:a.t=2.515, P=0.031。 图 4 广东省江门市黄毛鼠NAD(P)H醒氧化还原酶1活性的测定结果 Figure 4 Test results of NAD(P)H quinone oxidoreductase 1 activity in Rattus losea in Jiangmen, Guangdongprovince |
| |
敏感黄毛鼠血清和肝脏中Cytb5的含量分别为(27.63±0.61)和(36.43±0.65) nmol/L,抗药性黄毛鼠血清和肝脏中Cytb5的含量分别为(27.50±0.86)和(33.89±0.90) nmol/L,经检验,敏感和抗药性黄毛鼠血清中Cytb5的含量差异无统计学意义(t=0.125,P=0.903),而肝脏中Cytb5的含量差异有统计学意义(t=2.281,P=0.046)。见图 5。

|
| 注; a.t=2.281, P=0.046。 图 5 广东省江门市黄毛鼠细胞色素b5含量的测定结果 Figure 5 Test results of cytochrome b5 content in Rattus losea in Jiangmen, Guangdong province |
| |
在Cytb5的活性方面,敏感黄毛鼠血清和肝脏中Cytb5的活性分别为(51.76±0.69)和(69.75±1.07) U/L,抗药性黄毛鼠血清和肝脏中Cytb5的活性分别为(50.53±1.93)和(68.43±2.15) U/L,经检验,敏感和抗药性黄毛鼠血清及肝脏中Cytb5的活性差异均无统计学意义(t1=0.601,P1=0.561;t2=0.552,P2=0.593)。见图 6。

|
| 图 6 广东省江门市黄毛鼠细胞色素b5活性的测定结果 Figure 6 Test results of cytochrome b5 activity of Rattus losea in Jiangmen, Guangdong province |
| |
研究结果表明,在广东省江门市黄毛鼠种群中无论是敏感鼠还是抗性鼠,肝脏中解毒酶的含量及活性均高于血清中的含量和活性,其中肝脏中NQO1的含量和活性、Cytb5的含量在敏感鼠和抗药性鼠之间差异有统计学意义,且敏感鼠高于抗药性鼠,而血清中3种酶的含量和活性、肝脏中CYP450的含量和活性以及Cytb5的活性差异均无统计学意义。
抗凝血类杀鼠剂对鼠类的作用机制主要是通过阻止鼠类的维生素K循环,导致凝血功能障碍。在维生素K循环中,维生素K环氧化物还原酶(vitamin K epoxide reductase,VKOR)可以将氧化型的维生素K还原为还原型维生素K,随后维生素K依赖的凝血因子和蛋白在γ-谷氨酰羧化酶(γ-glutamyl-carboxylase,GGCX)的作用下,利用还原型维生素K将谷氨酸残基转变为γ-羧基谷氨酸,在此过程中还原型维生素K就变为氧化型的维生素K。杀鼠灵等抗凝血类杀鼠剂与维生素K的基本化学结构相似,可以与维生素K循环中的VKOR相结合,阻止还原型维生素K的生成,从而阻止凝血因子的活化导致凝血功能障碍[15]。Pelz等[2]和Wajih等[16]研究提出了NAD(P)H依赖的维生素K还原途径:抗药性鼠为了维持γ-羧化效率,关闭VKOR还原途径,同时开启NAD(P)H还原途径,该途径涉及到NQO1和NAD(P)H脱氢酶等。相对于VKOR而言,NQO1对抗凝血剂并不敏感,Markussen等[17]研究发现NQO1基因的表达量和活性在抗药性鼠中低于敏感鼠,本研究结果与此类似,推测VKOR补充途径主要依赖NAD(P)H脱氢酶。
除了VKOR、NQO1、NAD(P)H脱氢酶与鼠类的抗药性相关外,Cyt-P450参与抗凝血类杀鼠剂在鼠体内的代谢,杀鼠灵可以选择性地被CYP450酶催化生成4′-、6-、7-、8-和10-羟基化杀鼠灵,这些代谢产物能够随着尿液或粪便排出体外,从而降低有毒物质对机体的损害[18]。Takeda等[19]研究发现日本屋顶鼠(R. rattus)对杀鼠灵的抗药性主要通过增加P450基因的表达促进杀鼠灵的代谢,其中敏感鼠和抗药性鼠Cyp2b1、Cyp2c6、Cyp2c11和Cyp3a2基因的表达量有显著差别,在抗性鼠的血清中检测到更低水平的杀鼠灵,而在尿液中则检测到更多的羟基化杀鼠灵。同样,在英国的褐家鼠(R. norvegicus)种群中,CYP450对杀鼠剂的代谢活动增强,能够解释不同地理种群相同的VKORC1基因突变而抗药性水平差异有统计学意义,在西北部褐家鼠的肝脏中能检测到更多的羟基化鼠得克[20]。本研究中CYP450的含量和活性在敏感鼠和抗药性鼠之间差异无统计学意义,可能是由于CYP450是一个复杂的基因家族,整体的含量和活性差异不大,但该家族中部分亚家族的关键基因在表达量和活性上存在差异,从而影响CYP450酶的代谢功能。而Cytb5作为CYP450的协同作用因子,其基因的表达量变化即含量可能与鼠类对杀鼠灵的抗药性相关。
鼠类对抗凝血类杀鼠剂的抗药性是一个复杂的生理过程,一方面是抗凝血杀鼠剂的作用靶标酶VKOR发生遗传变异,导致抗凝血剂的抑制作用下降;另一方面是解毒系统对杀鼠剂的代谢作用增强;此外,钙腔蛋白(calumenin,CALU)作为一种拮抗信号肽,可以与VKOR结合从而阻断杀鼠灵与VKOR的结合[17],CALU、NQO1、NAD(P)H脱氢酶、Cytb5、NAD(P)H P450还原酶等也可能与鼠类的抗药性相关[21];另外,抗凝血杀鼠剂进入肠道后,肠道微生物菌群产生的化合物能与药物结合,改变药物的结构从而使药物化学性质改变,导致鼠类产生抗药性[22]。因此,在抗凝血剂抗药性的研究中,应将多个因素结合在一起进行综合分析,甚至考虑另外的维生素K补充途径,才有可能更好地阐明鼠类对抗凝血剂的抗药性作用机制。
| [1] |
姚丹丹, 冯志勇, 隋晶晶, 等. 黄毛鼠对抗凝血杀鼠剂回避行为的初步研究[J]. 中国媒介生物学及控制杂志, 2013, 24(3): 211-214. Yao DD, Feng ZY, Sui JJ, et al. Preliminary study on avoidance behavior of Rattus losea to anticoagulant rodenticide[J]. Chin J Vector Biol Control, 2013, 24(3): 211-214. |
| [2] |
Pelz HJ, Rost S, Hünerberg M, et al. The genetic basis of resistance to anticoagulants in rodents[J]. Genetics, 2005, 170(4): 1839-1847. DOI:10.1534/genetics.104.040360 |
| [3] |
Rost S, Fregin A, Hünerberg M, et al. Site-directed mutagenesis of coumarin-type anticoagulant-sensitive VKORC1:evidence that highly conserved amino acids define structural requirements for enzymatic activity and inhibition by warfarin[J]. Thromb Haemost, 2005, 94(4): 780-786. DOI:10.1160/TH05-02-0082 |
| [4] |
周斌芬, 唐振华, 高菊芳. 昆虫代谢抗性的研究进展[J]. 农药, 2008, 47(5): 313-315, 323. Zhou BF, Tang ZH, Gao JF. Advances in metabolic resistance to insecticides in insects[J]. Agrochemicals, 2008, 47(5): 313-315, 323. DOI:10.16820/j.cnki.1006-0413.2008.05.001 |
| [5] |
曾晓芃, 于彩虹, 高希武. 德国小蠊抗性与敏感品系细胞色素P450生化特征的研究[J]. 中国媒介生物学及控制杂志, 2004, 15(3): 175-177, 179. Zeng XP, Yu CH, Gao XW. Study on cytochrome P450 biochemical characterization in susceptible strain and resistant population of German cockroach(Blattella germanica)[J]. Chin J Vector Biol Control, 2004, 15(3): 175-177, 179. DOI:10.3969/j.issn.1003-4692.2004.03.005 |
| [6] |
Porter TD, Coon MJ. Cytochrome P450[J]. J Biol Chem, 1991, 266(21): 13469-13472. |
| [7] |
汪希兰, 宋磊, 张龙, 等. 两种诱导法对大鼠肝微粒体细胞色素P450酶含量的影响[J]. 贵州医药, 2017, 41(9): 909-910. Wang XL, Song L, Zhang L, et al. Effects of two different induction methods on liver microsomal cytochrome P450 in rats[J]. Guizhou Med J, 2017, 41(9): 909-910. DOI:10.3969/j.issn.1000-744X.2017.09.004 |
| [8] |
夏小俊, 金中初. NQO1酶及其被氧环境诱导表达的研究进展[J]. 生理科学进展, 2002, 33(3): 225-229. Xia XJ, Jin ZC. Advances in the study of NAD(P)H:quinone oxidoreductase and its induction by cellular oxidative stress[J]. Prog Physiol Sci, 2002, 33(3): 225-229. |
| [9] |
高志祥, 林伟松, 冯志勇, 等. 广东省作物种植区害鼠群落结构调查研究[J]. 中国植保导刊, 2011, 31(6): 35-37. Gao ZX, Lin WS, Feng ZY, et al. Study on rodent community structure in crop field in Guangdong province[J]. China Plant Prot, 2011, 31(6): 35-37. DOI:10.3969/j.issn.1672-6820.2011.06.010 |
| [10] |
冯志勇, 姚丹丹, 黄立胜, 等. 黄毛鼠对第一代抗凝血灭鼠剂的抗药性监测[J]. 植物保护学报, 2007, 34(4): 420-424. Feng ZY, Yao DD, Huang LS, et al. Surveillance on the resistance of Rattus losea to the first-generation anticoagulants[J]. Acta Phytophy Sin, 2007, 34(4): 420-424. DOI:10.3321/j.issn:0577-7518.2007.04.017 |
| [11] |
姚丹丹, 梁练, 胡杰, 等. 湛江地区黄毛鼠对溴敌隆的敏感性研究[J]. 中国媒介生物学及控制杂志, 2008, 19(1): 1-3. Yao DD, Liang L, Hu J, et al. The susceptibility of Rattus losea to bromadiolone in Zhanjiang[J]. Chin J Vector Biol Control, 2008, 19(1): 1-3. DOI:10.3969/j.issn.1003-4692.2008.01.001 |
| [12] |
隋晶晶, 高志祥, 姚丹丹, 等. 血凝反应法检测黄毛鼠对抗凝血杀鼠剂抗性的可行性研究[J]. 中国媒介生物学及控制杂志, 2013, 24(3): 208-210, 214. Sui JJ, Gao ZX, Yao DD, et al. Study on the feasibility of blood clotting response test for determining resistance to anticoagulant rodenticide in Rattus losea[J]. Chin J Vector Biol Control, 2013, 24(3): 208-210, 214. |
| [13] |
Wang JS, Feng ZY, Yao DD, et al. Warfarin resistance in Rattus losea in Guangdong province, China[J]. Pestic Biochem Physiol, 2008, 91(2): 90-95. |
| [14] |
姚丹丹, 姜洪雪, 刘福佳, 等. 广东省江门市黄毛鼠对第一代抗凝血杀鼠剂的抗药性及其与VKORC1基因的相关性研究[J]. 中国媒介生物学及控制杂志, 2019, 30(6): 17-21. Yao DD, Jiang HX, Liu FJ, et al. A study of the resistance of Rattus losea to the first-generation anticoagulant rodenticide and its correlation with the VKORC1 gene[J]. Chin J Vector Biol Control, 2019, 30(6): 17-21. DOI:10.11853/j.issn.1003.8280.2019.06.004 |
| [15] |
宋英, 李宁, 王大伟, 等. 鼠类对抗凝血类灭鼠剂抗药性的遗传机制[J]. 中国科学:生命科学, 2016, 46(5): 619-626. Song Y, Li N, Wang DW, et al. Genetic mechanism of resistance to anticoagulant rodent poison in rodents[J]. Sci Sin Vitae, 2016, 46(5): 619-626. DOI:10.1360/N052016-00161 |
| [16] |
Wajih N, Sane DC, Hutson SM, et al. The inhibitory effect of calumenin on the vitamin K-dependent γ-carboxylation system:characterization of the system in normal and warfarin-resistant rats[J]. J Biol Chem, 2004, 279(24): 25276-25283. DOI:10.1074/jbc.M40164520 |
| [17] |
Markussen MD, Heiberg AC, Fredholm M, et al. Characterization of bromadiolone resistance in a Danish strain of Norway rats, Rattus norvegicus, by hepatic gene expression profiling of genes involved in vitamin K-dependent γ-carboxylation[J]. J Biochem Mol Toxicol, 2007, 21(6): 373-381. DOI:10.1002/jbt.20201 |
| [18] |
Guengerich FP, Dannan GA, Wright ST, et al. Purification and characterization of liver microsomal cytochromes P-450:electrophoretic, spectral, catalytic, and immunochemical properties and inducibility of eight isozymes isolated from rats treated with phenobarbital or β-naphthoflavone[J]. Biochemistry, 1982, 21(23): 6019-6030. DOI:10.1021/bi00266a045 |
| [19] |
Takeda K, Ikenaka Y, Tanikawa T, et al. Novel revelation of warfarin resistant mechanism in roof rats (Rattus rattus) using pharmacokinetic/pharmacodynamic analysis[J]. Pestic Biochem Physiol, 2016, 134: 1-7. DOI:10.1016/j.pestbp.2016.04.004 |
| [20] |
Boitet M, Hammed A, Chatron N, et al. Elevated difenacoum metabolism is involved in the difenacoum-resistant phenotype observed in Berkshire rats homozygous for the L120Q mutation in the vitamin K epoxide reductase complex subunit 1(Vkorc1) gene[J]. Pest Manag Sci, 2018, 74(6): 1328-1334. DOI:10.1002/ps.4797 |
| [21] |
Ishizuka M, Okajima F, Tanikawa T, et al. Elevated warfarin metabolism in warfarin-resistant roof rats (Rattus rattus) in Tokyo[J]. Drug Metab Dispos, 2007, 35(1): 62-66. |
| [22] |
徐倩, 徐国兵. 香豆素类化合物代谢研究进展[J]. 中国实验方剂学杂志, 2015, 21(3): 222-225. Xu Q, Xu GB. Metabolism research review of coumarin compounds[J]. Chin J Exp Tradit Med Formul, 2015, 21(3): 222-225. DOI:10.13422/j.cnki.syfjx.2015030222 |
 2020, Vol. 31
2020, Vol. 31


