扩展功能
文章信息
- 南晓伟, 解新霞, 于红敏, 司晓艳, 陈继来, 张晨光, 张秀红
- NAN Xiao-wei, XIE Xin-xia, YU Hong-min, SI Xiao-yan, CHEN Ji-lai, ZHANG Chen-guang, ZHANG Xiu-hong
- 内蒙古包头市2018年一起流行性乙型脑炎疫情的媒介蚊虫及感染虫媒病毒调查
- An investigation of the vector mosquitoes and arboviruses during a Japanese encephalitis epidemic in Baotou of Inner Mongolia autonomous region, China, 2018
- 中国媒介生物学及控制杂志, 2020, 31(6): 652-656
- Chin J Vector Biol & Control, 2020, 31(6): 652-656
- 10.11853/j.issn.1003.8280.2020.06.005
-
文章历史
- 收稿日期: 2020-06-09
2 乌兰察布市地方病防治中心, 内蒙古 乌兰察布 012000;
3 包头医学院公共卫生学院, 内蒙古 包头 014040
2 Ulanqab Center for Endemic Disease Control and Prevention;
3 School of Public Health, Baotou Medical College
流行性乙型脑炎(乙脑)的病原体为乙脑病毒(Japanese encephalitis virus,JEV),是一种可引起严重中枢神经系统疾病的虫媒病毒[1],主要传播媒介为蚊虫。乙脑的致死率高达30%左右,另有50%的患者会留下永久性的神经系统后遗症[2]。包头市土默特右旗(土右旗)位于内蒙古自治区(内蒙古)中南部,黄河北岸,110°45′E,40°19′N,海拔990 m,属典型大陆性半干旱季风气候,年平均气温为7.5 ℃,7月气温最高平均为22.9 ℃,年平均降水量346 mm。2018年8-9月,该地区出现5例乙脑病例[3],当年9月在土右旗采集蚊虫标本,开展蚊虫及其携带虫媒病毒调查,现将结果报告如下。
1 材料与方法 1.1 蚊虫标本的采集2018年9月8-12日,使用诱蚊灯(武汉吉星医疗科技有限公司,LTS-M02)在土右旗10个村庄的牲畜棚及居民房屋外环境采集蚊虫。在太阳落山之前悬挂诱蚊灯,次日06:00左右收回诱蚊灯,将诱蚊袋置于冰排上,尽快放置实验室冰箱冷冻处死。在冰排上对蚊虫标本进行分类鉴定后,按照采集点和标本种类分装于冻存管中,50~100只/管,置于液氮罐中保存备用。
1.2 蚊虫标本处理从液氮罐中取出装有蚊虫的冻存管,迅速放入冰盒。在生物安全柜内将蚊虫标本分装至装有Φ 5 mm不锈钢珠的圆底EP管中,将装有蚊虫的EP管迅速置于冰浴中,向EP管中加入细胞培养液1 ml,用组织研磨仪(Qiagen,Tissue LyserII)以30 Hz的频率振荡1 min,振荡结束后,取下Tissue Lyser Adapter Set,转动试管架,使靠近Tissue Lyser的试管放置在最外面,继续振荡1 min,之后将EP管置于低温离心机(Eppendorf,5424型),4 ℃ 5 000 r/min,离心半径8.4 cm,离心10 min,离心后吸取上清液分装在3个EP管中,其中2管各为200 μl,另外1管为500 μl。其中1管直接使用核酸提取试剂盒(上海伯杰医疗科技有限公司,TQ-BG-001-96B)在半自动核酸提取仪(上海伯杰医疗科技有限公司,型号:BG-Flex-32)进行总核酸提取,提取的50 μl总核酸放置-80 ℃冰箱备用。
1.3 引物合成黄病毒科(Flaviviridae)、布尼亚病毒科(Bunyaviridae)和甲病毒属(Alphavirus)的特异性引物序列由中国疾病预防控制中心病毒病预防控制所病毒性脑炎室提供[4],由生工生物工程(上海)股份有限公司合成,引物序列见表 1。
用Invitrogen公司的Super ScriptIII One-Step RT-PCR System with Platinum® Taq High Fidelity(货号:12574035)试剂盒进行一步法RT-PCR检测。PCR反应管为8联薄壁透明管,管盖为8联透光性管盖,购自美国Axygen公司。正、反向引物以及探针的储存浓度为100 μmol/L,避免反复冻融,在配制体系时将储存浓度用ddH2O稀释为工作浓度均为10 μmol/L。按照Super Script One-Step RT-PCR System的说明书配制体系,其中2×invengen Master Mix为12.5 μl,正、反向引物分别为0.5 μl,SSⅢ为0.5 μl,模板RNA为5 μl,ddH2O补足至25 μl。反应程序为:热循环参数55 ℃,30 min,1个循环;95 ℃ 3 min,94 ℃ 10 s,55 ℃ 40 s,共40个循环;72 ℃延伸10 min,然后4 ℃保持。1.5%琼脂糖凝胶电泳检查扩增条带,PCR产物送生工生物工程(上海)股份有限公司进行测序。
1.5 标本接种将RT-PCR检测阳性标本以及与其在同一地点采集到的各标本研磨液从超低温冰箱中取出,在500 μl研磨液中加入PS 5 μl(1 000 unit/ml penicillin和100 μg/ml streptomycin;品牌:Gibco),然后接种至长满80%的BHK细胞瓶中,置37 ℃,5%CO2培养箱孵育1 h,然后弃去液体,换细胞生长维持液(含胎牛血清1%),于培养箱培养,逐日观察细胞病变,连续传3代,无病变者丢弃。
1.6 全基因组测序将经过RT-PCR检测的阳性样本送至上海伯杰医疗科技有限公司,用一代测序法对样本进行JEV全基因测序。
1.7 序列分析使用SeqMan(DNAStar,Madison,WI)程序对新序列进行组装和调试;用MegAlign(DNAStar,Madison,WI)进行核苷酸和氨基酸序列的同源性分析;使用MEGA 5.05软件完成基于Neighbour-Joining方法的E基因的系统进化分析。
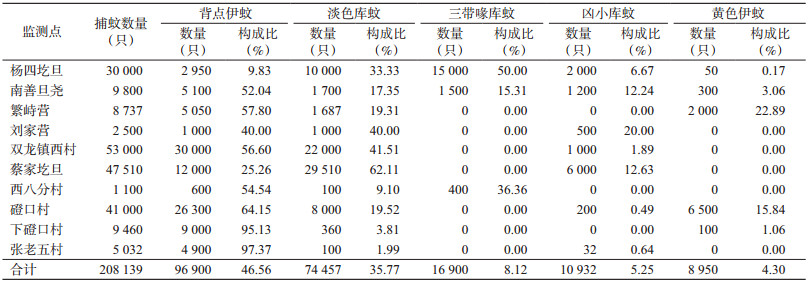
2 结果 2.1 蚊种构成2018年9月8-12日,在土右旗10个村的牲畜棚及居民房外环境共布放诱蚊灯38灯次,采集蚊虫5种208 139只,包括背点伊蚊(Aedes dorsalis)、淡色库蚊(Culex pipienspallens)、三带喙库蚊(Cx. tritaeniorhynchus)、凶小库蚊(Cx. modestus)和黄色伊蚊(Ae. flavescens),分别占捕蚊总数的46.56%、35.77%、8.12%、5.25%和4.30%。见表 2。
|
每个监测村采用随机法挑取一定数量的蚊虫,以50~100只/管,收集蚊虫共计198份(管)样本。经对198份样本检测,1.5%琼脂糖凝胶电泳检测扩增条带,发现在250 bp附近有条带出现,样本号为NMG58和NMG7。
2.3 核酸检测产物基因测序测序后分别获得310和251 bp的碱基序列,在GenBank BLAST中进行序列比对,2份阳性结果序列分别为JEV和Tahyna病毒序列。
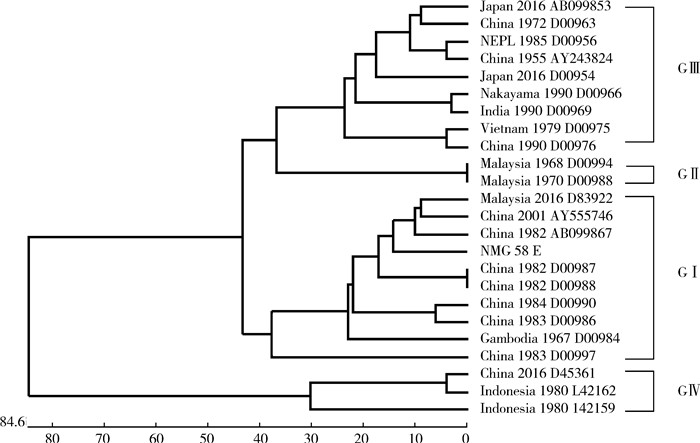
2.4 全基因测序分析采用一代测序方法,测序结果样本NMG58全基因序列为10 880 bp,与GenBank BLAST进行比对结果为JEV全基因序列。为确定此病毒的基因型,用Chen等[5]建立的基因分型方法,从GenBank中全面选择不同国家和地区的20株JEV PrM区段序列(E基因区段)进行系统进化分析,结果显示,NMG58序列属基因Ⅰ型。见图 1。
|
| 图 1 分离自不同国家的20株流行性乙型脑炎病毒株的系统进化树 Figure 1 The phylogenetic tree of 20 JEV strains isolated in different countries |
| |
采用世界卫生组织推荐在中国广泛使用的减毒活疫苗株SA14-14-2株为参考株[6],对NMG58株的E基因区段核苷酸及氨基酸序列进行分析,并且与SH-101株一起比对分析。SA14-14-2全基因组全长10 976个核苷酸,基因组中96~10394位碱基为1个长开放阅读框(Open Reading Frame,ORF),编码3 432个氨基酸。NMG58全基因序列10 880 bp,包括1个10 299 bp的ORF,NMG58病毒基因组934~2433位,为E基因区段。用MegAlign进行核苷酸以及氨基酸的同源性分析,结果显示,NMG58株与SA14-14-2和SH-101核苷酸同源性分别为87.41%和97.54%,氨基酸同源性为97.04%和99.57%,其与疫苗株和SH-101之间核苷酸分别存在12.59%和2.56%的差异,氨基酸分别存在2.96%和0.43%的差异。NMG58序列与SA14-14-2氨基酸存在15个位点差异,分别位于E-107、E-123、E-129、E-138、E-176、E-177、E-222、E-244、E-264、E-279、E-315、E-327、E-366、E-439和E-447,与SH-101氨基酸仅存在1个位点差异,为E-114位。
3 讨论土右旗近20年无乙脑病例报告[7],2018年9月突发5例成年人乙脑病例。该旗位于黄河北岸,年平均降水量不足200 mm,而2018年7月降水量明显增多,本次疫情可能与主要媒介蚊种大量孳生有关。包头市为病媒生物监测的常规监测点,近几年未监测到三带喙库蚊。此次在包头市土右旗的杨四圪旦、南善旦尧、繁峙营和磴口村等10个村的牲畜棚及居民房屋的外环境布放诱蚊灯,共捕获蚊虫208 139只,其中三带喙库蚊占8.12%,主要采集于猪圈及其周围农户,同时还监测到凶小库蚊、淡色库蚊和背点伊蚊。幼猪(Piglets)为JEV的储存宿主,而三带喙库蚊为乙脑的主要传播媒介。据记载,背点伊蚊也是JEV的传播媒介。
与人类关系最为密切的虫媒病毒主要属于黄病毒科、布尼亚病毒科、披膜病毒科(Togaviridae)和呼肠孤病毒科(Reoviridae)[8],而我国现流行的虫媒病毒主要分布于黄病毒科、布尼亚病毒科和披膜病毒科的甲病毒属[9]。本研究为了全面检测到虫媒病毒,设计了该3个病毒科(属)的核酸检测引物,其中甲病毒属为1条正向引物和2条反向引物。本研究中共检测到1株JEV和1株Tahyna病毒基因阳性,均来自背点伊蚊,JEV采集于猪圈,Tahyna病毒采集于磴口村一居民区。在我国媒介伊蚊主要有白纹伊蚊(Ae. albopictus)和埃及伊蚊(Ae. aegypti),是登革病毒、黄热病毒和寨卡病毒等病毒的主要传播媒介,而在内蒙古地区,主要以背点伊蚊为主,提示背点伊蚊可能为内蒙古地区乙脑的主要传播媒介。此次调查中,其中8.12%的蚊虫为三带喙库蚊,我们将部分三带喙库蚊分成26个样本组进行虫媒病毒核酸检测,未检测到阳性样本,这或许与优势蚊虫有一定关系。此次对检测阳性及同一地点样本共15份蚊虫样本,同时接种BHK细胞,共45瓶,经过3代盲传,未获得阳性分离物。因实验条件有限,计划后续接种C6/36细胞进行病毒分离。此次出现的5例成人乙脑病例IgG检测均为阳性,故此次报告着重介绍JEV研究结果,Tahyna病毒及其研究结果后续报道。
我国乙脑的减毒活疫苗株SA14-14-2为基因Ⅲ型,通过将NMG58株E蛋白区段的核苷酸和氨基酸序列与其对比,发现分别有12.59%和2.56%的差异,核苷酸差异较大,而氨基酸序列上的差异很小,由此可见为沉默突变,未引起氨基酸的变化。对NMG58株进行基因分型鉴定时,采用了Chen等[5]建立的基因分型方法,该方法选择的cut-off值为12.00%的差异度,此方法把JEV分为基因Ⅰ~Ⅴ共5个基因型。Chen等[5]的研究显示属于基因Ⅰ型的多数为泰国北部和柬埔寨地区的毒株;属于基因Ⅱ型的多由泰国南部、马来西亚、印度尼西亚的毒株形成;属于基因Ⅲ型的来自于印度、中国及日本的毒株;部分印度尼西亚的毒株独自形成了自己的基因型即Ⅳ型。1952年在马来西亚首次分离到基因Ⅴ型[10],2009年在西藏自治区采集的蚊虫中分离到1株基因Ⅴ型JEV[11-13]。同时,NMG58株E基因区段核苷酸及氨基酸与中国首次分离的相同基因型SH-101株比对,氨基酸仅有1个位点差异,本研究发现目前使用的减毒疫苗株能够覆盖基因Ⅰ型JEV毒株,因此,对此次疫区重点人群进行乙脑疫苗接种具有保护作用。
此次获得的NMG58株全基因序列,为基因Ⅰ型,这是首次在内蒙古地区获得JEV全基因序列,同时也是首次获得基因Ⅰ型序列。我国首次发现JEV基因Ⅰ型是在2001年的上海市[14],之后是在2006年辽宁省东港市[15],均为沿海城市。此次跨过秦岭-淮河界,在我国的北部内陆城市出现,对研究我国JEV各基因型的分布有重要意义。
| [1] |
李晓宇, 宋宏, 付士红, 等. 中国流行性乙型脑炎病毒分子生物学特性研究[J]. 病毒学报, 2004, 20(3): 200-209. Li XY, Song H, Fu SH, et al. The molecular biology of Japanese encephalitis viruses isolated in China[J]. Chin J Virol, 2004, 20(3): 200-209. DOI:10.3321/j.issn:1000-8721.2004.03.002 |
| [2] |
王环宇, 梁国栋. 我国虫媒病毒研究10年回顾[J]. 中国公共卫生, 2003, 19(4): 473-476. Wang HY, Liang GD. Review of research on Arboviruses in China in the past 10 years[J]. Chin J Pub Health, 2003, 19(4): 473-476. DOI:10.11847/zgggws2003-19-04-51 |
| [3] |
万寒兵, 杨玉荣, 林亮, 等. 2018年内蒙古自治区包头市一起老年人流行性乙型脑炎暴发疫情的调查[J]. 疾病监测, 2019, 34(12): 1126-1129. Wan HB, Yang YR, Lin L, et al. An outbreak of Japanese encephalitis in elderly people in Baotou, Inner Mongolia, 2018[J]. Dis Surveill, 2019, 34(12): 1126-1129. DOI:10.3784/j.issn.1003-9961.2019.12.020 |
| [4] |
程睿, 南晓伟, 范娜, 等. 内蒙古自治区采集的蚊虫标本新发现乙脑病毒和盖塔病毒[J]. 中华流行病学杂志, 2020, 41(4): 571-579. Cheng R, Nan XW, Fan N, et al. Emerging of Japanese encephalitis virus and Getah virus from specimen of mosquitoes in Inner Mongolia autonomous region[J]. Chin J Epidemiol, 2020, 41(4): 571-579. DOI:10.3760/cma.j.cn112338-20190425-00284 |
| [5] |
Chen WR, Rico-HesseR, Tesh RB. A new genotype of Japanese encephalitis virus from Indonesia[J]. Am J Trop Med Hyg, 1992, 47(1): 61-69. DOI:10.4269/ajtmh.1992.47.61 |
| [6] |
曾明, 俞永新, 董关木, 等. 乙型脑炎病毒减毒活疫苗生产株SA14-14-2基因组全序列的测定[J]. 中华微生物学和免疫学杂志, 2001, 21(5): 69-73. Zeng M, Yu YX, Dong GM, et al. Sequence analysis of the full-length genome of Japanese encephalitis virus vaccine SA14-14-2 strain[J]. Chin J Microbiol Immunol, 2001, 21(5): 69-73. DOI:10.3760/j:issn:0254-5101.2001.05.021 |
| [7] |
范耀春, 闫真, 李澄, 等. 内蒙古自治区1991-2010年流行性乙型脑炎流行特征分析[J]. 中国媒介生物学及控制杂志, 2012, 23(2): 174-175. Fan YC, Yan Z, Li C, et al. Analysis on the epidemiological characteristics of Japanese encephalitis from 1991 to 2010 in Inner Mongolia autonomous region[J]. Chin J Vector Biol Control, 2012, 23(2): 174-175. |
| [8] |
梁国栋. 虫媒病毒:重要的被忽略的热带传染病病原体[J]. 中国热带医学, 2018, 18(1): 1-5. Liang GD. Arbovirus:the very important pathogen of neglected tropical infectious disease in the world[J]. Chin Trop Med, 2018, 18(1): 1-5. DOI:10.13604/j.cnki.46-1064/r.2018.01 |
| [9] |
陆敏, 孙薇, 张咏适, 等. 我国虫媒病毒病研究进展[J]. 中国国境卫生检疫杂志, 2019, 42(1): 74-76. Lu M, Sun W, Zhang YS, et al. Research progress of arbovirus deseases in China[J]. Chin J Frontier Health Quarant, 2019, 42(1): 74-76. DOI:10.16408/j.1004-9770.2019.01.020 |
| [10] |
Mohammed MAF, Galbraith SE, Radford AD, et al. Molecular phylogenetic and evolutionary analyses of Muar strain of Japanese encephalitis virus reveal it is the missing fifth genotype[J]. Infect, Gene Evol, 2011, 11(5): 855-862. DOI:10.1016/j.meegid.2011.01.020 |
| [11] |
Li MH, Fu SH, Chen WN, et al. Molecular characterization of full-length genome of Japanese encephalitis virus genotype Ⅴ isolated from Tibet, China[J]. Biomed Environ Sci, 2014, 27(4): 231-239. DOI:10.3967/bes2014.046 |
| [12] |
Li MH, Fu SH, Chen WX, et al. Genotype Ⅴ Japanese encephalitis virus is emerging[J]. PLoS Negl Trop Dis, 2011, 5(7): e1231. DOI:10.1371/journal.pntd.0001231 |
| [13] |
张慧艳, 高晓艳, 崔世恒, 等. 我国新出现的基因Ⅴ型乙脑病毒全基因组分子特征[J]. 中华微生物学和免疫学杂志, 2015, 35(2): 81-86. Zhang HY, Gao XY, Cui SH, et al. Whole genome sequence analysis of an emerging Japanese encephalitis virus (genotype Ⅴ) strain isolated in mainland China[J]. Chin J Microbiol Immunol, 2015, 35(2): 81-86. DOI:10.3760/cma.j.issn.0254-5101.2015.02.001 |
| [14] |
王环宇, 付士红, 李晓宇, 等. 我国首次分离到基因Ⅰ型乙型脑炎病毒[J]. 中华微生物学和免疫学杂志, 2004, 24(11): 843-849. Wang HY, Fu SH, Li XY, et al. Isolation and identification of genotypeⅠJapanese encephalitis virus in China[J]. Chin J Microbiol Immunol, 2004, 24(11): 843-849. DOI:10.3760/j:issn:0254-5101.2004.11.001 |
| [15] |
王俊文, 付士红, 王环宇, 等. 辽宁省乙脑病毒的分离与鉴定[J]. 中华实验和临床病毒学杂志, 2006, 20(1): 61-65. Wang JW, Fu SH, Wang HY, et al. Isolation and identification of Japanese encephalitis virus in Liaoning province[J]. Chin J Exp Clin Virol, 2006, 20(1): 61-65. DOI:10.3760/cma.j.issn.1003-9279.2006.01.017 |
 2020, Vol. 31
2020, Vol. 31



