扩展功能
文章信息
- 吴海霞, 任东升, 李贵昌, 王雪霜, 刘小波, 刘起勇
- WU Hai-xia, REN Dong-sheng, LI Gui-chang, WANG Xue-shuang, LIU Xiao-bo, LIU Qi-yong
- 病媒生物传播新型冠状病毒风险评估及防控建议
- Risk assessment and prevention and control recommendations for vectors transmitting coronavirus disease 2019
- 中国媒介生物学及控制杂志, 2020, 31(6): 633-638
- Chin J Vector Biol & Control, 2020, 31(6): 633-638
- 10.11853/j.issn.1003.8280.2020.06.001
-
文章历史
- 收稿日期: 2020-11-14
新型冠状病毒肺炎(新冠肺炎)疫情正在席卷全球。病媒生物可机械或生物性传播病原体,如蜚蠊能携带细菌、病毒、寄生虫等多种病原生物[1-2],能通过体表携带传播腺病毒、肠道致细胞病变的孤儿病毒(enteric cytopathic human orphan virus,ECHO)、脊髓灰质炎病毒等[3];蝇类可机械性携带传播脊髓灰质炎病毒、肝炎病毒等数十种病原体等[4],家蝇(Musca domestica)可携带病鸡排泄物机械性传播火鸡冠状病毒[5];而与人类同属哺乳动物的鼠类,不但能通过机械性携带传播多种病原体,且具有与类似人类的冠状病毒结合受体血管紧张素转化酶2(angiotensin-converting enzyme 2,ACE2);蚊虫可通过刺吸人血,传播多种病毒。这些病媒生物的生活习性及活动范围使得其可能与新冠肺炎患者及其周边环境发生接触,而新型冠状病毒(新冠病毒)已报道的传播途径包括了体表黏膜途径和消化道途径(粪-口途径)。因此很有必要对病媒生物传播新冠病毒的风险进行评估研究。
本文根据病媒生物的生活习性、人群暴露于病媒生物活动场所或接触物品的可能性及新冠病毒目前已报道的传播途径,综合对病媒生物传播新冠肺炎的风险进行评估,以便在病媒生物控制过程中采取有针对性的控制策略和措施,降低通过病媒生物传播新冠病毒的潜在风险,同时减少过度控制和环境污染。
1 评估方法采用风险矩阵法,对病媒生物传播新冠病毒风险发生的可能性进行评估。通过对历史资料的收集、整理与分析,由有经验的专家对确定的风险因素发生可能性,采用定量与定性相结合的分析方法,进行量化评分,将评分结果列入二维矩阵表中进行计算,最终基于风险发生的可能性确定风险等级,提出控制风险的方案。
具体实施步骤:①根据评估议题邀请专家组成专家组;②专家组确定评估的具体内容;③专家组对病媒生物孳生活动风险、新冠病毒暴露污染风险发生的可能性进行描述,对可能性得分进行量化赋值并列出理由;④基于病媒生物孳生活动的风险、新冠病毒污染风险,建立病媒生物传播新冠病毒的风险等级矩阵;⑤对特定场所进行风险评分:专家组根据病媒生物的生活习性、人群暴露于病媒生物活动场所或接触物品的可能性及新冠病毒目前已报道的传播途径,对不同场所的病毒污染风险和病媒生物孳生、活动风险分别进行评分,两项分值相加计算各场所的总风险分值;⑥在风险评估矩阵分类表中找出总风险分值对应的风险等级,从而确定该场所的风险等级。
2 风险识别 2.1 评估内容 2.1.1 生物性传播风险我国华南地区的褐家鼠(Rattus norvegicus),云南省的齐氏姬鼠(Apodemus chevrieri)、澜沧江姬鼠(A. ilex)、丽江绒鼠(Eothenomys fidelis)等鼠类中发现多种冠状病毒,但目前未发现这些冠状病毒可以感染人类[6-11]。新冠病毒通过其外壳棘突蛋白(Spike protein)上的受体结合结构域与人的肺泡组织细胞中的ACE2结合,而进入肺泡细胞中增殖并使人致病[12-13]。其侵入细胞受体与重症急性呼吸综合征(SARS)冠状病毒相同。鼠类肺泡细胞也存在ACE2,其氨基酸序列与人ACE2虽然存在差异,但SARS冠状病毒通过受体结合区(receptor-binding domain,RBD)与小鼠ACE2结合,通过在小鼠体内连续传代,SARS病毒感染效率大幅度提高。然而通过分析人和其他13种动物ACE2 DNA序列,小鼠〔小家鼠(Mus musculus)〕和大鼠(褐家鼠)ACE2受体与人和其他动物序列差别最大,且不能与新冠病毒结合。实验证实小鼠和小鼠细胞均不能在实验室感染新冠病毒,只能使用人ACE基因转移小鼠作为实验研究模型[14]。因此新冠病毒在家栖鼠中生物性传播风险较低。
病毒在蚊虫体内能否存活、增殖、突破中肠屏障和唾液腺屏障是蚊虫生物性传播病毒的基础,目前已知蚊媒病毒可通过蚊虫传播。基于当前世界卫生组织(WHO)和美国疾病与预防控制中心(CDC)报道以及堪萨斯州立大学生物安全研究所初步实验研究证据,新冠病毒尚无法在蚊虫中复制,尚无蚊虫传播新冠病毒的实验证据[15]。此外,目前已知冠状病毒感染对象均为脊椎动物[16],可以判断蚊虫传播新冠病毒的风险极低,即排除蚊虫可生物性传播新冠病毒的风险。
2.1.2 机械性传播风险《新型冠状病毒肺炎诊疗方案(试行第八版)》中指出新冠病毒经呼吸道飞沫和密切接触传播是主要的传播途径;在相对封闭的环境中长时间暴露于高浓度气溶胶情况下存在经气溶胶传播的可能;接触病毒污染的物品也可造成感染;由于在粪便、尿液中可分离到新冠病毒,应注意其对环境污染造成接触传播或气溶胶传播。
根据病媒生物的孳生习性和活动性,蜚蠊、蝇类有可能接触病毒污染物,如未及时清理病毒污染的废弃物、食品等,然后通过机械携带,病媒生物活动时污染清洁的物品、食品,从而造成病毒的传播;病毒可能随着粪便进入城市下水管道或污染公共厕所鼠类的可能栖息场所,在城市下水系统和农村管理较差厕所中生活的鼠类的四肢、皮毛接触到污染物,经机械性携带病毒,可能传播到人类生活区,再通过污染物体表面或呼吸系统感染人类。特别是在接收新冠肺炎患者的医疗机构、医学观察区(隔离区)、确诊病例居住场所的环境中均可能存在新冠病毒的污染。一些紧急征用的隔离区条件参差不齐,有些条件较差或管理不善场所的厨房、餐厅、库房、垃圾堆放点、甚至病房都可能有蜚蠊、蝇类和鼠类等病媒生物活动。因此病媒生物机械性携带传播新冠病毒的风险不可忽视。
蚊虫一次吸血量1~4 mg[17-19],从血液中获取的病毒量很少,而且很快会进入蚊胃,即使未能一次吸饱血而马上再次吸血,其残留在唾液腺中的血液很少,所以通过吸血机械性传播的可能性极低。本文重点对蜚蠊、蝇类和鼠类机械性传播病毒开展风险评估。
2.2 制作风险矩阵图 2.2.1 新冠病毒暴露风险可能性分级新冠病毒暴露风险分级流程见图 1。
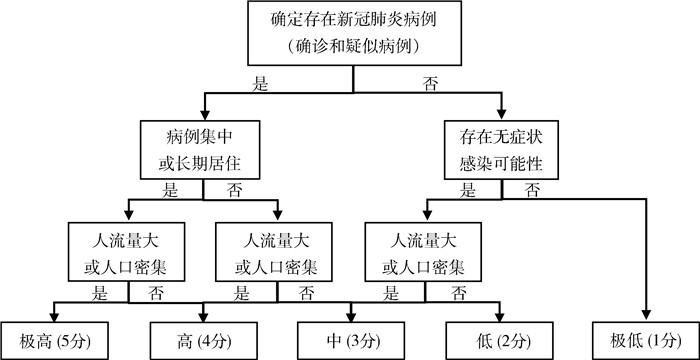
|
| 图 1 新冠病毒暴露风险分级流程图 Figure 1 Flow chart for grading the risk of exposure to SARS-CoV-2 |
| |
根据污染源出现的概率和人口的流动性,将不同场所新冠病毒污染的风险分为5级,并赋值:
极高风险:有病例存在,且病例集中或病例较长时间居住生活,人口密集或人流量大,病毒污染环境风险高,5分。
高风险:有病例存在,且病例集中或病例较长时间居住生活,但人流量不大或非人口密集;或病例未长时间居住,但人口密集或人流量大,4分。
中风险:有病例存在,但并非人口密集,或者存在病例可能性且人口密集或人流量大,可能造成较大范围扩散,3分。
低风险:存在病例可能性,并非人口密集且人流量不大,2分。
极低风险:暂时没有病例存在的场所,1分。
2.2.2 病媒生物孳生、活动风险可能性等级划分通过对病媒生物孳生、活动风险分析,确定分5级并赋值:
极高风险:孳生环境条件适宜,孳生/活动区域范围大。
高风险:孳生环境条件适宜,孳生/活动区域范围小。
中等风险:孳生环境条件中等,孳生/活动区域范围大。
低风险:孳生环境条件中等,孳生/活动区域范围小。
极低风险:孳生环境不适宜。
2.2.3 划分风险可能性等级,制作风险矩阵图根据新冠病毒暴露可能性风险和病媒生物孳生活动可能性风险评分,建立风险评估矩阵,分别将2个风险发生可能性因素得分进行相加,并根据得分划分风险等级。见图 2。
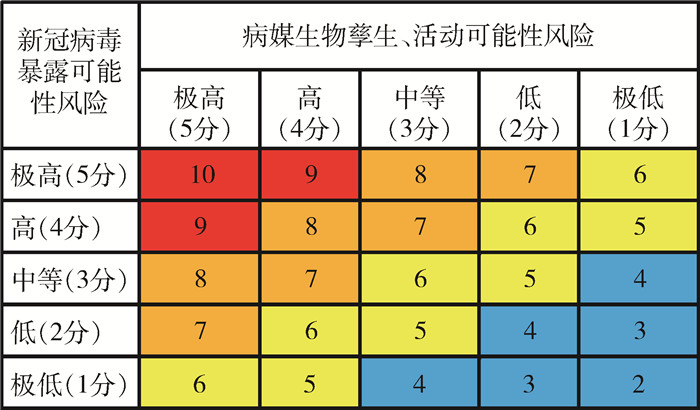
|
| 注:红色.得分9~10分, 表示传播风险发生可能性极高; 橙色.得分7一8分, 表示传播风险发生可能性高; 黄色.得分5一6分, 表示传播风险发生可能性中等; 蓝色.得分2一4分, 表示传播风险发生可能性低。 图 2 病媒生物传播新冠病毒风险可能性评估矩阵图 Figure 2 Risk probability matrix of vectors transmitting SARS-CoV-2 |
| |
社区与村镇:指14 d内有确诊和疑似病例居住或活动的社区或村镇。
医疗机构:医院、急救中心、社区(乡镇)卫生服务机构、诊所、药店等相关诊疗环境及污物处理场所等。
医学观察区:指政府指定的各类常规、临时的较为集中的疑似、轻症病例观察区,政府规定应隔离人员的集中隔离区。
有动物交易的农贸市场、集贸市场:指近期(14 d内)有过活禽、人工饲养野生动物、野生动物交易的已关闭和未关闭的农贸市场、集贸市场、花鸟虫鱼市场及专门的活体动物交易市场。
交通枢纽:指车站、机场、港口码头、长途客运站。
公共交通工具:指火车、飞机、轮船、长途客运车辆等。
公共场所:指商场超市、影剧院、宾馆、饭店等人群密集场所。
建筑工地:指规模较大、人员相对集中住宿的生活区。
学校:指有学生寄宿的大、中、小学,托幼机构、各类职业学校、培训机构等。
机关、企事业单位:指人员相对集中的工作场所。
动物园、动物医院、经济动物饲养与销售等环境:指有动物饲养、诊疗,特别是人工饲养野生动物的场所。
入境、新冠流行区输入货物储存、处理场所:指存放、运输、加工、处理和经营入境、新冠病毒流行区输入货物的场所及运输工具等,特别是冷冻食品。包括此类货物储存冷库、仓库,餐饮行业后厨储存、加工处理此类物品区域,超市、农贸市场储存及加工处理此类物品区域,工厂储存、加工、分装此类物品区域,长途运输此类物品的车辆等。
2.3.2 重点场所蜚蠊传播新冠病毒风险可能性评估根据全国病媒生物监测结果[20-21]和文献检索,以及有现场工作经验的专家评估,对重点环境类型中蜚蠊对新冠病毒的传播风险发生可能性进行评估,结果见表 1。
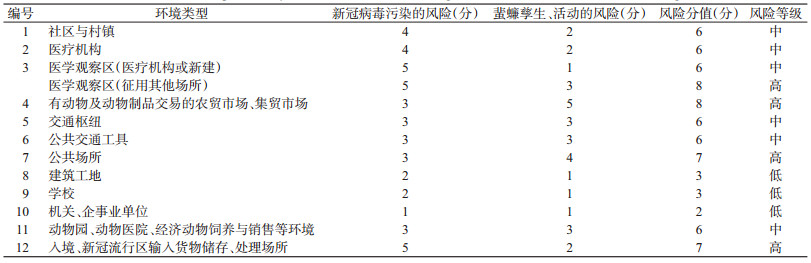
|
根据全国病媒生物监测结果[22],综合考虑蝇类易孳生程度、集中防蝇潜力、个体防蝇潜力等因素,对重点环境类型中蝇类对新冠病毒的传播风险可能性进行评估,结果见表 2。
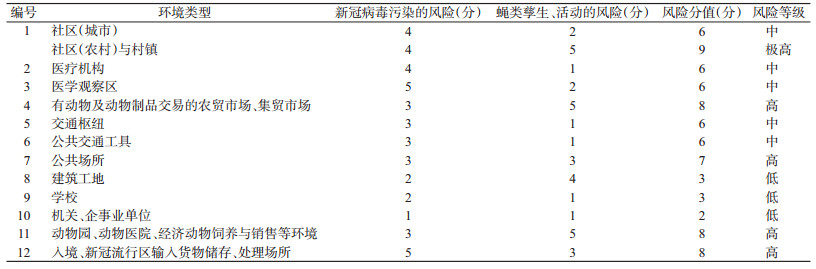
|
根据全国病媒生物监测结果[23],通过对鼠类活动风险分析,其中鼠类密度高低分2级,可迁移范围大小分高低2级,组合为4级,加上不适应孳生共5级。对重点环境类型中鼠类对新冠病毒的传播风险可能性进行评估,结果见表 3。
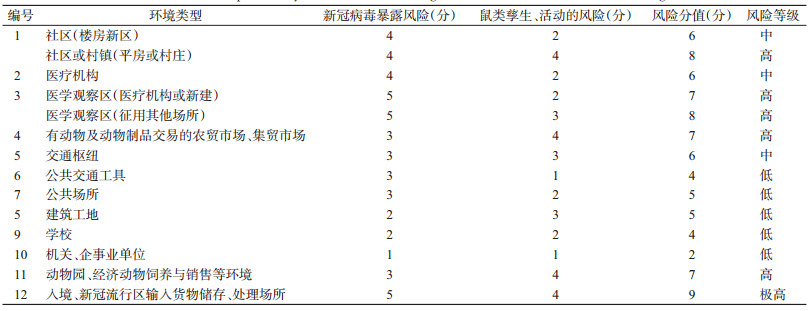
|
总体上,鼠、蜚蠊、蝇等病媒生物,在新冠病毒暴露的特殊场所和局部环境,具有潜在传播新冠病毒的风险,但风险较低。具体如下:(1)蜚蠊、蝇类具有机械性传播新冠病毒的潜在风险;鼠类存在经机械性携带和生物性传播新冠病毒的可能性。(2)传播风险可能性等级与新冠病毒暴露风险等级呈正相关。(3)传播风险可能性等级与病媒生物的分布范围、密度及活动能力等呈正相关。
3.2 风险管理建议基于目前病媒生物传播新冠病毒风险发生可能性的评估结果,提出风险管理建议。见表 4。

|
此外,建议在新冠病毒暴露风险较高的特殊场所和局部环境开展病媒生物防制,降低新冠病毒传播风险;开展病媒生物携带和传播新冠病毒的研究,进一步做好病媒生物传播新冠病毒风险评估,做好精准预防与控制。
本评估仅根据现有新冠病毒和其他冠状病毒特点和传播途径等因素做出,尚缺乏病媒生物携带和传播新冠病毒的直接证据,病媒生物传播新冠病毒的风险存在不确定性。
(注:2020年1月15日,中国CDC启动新冠肺炎疫情一级响应,1月24日,成立了爱国卫生组,本文作者参与其中组织制定环境卫生有关技术方案和指南等工作。其后,中国CDC传染病预防控制所也成立病媒生物防制小组。从2020年1月25日开始至2月7日,在爱国卫生工作组的领导下,中国CDC传染病预防控制所病媒生物防制小组(媒介生物控制室全体成员)根据当时新冠肺炎疫情的研究进展,对病媒生物传播新冠病毒的风险作出初步评估。本文是在当时评估报告的基础上修改而成。)
| [1] |
胡修元, 张一鸣, 盛琳芳, 等. 蟑螂携带病毒的调查研究[J]. 公共卫生与疾病控制杂志, 1983, 2(2): 1-4. Hu XY, Zhang YM, Sheng LF, et al. Investigation of the virus carried by cockroaches[J]. J Public Health Dis Control, 1983, 2(2): 1-4. |
| [2] |
常庆宁, 哈丽娜, 邸师红, 等. 银川市蟑螂侵害及病原携带状况调查[J]. 中华卫生杀虫药械, 2019, 25(6): 569-572. Chang QN, Ha LN, Di SH, et al. Investigation on the cockroach hazards and pathogen-carrying status in Yinchuan city[J]. Chin J Hyg Insect Equip, 2019, 25(6): 569-572. DOI:10.19821/j.1671-2781.2019.06.016 |
| [3] |
孟艳玲, 佟淑芬. 蟑螂传播疾病的探讨[J]. 医学动物防制, 1995(4): 391-392. Meng YL, Tong SF. Review of cockroach transmission disease[J]. Chin J Pest Control, 1995(4): 391-392. |
| [4] |
刘起勇. 环境有害生物防治[M]. 北京: 化学工业出版社, 2004: 28. Liu QY. Environmental pest control[M]. Beijing: Chemical Industry Press, 2004: 28. |
| [5] |
Calibeo-Hayes D, Denning SS, Stringham SM, et al. Mechanical transmission of turkey coronavirus by domestic houseflies (Musca domestica Linnaeaus)[J]. Avian Dis, 2003, 47(1): 149-153. DOI:10.1637/0005-2086(2003)047[0149:MTOTCB]2.0.CO;2 |
| [6] |
Lai MYY, Cheng PKC, Lim WWL. Survival of severe acute respiratory syndrome coronavirus[J]. Clin Infect Dis, 2005, 41(7): e67-e71. DOI:10.1086/433186 |
| [7] |
Holshue LM, DeBolt C, Lindquist S, et al. First case of 2019 novel coronavirus in the United States[J]. N Engl J Med, 2020, 382(10): 929-936. DOI:10.1056/NEJMoa2001191 |
| [8] |
Lu RJ, Zhao X, Li J, et al. Genomic characterisation and epidemiology of 2019 novel coronavirus:implications for virus origins and receptor binding[J]. Lancet, 2020, 395(10224): 565-574. DOI:10.1016/S0140-6736(20)30251-8 |
| [9] |
Ge XY, Yang WH, Zhou JH, et al. Detection of alpha-and betacoronaviruses in rodents from Yunnan, China[J]. Virol J, 2017, 14(1): 98. DOI:10.1186/s12985-017-0766-9 |
| [10] |
Lau SKP, Woo PCY, Li KSM, el al. Discovery of a novel coronavirus, China Rattus coronavirus HKU24, from Norway rats supports the murine origin of Betacoronavirus 1 and has implications for the ancestor of Betacoronavirus lineage A[J]. J Virol, 2015, 89(6): 3076-3092. DOI:10.1128/JVI.02420-14 |
| [11] |
Wang W, Lin XD, Guo WP, et al. Discovery, diversity and evolution of novel coronaviruses sampled from rodents in China[J]. Virology, 2015, 474: 19-27. DOI:10.1016/j.virol.2014.10.017 |
| [12] |
Li F. Receptor recognition and cross-species infections of SARS coronavirus[J]. Antiviral Res, 2013, 100(1): 246-254. DOI:10.1016/j.antiviral.2013.08.014 |
| [13] |
Wan YS, Shang J, Graham R, et al. Receptor recognition by the novel coronavirus from Wuhan:an analysis based on decade-long structural studies of SARS coronavirus[J]. J Virol, 2020, 94(7): e00127-20. DOI:10.1128/JVI.00127-20 |
| [14] |
Zhai XF, Sun JM, Yan ZQ, et al. Comparison of severe acute respiratory syndrome coronavirus 2 spike protein binding to ACE2 receptors from human, pets, farm animals, and putative intermediate hosts[J]. J Virol, 2020, 94(15): e00831-20. DOI:10.1128/JVI.00831-20 |
| [15] |
Huang YJS, Vanlandingham DL, Bilyeu AN, et al. SARS-CoV-2 failure to infect or replicate in mosquitoes:an extreme challenge[J]. Sci Rep, 2020, 10(1): 11915. DOI:10.1038/s41598-020-68882-7 |
| [16] |
向倩, 王睿. 冠状病毒感染特点与防治[J]. 中华医院感染学杂志, 2003, 13(11): 1097-1100. Xiang Q, Wang R. Characteristics of coronavirus infection and its control[J]. Chin J Nosocomiol, 2003, 13(11): 1097-1100. DOI:10.3321/j.issn:1005-4529.2003.11.043 |
| [17] |
张云智, 张海林. 白纹伊蚊吸血特性的观察[J]. 地方病通报, 1994, 9(2): 37-38. Zhang YZ, Zhang HL. Observation on specificity of bloodsucking of Aedes albopictus[J]. Endemic Dis Bull, 1994, 9(2): 37-38. |
| [18] |
张洪杰, 张金酮. 两种蚊虫在人工膜喂血装置上吸血与繁殖的观察[J]. 寄生虫与医学昆虫学报, 1997, 4(1): 39-44. Zhang HJ, Zhang JT. Observations on blood feeding and reproduction of two species of mosquitoes fed with an artificial membrane system[J]. Acta Parasitol Med Entomol Sin, 1997, 4(1): 39-44. |
| [19] |
Chen WJ, Chen ER. Fate of ingested immunoglobulin G in the mosquito Aedes aegypti (Diptera:Culicidae)[J]. Kaohsiung J Med Sci, 1990, 6(11): 606-613. |
| [20] |
吴海霞, 鲁亮, 孟凤霞, 等. 2006-2015年我国蜚蠊监测报告[J]. 中国媒介生物学及控制杂志, 2018, 29(2): 113-119. Wu HX, Lu L, Meng FX, et al. Reports on national surveillance of cockroaches in China, 2006-2015[J]. Chin J Vector Biol Control, 2018, 29(2): 113-119. DOI:10.11853/j.issn.1003.8280.2018.02.001 |
| [21] |
任东升, 吴海霞, 郭玉红, 等. 2018年全国蜚蠊监测报告[J]. 中国媒介生物学及控制杂志, 2019, 30(2): 142-145. Ren DS, Wu HX, Guo YH, et al. National vectors surveillance report on cockroaches in China, 2018[J]. Chin J Vector Biol Control, 2019, 30(2): 142-145. DOI:10.11853/j.issn.1003.8280.2019.02.006 |
| [22] |
吴海霞, 鲁亮, 孟凤霞, 等. 2006-2015年我国蝇类监测报告[J]. 中国媒介生物学及控制杂志, 2018, 29(1): 5-10. Wu HX, Lu L, Meng FX, et al. Reports on national surveillance of flies in China, 2006-2015[J]. Chin J Vector Biol Control, 2018, 29(1): 5-10. DOI:10.11853/j.issn.1003.8280.2018.01.002 |
| [23] |
吴海霞, 鲁亮, 孟凤霞, 等. 2006-2015年我国鼠类监测报告[J]. 中国媒介生物学及控制杂志, 2017, 28(6): 517-522. Wu HX, Lu L, Meng FX, et al. Reports on national surveillance of rodents in China, 2006-2015[J]. Chin J Vector Biol Control, 2017, 28(6): 517-522. DOI:10.11853/j.issn.1003.8280.2017.06.001 |
 2020, Vol. 31
2020, Vol. 31


