扩展功能
文章信息
- 潘珠, 梁秋光, 岑清泉, 黄济英, 陈冠森, 杨柳, 杨华源
- PAN Zhu, LIANG Qiu-guang, CEN Qing-quan, HUANG Ji-ying, CHEN Guan-sen, YANG Liu, YANG Hua-yuan
- 3种致病性耶尔森菌对宿主鼠的交叉免疫反应研究
- Study on cross-immune responses of three pathogenic Yersinia species to host rats
- 中国媒介生物学及控制杂志, 2020, 31(5): 540-544
- Chin J Vector Biol & Control, 2020, 31(5): 540-544
- 10.11853/j.issn.1003.8280.2020.05.008
-
文章历史
- 收稿日期: 2020-04-20
耶尔森菌属(Yersinia)有11个菌种, 其中鼠疫耶尔森菌(鼠疫菌,Y. pestis)、假结核耶尔森菌(假结核菌,Y. pseudotuberculosis)、小肠结肠炎耶尔森菌(小肠结肠炎菌, Y. enterocolitica)为人兽共患病致病菌,在世界范围内分布广泛,已知有80多种动物可被感染。3种菌具有共同的V抗原和外膜蛋白(OmpA), 且后者免疫原性较V抗原更稳定, 动物免疫反应强烈3种菌的OmpA不仅在基因水平有高度一致性, 在蛋白质一级结构具有更高的一致性,且具有种间的交叉免疫原性,动物在感染某种致病性耶尔森菌后会获得保护性免疫[1]。本研究采用假结核菌和小肠结肠炎菌对广东省鼠疫的主要和次要宿主的鼠种进行免疫, 检测该鼠种是否能抵抗鼠疫菌的攻毒, 为探讨广东省鼠疫疫源地现处于静息期的原因提供一种思路。
1 材料与方法 1.1 实验动物在广东省雷州半岛用鼠笼捕获啮齿目鼠科的黄毛鼠(Rattus losea)、黄胸鼠(R. tanezumi)和褐家鼠(R. noregicus), 分别单笼饲养7~10 d。挑选健康成年鼠, 黄毛鼠、黄胸鼠体质量在120~ 150 g之间, 褐家鼠在200~250 g之间, 通过心脏采血后分离血清用玻片凝集法测定假结核菌、小肠结肠炎菌抗体, 间接血细胞凝集法(IHA)测鼠疫菌F1抗体, 均阴性者供试。
1.2 实验菌株鼠疫菌EV76株:疫苗株, 购自兰州生物制品研究所有限责任公司(批号:201705007)。假结核菌53518、53521标准株:血清型Ⅰ、Ⅳ, 中国疾病预防控制中心传染病预防控制所赠本单位实验室保存。小肠结肠炎菌株:猪盲株、海31株为0 : 9血清型, 平36株为0:3血清型, 分离自雷州半岛鼠类或猪盲肠猪粪。攻毒菌株均经鼠类传数代以增强毒力后供试。免疫用菌株不经动物传代。
1.3 主要试剂鼠疫菌F1抗体诊断试剂盒(间接血凝法)(批号:20190201)、鼠疫菌诊断用噬菌体(批号:20181101)均为兰州生物制品研究所有限责任公司生产。
1.4 6株实验菌株的毒力和免疫性检测黄毛鼠120只,分6组, 每组20只, 其中10只免疫鼠, 10只对照鼠。6个免疫组分别用假结核菌53518、假结核菌. 53521、猪盲、海31、平36和EV76株免疫。黄胸鼠实验方法及数量同黄毛鼠。
免疫菌株分别于28 ℃赫氏溶解血培基斜面培养3代后用生理盐水麦氏比浊法制成一定浓度的菌液。每组免疫鼠分别腹腔注射相应的菌液免疫, 共4次, 每次间隔10d, 菌量分别为20、30、60和70亿。对照组同时腹腔注射同容积的生理盐水。最后1次免疫10 d后进行攻毒。每组的攻毒菌株为相应免疫菌, 即53518免疫组的攻毒菌株为53518菌株, 以此类推。53521、EV76、猪盲、海31攻毒株以预试验确定的接近最小全致死量腹腔注射, 菌量分别为每只鼠90、42.80和110亿。53518、平36株攻毒菌量为每只鼠250亿。53518.53521、EV76株攻毒时均混合0.30%枸橼酸铁铵溶液每只鼠0.3 ml。菌株培养温度均28 ℃。观察实验鼠的发病情况和死亡数。
1.5 鼠疫菌EV76株攻毒交叉免疫鼠 1.5.1 分组黄毛鼠随机分为6组:1个对照组, 5个免疫组(假结核菌53518菌株免疫组、53521菌株免疫组, 小肠结肠炎菌猪盲株免疫组海31株免疫组、平36株免疫组)。黄胸鼠随机分为2部分。第1部分黄毛鼠, 1个对照组和5个免疫组, EV76株攻毒菌量为每只鼠38亿; 第2部分1个对照组和3个小肠结肠炎菌株免疫组, 每只鼠攻毒菌量为30亿。褐家鼠随机分为1个对照组和3个小肠结肠炎菌株免疫组。
1.5.2 免疫各免疫组实验鼠分别腹腔注射相应的菌液免疫, 免疫方法如1.4所述。对照组同时腹腔注射相同容积的生理盐水。最后1次免疫10d后进行攻毒。
1.5.3 攻毒鼠疫菌EV76株, 赫氏溶解血培养基斜面连续培养3次, 每次48 h, 最后一次用生理盐水制成一定浓度的菌液, 取适量菌液与0.30%枸橼酸铁铵生理盐水溶液0.3 ml混合腹腔注射每只鼠。观察实验鼠发病情况, 死亡鼠及时解剖, 观察脏器病理变化, 取腺、肝、脾、肺、心压印分离培养鼠疫菌EV76株,并经鼠疫噬菌体裂解试验证实。攻毒14 d后存活鼠分别取全血、解剖, 观察脏器病变, 分离培养细菌。鼠血分离血清检测鼠疫F1抗体(IHA微量法)和相应免疫菌抗体(玻片凝集法)。
1.6 统计学分析用SPSS 20.0软件进行统计学分析。鼠类死亡率的比较采用X2检验或Fisher精确概率法, P < 0.05为差异有统计学意义。
2 结果 2.1 菌株毒力和免疫性试验黄胸鼠与黄毛鼠实验结果一致。假结核菌53518免疫组、小肠结肠炎菌平36免疫组被相应菌株攻毒后免疫鼠和对照鼠均未发病。假结核菌53521和小肠结肠炎菌猪盲、海31以及EV76免疫组, 经相应菌株最小全致死量攻毒后, 对照鼠全部死亡, 免疫鼠全部未发病。
2.2 交叉免疫反应试验 2.2.1 黄毛鼠黄毛鼠经假结核菌、小肠结肠炎菌免疫后鼠疫菌EV76株(28 ℃培养)25亿攻毒见表 1。假结核菌免疫组、小肠结肠炎菌免疫组和对照组死亡率相比,差异均有统计学意义(x2=18.793, P < 0.001;x2=9.000, P=0.003)。假结核菌免疫组和小肠结肠炎菌免疫组死亡率差异无统计学意义(x2= 2.533, P=0.112)。53518与53521株免疫组死亡率相比, 猪盲、海31与平36株免疫组死亡率相比, 差异均无统计学意义(均P=1.000)。攻毒后, 发病轻者松毛、弓背、不爱活动、进食少; 重者不能活动或行动不稳、颤抖、眯眼流泪、点头呼吸, 几乎均死亡。对照组发病早、症状重, 免疫组普遍发病迟、轻微或不发病, 对照组、小肠结肠炎菌组和假结核菌组平均死亡天数分别为1.77.3.33.5.50d。解剖死亡鼠, 普遍皮下充血, 肺出血或充血, 心血不凝固, 约60.00%有胸水, 个别有腹水, 约20.00%脾厚大。死亡鼠均分离出鼠疫菌EV76株, 并经鼠疫噬菌体裂解试验证实。14d后解剖存活鼠, 约20.00%脾厚大,余无明显异常, 均未分离到鼠疫菌EV76株。存活鼠鼠疫F1抗体阳性率为53.85%(28/52), 几何平均滴度为1:621.67。53518.53521和平36株采用玻片凝集法均未能检测到抗体, 猪盲株、海31株抗原性强, 抗体阳性率为100%。黄胸鼠、褐家鼠的实验结果和黄毛鼠相同。猪盲、海31株抗体几何平均滴度分别为1:344.55和1:287.35。
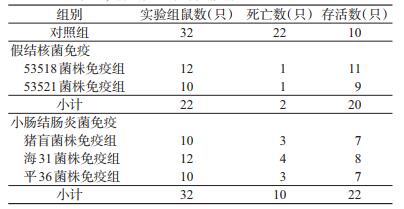
|
EV76株对每只鼠38亿攻毒, 结果见表 2。假结核菌免疫组与对照组死亡率相比, 差异有统计学意义(x2=24.350, P < 0.001), 小肠结肠炎菌免疫组与对照组死亡率比较差异无统计学意义(x2=0.000, P= 1.000),假结核菌免疫组与小肠结肠炎菌免疫组死亡率比较差异有统计学意义(x2= 29.580, P < 0.001)。53518与53521株免疫组死亡率相比, 猪盲、海31与平36株免疫组死亡率相比, 差异均无统计学意义(P=0.090, P= 1.000)。对照组、小肠结肠炎菌组和假结核菌组平均死亡天数分别为1.52、2.202.50 d。

|
黄胸鼠EV76株37 ℃培养30亿攻毒, Fisher精确概率法统计学分析, 小肠结肠炎菌免疫组与对照组死亡率相比,差异有统计学意义(P=0.004), 见表 3。猪盲、海31与平36株免疫组死亡率比较, 差异无统计学意义(P=0.310)。对照组平均死亡天数为4.20 d, 免疫组仅1例死亡,死亡天数为1 d。

|
2种菌量攻毒下黄胸鼠发病、解剖情况同黄毛鼠。存活鼠F1抗体阳性率为29.82%(17/57), 几何平均滴度为1:220.67。猪盲、海31株抗体几何平均滴度分别为1:675.59和1:3 010.02。
2.2.3 褐家鼠EV76株37 ℃培养35亿攻毒, 小肠结肠炎菌免疫组与对照组死亡率比较, 差异有统计学意义(x2=15.384, P < 0.001), 见表 4。猪盲、海31与平36株免疫组死亡率差异无统计学意义(P= 1.000)。对照组平均死亡天数为1.83 d, 免疫组死亡1例, 死亡天数为1d。发病解剖情况同黄毛鼠。存活鼠F1抗体阳性率为48.48%(16/33), 几何平均滴度为1:891.44;猪盲、海31株抗体几何平均滴度分别为1:1105.98和1:3010.02。
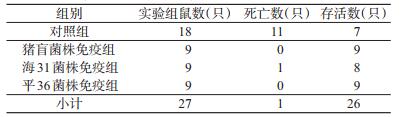
|
黄胸鼠、黄毛鼠和褐家鼠是广东省鼠类的优势种或常见种, 也是广东省鼠疫的主、次要宿主。小肠结肠炎菌3个菌株,其血清型O:3、0:9是本省分离该菌种的基本血清型。因而本实验所选鼠类和菌株均具有较强的代表性。疫源地中鼠疫菌在宿主一媒介间传播, 长期在自然界循环延续, 37和28℃均为宿主媒介的可能存在温度, 37 ℃培养的鼠疫菌多; 为毒力因子F1[2], 毒力较28℃培养更强, 因而本研究选择耐受较强毒力的黄胸鼠、褐家鼠作为37℃培养菌的攻毒实验对象, 2种培养温度对实验无明显区别。本实验研究表明:(1)鼠类被1种菌有效免疫后,可以获得对该种菌强而有力的免疫力, 表明本实验对鼠类的免疫方法是有效和合适的。(2)假结核菌免疫鼠耐受鼠疫菌的攻击, 有较强的交叉免疫保护作用; 小肠结肠炎菌O:3和O:9血清型免疫也有一定的交叉免疫保护作用, 这与小肠结肠炎菌、假结核菌和鼠疫菌这3种菌的亲缘关系相一致。根据DNA-DNA杂交结果, 小肠结肠炎菌与鼠疫菌、假结核菌的同源性为43%~64%[3]。有研究表明, 鼠疫菌由假结核菌进化而来, 已有数千年的历史,经全基因组序列比较, 假结核菌IP32953与鼠疫菌C092和KIM之间在核苷酸水平上同源性为83%[4]。
有学者认为动物的耶尔森菌感染只限于初次感染, 所获得的免疫力可使动物不再感染其他耶尔森菌[5]。从本实验看, 耶尔森菌不仅限于初次感染, 是否再感染与动物曾获得的免疫力强弱、再感染菌株的毒力、数量、感染途径和个体差异等因素密切相关。在感染过假结核菌和小肠结肠炎菌的鼠类中, 获得的免疫力对其抵抗鼠疫菌的侵袭确有一定的保护作用, 其中以假结核菌的保护作用为强。因而在鼠疫疫源地中, 鼠疫主、次宿主等动物是否广泛感染过假结核菌、小肠结肠炎菌, 可能成为阻止、延缓鼠疫流行的一个重要因素。一些耶尔森菌的流行病学调查及与鼠疫疫源地的相关关系推测也印证了这个观点。在世界鼠疫第三次大流行期间, 欧洲和日本由于其他病原性耶尔森菌广泛分布在动物中, 因而阻止了鼠疫的流行[5]。我国甘宁黄土高原鼠疫自然疫源地鼠类小肠结肠炎菌携带率高, 阻止了鼠疫的流行而内蒙古鼠疫自然疫源地的家鼠野鼠小肠结肠炎菌和假结核菌的携带率都低, 未能阻止鼠疫流行[5]。2009年浙江省温州市鼠疫疫源地鼠类耶尔森菌检出率为11.79%, 其中小肠结肠炎菌占79.01%, 假结核菌占2.47%, 疫源地处于静息期[6]。2013- 2014年在云南省剑川县野鼠鼠疫疫源地鼠类小肠结肠炎菌分离率为5.27%, 推测与鼠疫的相对静息相关[7]。2013-2015年对我国西南三省交界处静息鼠疫疫源地的监测发现, 同一疫源地内的动物感染鼠疫菌与感染小肠结肠炎菌、假结核菌呈现此消彼长特征, 在更大范围佐证了致病性耶尔森菌的交叉免疫学说[8]。
广东省鼠疫流行历经87年(1866-1952年)之久,1953年起未发现鼠疫病例, 也未分离到鼠疫菌。1973-1987年从鼠类检出鼠疫F1抗体阳性40份, F1抗原阳性3份, 从猫中检出F1抗体阳性1份[9]。此后历年的鼠疫监测中均没有再检出F1抗原、抗体阳性, 广东省鼠疫疫源地现处于静息期。1991年在湛江市进行的人和动物假结核病血清学(IHA法)调查发现,鼠类阳性率为8.99%(161/1 789), 牛血清阳性率为5.02%(12/239)[10]。2005年在广东省进行了小肠结肠炎菌、假结核菌的流行病学调查, 在鼠疫疫源地内从黄胸鼠分离到假结核菌1株, 从鼠类及猪粪、蚤等分离到小肠结肠炎菌61株(O:3血清型40株, 0:9血清型21株); 非疫源地从鼠类分离出小肠结肠炎菌2株、中间型耶尔森菌1株[11], 表明广东省动物间小肠结肠炎菌感染普遍。广东省鼠疫疫源地处于静息期除了环境治理和灭鼠灭蚤外, 疫源地内鼠类等动物普遍感染过小肠结肠炎菌、假结核菌等耶尔森属菌也是一个重要因素。
在28 ℃培养的EV76:株毒力较稳定, 37 ℃培养毒力不稳定。3个鼠种中, 耐受攻毒菌量有区别, 褐家鼠与黄胸鼠耐受菌量接近, 但褐家鼠稍高, 应该与其体质量较重有关, 黄毛鼠明显耐受菌量较低。
这3种耶尔森菌中, 53518、平36菌株对鼠类无致病力, 未检测到抗体,但53518与53521株对鼠类的交叉免疫保护作用相同,平36与海31、猪盲株的交叉免疫保护作用相同。有报道指出, O:8血清型小肠结肠炎菌对小白鼠抵抗鼠疫菌感染没有交叉免疫保护作用[12], 因而哪些血清型的小肠结肠炎菌会有一定的交叉免疫保护作用,以及耶尔森菌属中其他没有致病力的菌种是否可对动物抵御鼠疫菌的侵袭有交叉免疫保护作用, 尚需更多实验和流行病学调查证实。
| [1] |
陈妤煌.致病性耶尔森菌外膜蛋白A同源性分析及免疫学特征研究[D].北京: 中国疾病预防控制中心, 2016. Chen YH. Homology analysis and immunological characters study of OmpA from pathogenic Yersinia[D]. Beijing: Chinese Center for Disease Control and Prevention, 2016. |
| [2] |
杨华源, 刘小华, 张曼碧, 等. 鼠疫菌EV株免疫球蛋白反向血凝试验的敏感性和特异性试验[J]. 热带医学杂志, 2005, 5(5): 614-616. Yang HY, Liu XH, Zhang MB, et al. Sensitivity and specificity of the detection of immunoglobulin of Yersinia pestis EV strsin by RIHA test[J]. J Trop Med, 2005, 5(5): 614-616. DOI:10.3969/j.issn.1672-3619.2005.05.016 |
| [3] |
汪华, 景怀琦, 朱凤才, 等. 小肠结肠炎耶尔森菌[M]. 北京: 人民出版社, 2004: 4. Wang H, Jing HQ, Zhu FC, et al. Yersinia enterocolitica[M]. Beijing: People Publishing House, 2004: 4. |
| [4] |
申小娜, 海荣, 俞东征. 鼠疫菌基因组学研究进展[J]. 疾病监测, 2009, 24(6): 440-445. Shen XN, Hai R, Yu DZ. Developments in genomic study of Yersinia pestis[J]. Dis Surveil, 2009, 24(6): 440-445. DOI:10.3784/j.issn.1003-9961.2009.06.019 |
| [5] |
谷爱娣, 樊振亚. 3种对人致病性耶尔森氏菌生物学特性及流行病学意义[J]. 中国地方病防治杂志, 2001, 16(4): 218-222. Gu AD, Fan ZY. The biological characteristics and epidemiological significance of three pathogenic Yersinia[J]. Chin J Control Endem Dis, 2001, 16(4): 218-222. DOI:10.3969/j.issn.1001-1889.2001.04.011 |
| [6] |
张孝和, 陈祎, 倪庆翔, 等. 浙江省温州市鼠疫静息期鼠类携带耶尔森菌调查分析[J]. 疾病监测, 2010, 25(9): 744-745. Zhang XH, Chen Y, Ni QX, et al. Survey on the carriage of Yersinia in rodents in silent period of plague in Wenzhou[J]. Dis Surveil, 2010, 25(9): 744-745. DOI:10.3784/j.issn.1003-9961.2010.09.024 |
| [7] |
陈双艳, 郭英, 张海鹏, 等. 2013-2014年云南省剑川县野鼠鼠疫疫源地小肠结肠炎耶尔森菌的调查分析[J]. 疾病监测, 2016, 31(2): 141-144. Chen SY, Guo Y, Zhang HP, et al. Investigation of Yersinia enterocolitica in wild plague foci in Jianchuan, Yunnan[J]. Dis Surveil, 2016, 31(2): 141-144. DOI:10.3784/j.issn.1003-9961.2016.02.013 |
| [8] |
段然, 梁俊容, 张婧, 等. 我国西南3省交界处静息鼠疫疫源地致病性耶尔森菌研究[J]. 中国媒介生物学及控制杂志, 2017, 28(3): 241-243, 261. Duan R, Liang JR, Zhang J, et al. Research on pathogenic Yersinia within natural plague focus during rest periods on the border of three provinces in Southwest of China[J]. Chin J Vector Biol Control, 2017, 28(3): 241-243, 261. DOI:10.11853/j.issn.1003.8280.2017.03.011 |
| [9] |
沈荣煊, 邓峰, 刘铭泉, 等. 广东鼠疫[M]. 广州: 广东科技出版社, 2005: 110-119. Shen RX, Deng F, Liu MQ, et al. Guangdong plague[M]. Guangzhou: Guangdong Science & Technology Press, 2005: 110-119. |
| [10] |
刘小华, 杨华源, 梁秋光, 等. 湛江市人和动物假结核病血清学调查[J]. 中国人兽共患病杂志, 1997, 13(5): 71. Liu XH, Yang HY, Liang QG, et al. Serological investigation of human and animal pseudotuberculosis in Zhanjiang city[J]. Chin J Zoonoses, 1997, 13(5): 71. |
| [11] |
杨华源, 梁秋光, 曾敏, 等. 广东鼠疫静息期小肠结肠炎、假结核耶尔森氏菌流行病学调查[J]. 中国地方病防治杂志, 2009, 24(5): 341-342. Yang HY, Liang QG, Zeng M, et al. Epidemiological survey on Yersinia enterocolitica and Y. pseudotubercolosis of plague static phase in Guangdong[J]. Chin J Control Endem Dis, 2009, 24(5): 341-342. |
| [12] |
Mazigh D, Quilici ML, Mollaret HH. Role of the virulence-associated plasmids of Yersinia enterocolitica on its immunogenicity against Y. pestis[J]. Ann Microbiol, 1984, 135(3): 283-290. DOI:10.1016/S0769-2609(84)80095-2 |
 2020, Vol. 31
2020, Vol. 31

