扩展功能
文章信息
- 杨瑞军, 黄世腾, 吕磊, 曹国平, 游佳玲, 万圣
- YANG Rui-jun, HUANG Shi-teng, LYU Lei, CAO Guo-ping, YOU Jia-ling, WAN Sheng
- 浙江省衢州市2019年本地登革热暴发疫情的分子流行病学研究
- Molecular epidemiological study of local dengue outbreak in Quzhou, Zhejiang province, China, 2019
- 中国媒介生物学及控制杂志, 2020, 31(5): 521-525
- Chin J Vector Biol & Control, 2020, 31(5): 521-525
- 10.11853/j.issn.1003.8280.2020.05.004
-
文章历史
- 收稿日期: 2020-04-10
登革热是由登革病毒(Dengue virus)引起, 经伊 蚊叮咬而传播的一种以发热、皮疹和全身疼痛为主 要症状的急性传染病[1], 广泛流行于全球热带及亚 热带地区[2-3), 是东南亚地区儿童死亡的主要原因之 一[4]。在我国, 登革热主要分布于广东、海南、广西、福建、台湾等南方及东南沿海各省(自治区)[5-7], 浙 江省杭州市于2017年[8]、义乌市于2009年[9]发生由 输人性病例引起的登革热疫情。素有“四省通衢,五路总头”之称的衢州市于2017年发现1例输入性 病例[10], 并于2019年暴发了一起由本地病例引起的 登革热疫情。为了对该起疫情病例及时做出实验 室确诊, 分析毒株的基因变异和种系进化特征, 从 分子水平追踪传染源, 对采集的患者血清标本, 进行 了登革热血清学、病原学和分子生物学特征研究。
1 材料与方法 1.1 病例来源2019年10月30日晚,衢州市疾病 预防控制中心(CDC)确诊1例本地登革热病例, 调 查人员立刻前往该病例所在村庄开展流行病学调 查, 10月31日至11月3日经现场搜索后又发现7例 确诊病例, 累计报告8例登革热确诊病例,基本确认 是一起登革热暴发疫情。
1.2 病例血清标本采集经患者知情同意后无菌 采集血液标本5ml, 专车冷链送至衢州市CDC实验 室, 分离血清立即进行检测,多余的血清标本置 于-80 C低温保存。
1.3 抗原检测应用胶体金方法对血清样本进行 登革病毒NS1抗原检测, 试剂购于澳大利亚Panbio 有限公司, 在有效期内使用,详细的操作说明及结果 判定都严格按照试剂说明书进行。
1.4 病毒核酸检测病毒核酸的提取严格按照 MagMAX-96病毒核酸抽取试剂盒使用说明书进行,取样200 μl, 最终洗脱至80μl, 作为模板。采用浙 江省CDC微生物检验所下发的引物和探针, 采用实 时荧光定量PCR(RT-qPCR)方法进行登革病毒核 酸检测, 具体参照登革热诊断标准WS216-2018附 录A[11]。
1.5 E基因扩增参考文献12]设计引物, 试剂采 用宝生物工程(大连)有限公司one Step RNA PCR Kit (Code No: DRR024A), 严格按试剂说明书进行。反应条件:42 ℃ 30 min反转录, 94 ℃ 2 min后, 94 ℃ 30s,51 ℃ 30s,72 ℃ 2min, 循环40次;72 ℃延 伸8min。取扩增产物5μl, 用1.5%琼脂糖凝胶电 泳, 根据Marker位置确认反应产物。
1.6 序列测定与分析采用PCR扩增产物纯化后 直接测序, 由.上海伯杰生物科技有限公司完成。采 用MAFFT 7.0软件对序列进行比对, 核苷酸和氨基 酸相似性分析采用DNAStar 7.1软件, 进化树的构建 采用MEGA 7.0.14软件最大似然法。
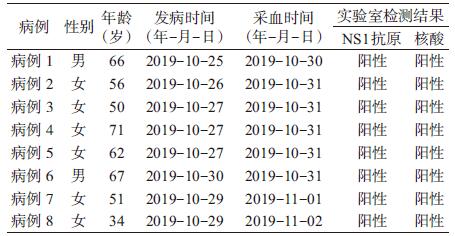
2 结果 2.1 基本情况指示病例余某, 10月25日晚自觉 畏寒、乏力, 于10月26日,上午到当地卫生室就诊(最 高时体温39.3 ℃), 给予输液治疗2d, 未好转。10 月29日下午到衢州市人民医院呼吸内科就诊, 检测 白细胞计数1.8 × 109/L, 血小板4.9 × 109/L, 10月30 日病毒NSI抗原阳性, 以疑似登革热收治到分院住 院,当晚衢州市CDC检测登革病毒核酸阳性, 血清 型为Ⅰ型。截止到11月3日, 疫情得到有效控制, 本 起疫情实验室共确诊8例。
2.2 实验室结果 2.2.1 抗原、核酸检测应用胶体金免疫层析法对 8例病例血清标本进行登革病毒NS1抗原检测, 结 果均为阳性;同时对标本血清核酸进行登革病毒型 特异性RT-qPCR法测定, 检测为登革病毒1型。病 例相关信息见表 1。
|
本次采用衢州市8株登革 病毒1型的E基因核苷酸序列,与来自GenBank中 不同国家和地区的35株不同基因型代表株相应区 段核苷酸序列MEGA 7.0.14软件最大似然法构建系 统进化树, 如图 1显示,8株毒株均聚集在登革病毒. 基因Ⅰ型进化支中, 且与JF960228(2010年新加坡 分离株)亲缘性最近。

|
| 注:●代表8株衢州分离株;其他为从GenBank下载的参考毒株。 图 1 2019年浙江省衢州市8株登革病毒与35株登革病毒1型参考株的E区核苷酸序列系统进化分析 Figure 1 Phylogenetic analysis based on the envelope gene sequence of 8 dengue type 1 virus (DENV - -1) strains isolated from Quzhou in 2019 and 35 DENV-1 strains from GenBank |
| |
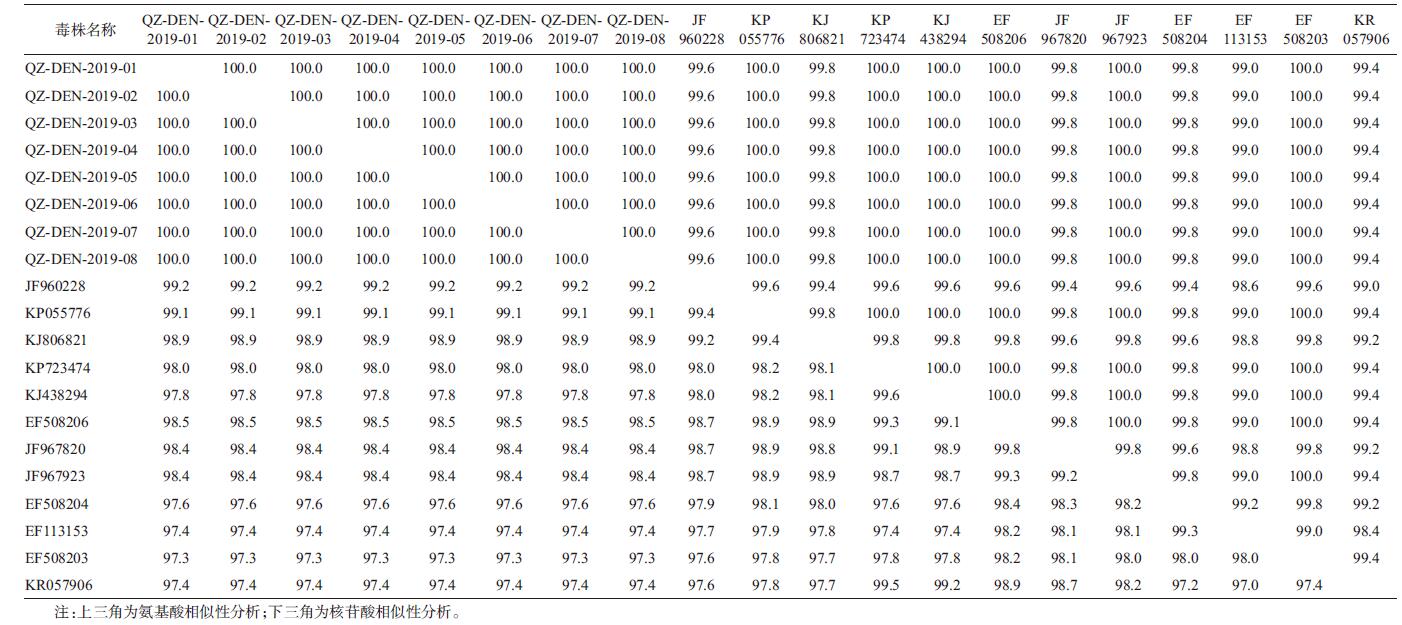
采用DNAStar 7.1软件中 MegAlign对项目中的20条序列进行核苷酸和氨基 酸相似性分析。表 2显示, 衢州地区8株登革病毒核 苷酸和氨基酸同源性均为100%, 说明他们均为同 一株病毒。衢州地区8株病毒与JF960228(新加坡,2010)核苷酸相似性最高,为99.1%, 与KR057906 (中国广州, 2014)核苷酸相似性最低, 为97.4%。衢 州地区8株病毒与KP055776(中国中山, 2014)、KP723474(中国广州, 2014)、KJ438294(中国广“州,2013)、JF967923(泰国, 2010)和EF508203(中国广 州, 2006)氨基酸相似性最高, 均为100%, 与 EF113153(中国广州, 2006)氨基酸相似性最低, 为 99.0%。
|
对8株登革病毒与12株同 型参考株进行E蛋白氨基酸位点差异分析显示, 仅 在E基因的毒力位点区域发现了1处氨基酸变异,为E基因Ⅰ区中的V6I。Ⅱ和Ⅲ区未发现氨基酸的 变异。
3 讨论根据本次疫情确诊的8例病例临床表现、流行 病史和实验室诊断, 判定其为-起本地登革热暴发 疫情的可能性较大, 传染来源不详。分析如下:①8例 病例发病前1个月均未离开过衢州市, 基本上在同 一村庄活动, 均属于本地病例;②该村庄户籍人口 1 700人,实际居住人口超过4 000人,村中人员流动 性大, 出租户多, 人员密集, 难以确认具体的传染来 源;③近期雨水偏多, 高温、高湿, 非常有利于白纹伊 蚊(Aedes albopictus)(登革病毒的主要媒介)的生长 繁殖;④截止到11月3日,衢州市2019年已报告约 20例输人性登革热病例, 较2018年上升600%, 病例 主要来自柬埔寨、越南、印度尼西亚等东南亚流行地 区,分布于衢州市下辖的各县(市、区) ;⑤该村庄环 境复杂, 村中多处废弃房屋, 垃圾乱堆, 杂草丛生, 蚊 媒密度高;10月31日监测显示, 布雷图指数仍高达 18, 叮咬指数3只/(人.h), 极有可能是村中流动人 员感染登革病毒而未及时发现, 导致村中出现暴发 疫情。
目前, 最广为接受的登革病毒基因分型使用的 基因区域是E基因区域。根据病毒包膜蛋白E的抗 原性不同, 将登革病毒分为4个血清型(1~4型)。据报道, 2007年在马来西亚沙捞越1名37岁的农民 身体上又发现了5型登革病毒血清型(森林型)[13], 但其中尤以登革病毒1型流行较为广泛[14]。将衢州 市本起暴发疫情与来自GenBank中不同国家和地区 的病毒代表株进行比较并构建系统进化树, 发现 8株毒株均聚集在登革病毒1型的Genotype Ⅰ中,与 JF960228互为姐妹群, 且与JF960228核苷酸及氨基 酸相似性较高;同时, 对E蛋白氨基酸位点差异进行 分析, 发现在E基因的毒力位点区域有1处氨基酸 变异, 为EⅠ区中的V6I, Ⅱ和Ⅲ区未发现氨基酸变 异。本次衢州病毒株为登革病毒1型GⅠ亚型, 与 新加坡2010年分离的病毒株(序列号JF960228)亲 缘关系最近, 其同源性也相对较高, 据此推测病毒株 来源于新加坡等东南亚国家的可能性较大。
衢州市位于浙江省西部, 钱塘江上游, 以山地丘 陵地带为主, 生态良好, 森林覆盖率达71.5%。近年 来衢州市蚊媒监测发现,主要蚊种有淡色库蚊 (Culex pipiens pallens) 、致倦库蚊(Cx. pipiens quinquefasciatus)、骚扰阿蚊(Armigeres subalbatus)、中华按蚊(Anopheles sinensis)、三带喙库蚊(Cx. tritaeniorhynchus)和白纹伊蚊, 这些蚊种的存在, 提 示衢州市存在登革热等蚊媒传染病的传播风险。同 时, 衢州市的气候条件以及人们的生活环境适宜蚊 虫孳生, 大大增加了人类同蚊媒的接触机会, 也增加 了登革热等蚊媒传染病的发病概率。
随着改革开放和招商引资的进一步发展, 国际商 贸、劳务、旅游活动、探亲访友等越来越频繁, 尤其是 与疫情流行国家及地区人员之间的往来,增加了登革 病毒传播的潜在风险;该病病情-般轻微, 但易误诊, 诊治不及时, 易引起扩散, 导致暴发流行。因此要密 切注意境外疫情动态, 加强对来自登革热疫区人员的 观察, 尽早发现病例并立即进于流彳病学应急处置及 采样检测, 做好蚊虫杀灭工作, 防止疫情扩散蔓延。
| [1] |
张拥军, 吴生根, 王金章, 等. 福建省2015年本地登革热病例的病原学特征[J]. 中国人兽共患病学报, 2019, 35(1): 28-33. Zhang YJ, Wu SG, Wang JZ, et al. Etiological characterization of indigenous dengue cases in Fujian province,2015[J]. Chin J Zoonoses, 2019, 35(1): 28-33. DOI:10.3969/j.issn.1002-2694.2018.00.210 |
| [2] |
范建华, 冯云, 朱进, 等. 2017年云南省西双版纳州登革1型病毒暴发疫情的调查研究[J]. 疾病监测, 2019, 34(5): 427-434. Fan JH, Feng Y, Zhu J, et al. Investigation on an outbreak of dengue serotype 1 virus in Xishuangbanna prefecture of Yunnan province,China,2017[J]. Dis Surveill, 2019, 34. DOI:10.3784/j.issn.1003-9961.2019.05.013 |
| [3] |
薛志静, 王君, 宋秀平, 等. 登革热病毒分子生物学特性及检测方法研究进展[J]. 中国媒介生物学及控制杂志, 2019, 30(2): 224-227. Xue ZJ, Wang J, Song XP, et al. Research progress in molecular biological characteristics and detection methods of dengue virus[J]. Chin J Vector Biol Control, 2019, 30(2): 224-227. DOI:10.11853/j.issn.1003.8280.2019.02.027 |
| [4] |
Prommalikit O, Thisyakorn U. Dengue virus virulence and diseases severity[J]. Southeast Asian J Trop Med Public Health, 2015, 46 Suppl 1: S35-42. |
| [5] |
WHO. Dengue and severe dengue[EB/OL]. (2015-05-01)[2015-08-24].http://www.who.int/mediacentre/factsheets/fs117/en/.
|
| [6] |
Wu WL, Bai ZJ, Zhou HQ, et al. Molecular epidemiology of dengue viruses in southern China from 1978 to 2006[J]. Virol J, 2011, 8(1): 322. DOI:10.1186/1743-422X-8-322 |
| [7] |
胡挺松, 刘永华, 张海林, 等. 云南省瑞丽市2016年登革病毒包膜蛋白基因进化特征分析[J]. 病毒学报, 2017, 33(6): 854-860. Hu TS, Liu YH, Zhang HL, et al. Phylogenetic analyses of the envelope protein genome of four serotypes of the dengue virus in Ruili city of Yunnan province,China in 2016[J]. Chin J Virol, 2017, 33(6): 854-860. DOI:10.13242/j.cnki.bingduxuebao.003256 |
| [8] |
祝绯飞, 袁寒艳, 王芝敏, 等. 2017年浙江省杭州市拱墅区登革热暴发疫情调查分析[J]. 疾病监测, 2019, 34(5): 422-426. Zhu FF, Yuan HY, Wang ZM, et al. Survey of an outbreak of dengue fever in Gongshu district of Hangzhou,2017[J]. Dis Surveill, 2019, 34(5): 422-426. DOI:10.3784/j.issn.1003-9961.2019.05.012 |
| [9] |
严菊英, 张严峻, 茅海燕, 等. 2009年浙江省义乌市登革热暴发疫情实验诊断和病原分子溯源[J]. 中华预防医学杂志, 2010, 44(12): 1091-1096. Yan JY, Zhang YJ, Mao HY, et al. Diagnosis of a dengue fever outbreak in Yiwu city,Zhejiang province in 2009 and its molecular tracing of the pathogen[J]. Chin J Prevent Med, 2010, 44(12): 1091-1096. DOI:10.3760/cma.j.issn.0253-9624.2010.12.007 |
| [10] |
杨瑞军, 黄世腾, 王晓光, 等. 浙江省衢州市1例输入性登革热病例分子流行病学研究[J]. 中国媒介生物学及控制杂志, 2018, 29(5): 445-447,487. Yang RJ, Huang ST, Wang XG, et al. Molecular epidemiological studies on an imported dengue fever case in Quzhou city,Zhejiang[J]. Chin J Vector Biol Control, 2018, 29(5): 445-447,487. DOI:10.11853/j.issn.1003.8280.2018.05.006 |
| [11] |
国家卫生和计划生育委员会. WS 216-2018登革热诊断[S]. 北京:中国标准出版社,2018. National Health and Family Planning Commission of People's Republic of China. WS 216-2018 Diagnosis for dengue fever[S]. Beijing:China Standard Press,2018. |
| [12] |
严菊英, 周佳悦, 楼秀玉, 等. 浙江省2013年输入性登革热病例病原分子溯源[J]. 中国媒介生物学及控制杂志, 2015, 26(1): 23-27. Yan JY, Zhou JY, Lou XY, et al. Molecular tracing of pathogen from patients with imported dengue fever in Zhejiang province,China,2013[J]. Chin J Vector Biol Control, 2015, 26(1): 23-27. DOI:10.11853/j.issn.1003.4692.2015.01.006 |
| [13] |
Mustafa MS, Rasotgi V, Jain S, et al. Discovery of fifth serotype of dengue virus (DENV-5):a new public health dilemma in dengue control[J]. Med J Armed Forces India, 2015, 71(1): 67-70. DOI:10.1016/j.mjafi.2014.09.011 |
| [14] |
Villabona-Arenas CJ, De Andrade Zanotto PM. Worldwide spread of dengue virus type 1[J]. PLoS One, 2013, 8(5): e62649. DOI:10.1371/journal.pone.0062649 |
 2020, Vol. 31
2020, Vol. 31

