扩展功能
文章信息
- 孔庆鑫, 韦凌娅, 沈林海, 王英红, 曹阳
- KONG Qing-xin, WEI Ling-ya, SHEN Lin-hai, WANG Ying-hong, CAO Yang
- 双链RNA饲喂干扰家蝇CYP6D1基因表达方法的建立
- Establishment of a method for interfering with CYP6D1 gene expression in Musca domestica by feeding dsRNA
- 中国媒介生物学及控制杂志, 2020, 31(4): 430-432
- Chin J Vector Biol & Control, 2020, 31(4): 430-432
- 10.11853/j.issn.1003.8280.2020.04.010
-
文章历史
- 收稿日期: 2020-02-14
随着拟除虫菊酯类杀虫剂的广泛使用,蝇类拟除虫菊酯抗药性水平不断提升[1-3]。2004年以来杭州市家蝇对溴氰菊酯及氯氰菊酯等杀虫剂一直处于高抗水平[4]。监测显示杭州市家蝇拟除虫菊酯抗性相关基因CYP6D1基因的mRNA表达量是敏感品系的50.7倍,提示其高抗性可能与CYP6D1基因表达量增加有关[5],但一直缺乏直接证据。
RNA干扰技术(RNAi)是研究基因功能常用技术,可诱导目标基因沉默[6]。该技术通过人工合成外源的小干扰RNA(siRNA)或者直接以目标基因为模板合成长双链RNA(dsRNA)[7],并采用显微注射、饲喂、浸泡等方法导入昆虫体内,对目标基因表达进行干扰[8-10]。其中饲喂导入dsRNA方法因其操作简便,适于多批次高通量干扰等优点,在昆虫抗药性研究领域应用较广[11]。
本研究通过体外表达产生家蝇CYP6D1基因的dsRNA,以人工饲喂法将其导入到家蝇体内,并对干扰效果进行评价,为家蝇拟除虫菊酯抗性机制研究提供支撑。
1 材料与方法 1.1 试剂RNeasy Mini Kit试剂盒(批号:157047290,德国Qiagen公司)、QuantiTect Reverse Transciption Kit(批号:154046607,德国Qiagen公司)、Multiplex PCR Kit(批号:151023967,德国Qiagen公司)。载体质粒L4440、宿主菌株大肠埃希菌DH5α、表达宿主菌株大肠埃希菌HT115(DE3)均购自湖南丰晖生物科技有限公司。
1.2 仪器冰冻破碎仪(型号:Tissue LyserⅡ,德国Qiagen公司)、自动核酸提取仪(型号:QIAcube,德国Qiagen公司)、Real-time PCR仪(型号:Rotor-Gene Q,德国Qiagen公司)、微量移液器(型号:Pipetman P10~P1000,法国Gilson公司)、高速冷冻离心机(型号:5427 R,德国Eppendorf公司)。
1.3 试虫家蝇杭州拟除虫菊酯抗性品系为本实验室筛选所得。家蝇实验室饲养环境条件为25℃,相对湿度70%,饲养至羽化后1~2d(体重约18~20mg/只)用于RNA干扰实验。
1.4 CYP6D1基因干扰 1.4.1 CYP6D1基因dsRNA制备重组质粒构建及转化由上海吉玛制药技术有限公司完成。化学合成家蝇CYP6D1基因序列(Accession number:AF081288),并连接入载体质粒L4440。转化入感受态宿主菌株大肠埃希菌DH5α,筛选阳性克隆,进行扩大培养,抽提质粒。将抽提后的质粒转化到大肠埃希菌HT115(DE3)。转化后菌液涂布于LB平板(含100.0 mg/L氨苄青霉素和12.5 mg/L四环素)37℃培养14h。筛选单菌落,接种到100 ml LB液体培养基37℃扩大培养至A600=0.5,加入异丙基-D-硫代半乳糖苷(IPTG)至终浓度0.4 mmol/L诱导培养4 h,作为处理组菌液待用。未进行质粒L4440转化的大肠埃希菌菌株HT115(DE3)作为对照。
1.4.2 干扰RNA的导入分别将100ml处理组及对照组菌液10000×g离心2 min,收集菌体,加入150 ml无菌水,充分震荡,使菌体重悬。为便于判断家蝇是否进食重悬菌液,在重悬菌液内加入0.2ml蓝色食用色素。重悬的菌液作为家蝇饮用水对羽化1~2d的家蝇饲喂3d。处理组、对照组实验均重复3次。
1.4.3 RNA干扰效果评价将饲喂后的处理组和对照组家蝇冷冻处死,挑选腹部蓝色个体检测CYP6D1基因mRNA的表达量。mRNA的表达量检测方法采用本实验室已发表的2-△△Ct的方法,gapdh基因作为内参基因[5]。每个样品重复测量3次。
1.5 数据处理采用SPSS 20.0软件进行数据处理,采用χ2检验比较处理组、对照组家蝇存活率,t检验用于比较处理组、对照组RNA干扰效果之间的差异,P<0.05表示差异有统计学意义。
2 结 果 2.1 饲喂对家蝇存活的影响对照组以无菌水作为饮水来源,处理组以重悬后的菌液为饮水来源,两组均以奶粉为饲料,连续喂养3 d,处理组、对照组均未出现大量死亡。其中处理组总存活率为88.0%,对照组为89.2%,差异无统计学意义(χ2=0.412,P=0.512)。
2.2 相对定量标准曲线取单只抗性品系家蝇提取总RNA,经反转录获得cDNA模板。按100、10-1、10-2、10-3、10-4进行梯度稀释,稀释后的模板通过荧光定量PCR扩增CYP6D1基因及gapdh基因。根据所得达到设定荧光阈值的循环数与稀释度的常用对数绘制标准曲线,结果显示2个基因标准曲线R2值均>0.99,扩增效率M值均在0.90~1.10之间,可用于CYP6D1基因相对定量计算,见图 1。
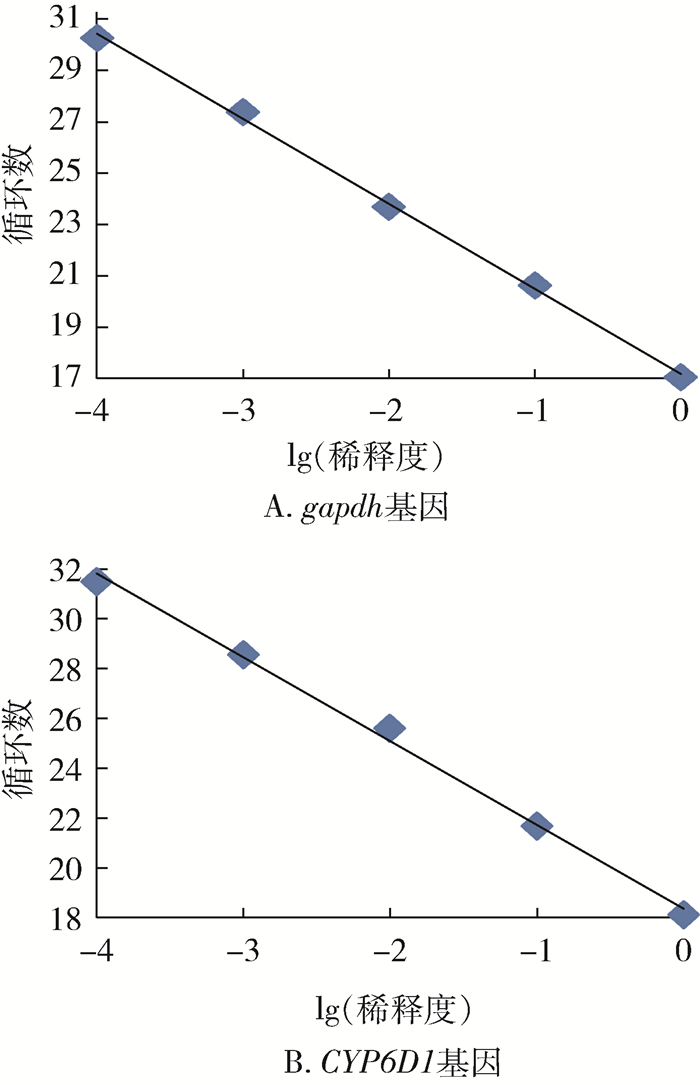
|
| 注:A标准曲线方程为y=-3.3172x+17.168,相关系数平方值(R2)为0.9988,扩增效率(M)为1.00;B标准曲线方程为y=-3.3643x+18.355,相关系数平方值(R2)为0.9962,扩增效率(M)为0.98。 图 1 荧光定量标准曲线 Figure 1 Standard curve for fluorescence quantification |
| |
经大肠埃希菌饲喂72 h后荧光定量PCR检测家蝇mRNA表达量变化,结果显示对照组表达量为1时,处理组相对表达量为0.599(n=3,s=0.061),处理组CYP6D1基因mRNA相对表达量较对照组下降了40.1%,两者之间差异具有统计学意义(t=-11.377,P=0.008)。
3 讨 论家蝇CYP6D1蛋白已被证实其超表达与家蝇拟除虫菊酯抗性有关[12]。Gao等[13]发现家蝇抗性品系LPR中CYP6D1基因启动子插入了15 bp的基因片段,认为该突变可导致其超表达。Pan等[14]研究发现抗性家蝇品系中可多种抗性机制并存,并验证了CYP6D1基因启动子中15bp基因片段的插入与CYP6D1基因超表达不一定存在必然联系。鉴于家蝇抗性机制复杂性和不确定性,建立家蝇CYP6D1基因RNAi方法将有助于其抗性机制研究。
本研究选择饲喂导入CYP6D1基因dsRNA表达宿主细菌主要基于以下考虑:(1)表达宿主菌大肠埃希菌HT115(DE3)为RNaseⅢ缺陷型,dsRNA其体内不会被降解,可不断富集。导入家蝇体内后被其消化系统裂解,释放的dsRNA在家蝇RNA酶的作用下随机降解成小RNA片段,产生RNA干扰效应。(2)表达宿主菌的保存较于纯化的dsRNA或siRNA更加方便,利于后期推广应用。(3)饲喂导入法更接近于自然状态,较其他导入方式简便,对虫体损伤小,可批量处理。处理组CYP6D1基因的mRNA的相对表达量较对照组下降了40.1%,显示本研究所建立的干扰方法已产生干扰效应。但相对表达量下降率较低,提示所建立的RNA干扰方法还存在一定不足,后期我们会在导入方式、导入剂量、效应时间等方面进一步筛选和优化,提升干扰效果。
| [1] |
Freeman JC, Ross DH, Scott JG. Insecticide resistance monitoring of house fly populations from the United States[J]. Pestic Biochem Physiol, 2019, 158: 61-68. DOI:10.1016/j.pestbp.2019.04.006 |
| [2] |
Khan HAA, Akram W, Fatima A. Resistance to pyrethroid insecticides in house flies, Musca domestica L., (Diptera:Muscidae) collected from urban areas in Punjab, Pakistan[J]. Parasitol Res, 2017, 116(12): 3381-3385. DOI:10.1007/s00436-017-5659-8 |
| [3] |
Scott JG. Evolution of resistance to pyrethroid insecticides in Musca domestica[J]. Pest Manag Sci, 2017, 73(4): 716-722. DOI:10.1002/ps.4328 |
| [4] |
韦凌娅, 孔庆鑫, 陈冰冰, 等. 杭州市家蝇对常用卫生杀虫剂的抗药性研究[J]. 中国媒介生物学及控制杂志, 2017, 28(5): 451-453. Wei LY, Kong QX, Chen BB, et al. Resistance of Musca domestica to commonly used insecticides in Hangzhou city, Zhejiang province[J]. Chin J Vector Biol Control, 2017, 28(5): 451-453. DOI:10.11853/j.issn.1003.8280.2017.05.010 |
| [5] |
王英红, 孔庆鑫, 邱丽华, 等. 高分辨率熔解曲线分析检测家蝇cyp6d1基因突变[J]. 中国媒介生物学及控制杂志, 2012, 23(6): 499-502. Wang YH, Kong QX, Qiu LH, et al. Determination of cyp6d1-gene mutation in Musca domestica by high-resolution melting analysis[J]. Chin J Vector Biol Control, 2012, 23(6): 499-502. |
| [6] |
Nandety RS, Kuo YW, Nouri S, et al. Emerging strategies for RNA interference (RNAi) applications in insects[J]. Bioengineered, 2015, 6(1): 8-19. DOI:10.4161/21655979.2014.979701 |
| [7] |
Cooper AMW, Silver K, Zhang JZ, et al. Molecular mechanisms influencing efficiency of RNA interference in insects[J]. Pest Manag Sci, 2019, 75(1): 18-28. DOI:10.1002/ps.5126 |
| [8] |
Li XM, Yang JY, Pu Q, et al. Serine hydroxymethyltransferase controls blood-meal digestion in the midgut of Aedes aegypti mosquitoes[J]. Parasit Vectors, 2019, 12(1): 460. DOI:10.1186/s13071-019-3714-2 |
| [9] |
Song HF, Fan YH, Zhang JQ, et al. Contributions of dsRNases to differential RNAi efficiencies between the injection and oral delivery of dsRNA in Locusta migratoria[J]. Pest Manag Sci, 2019, 75(6): 1707-1717. DOI:10.1002/ps.5291 |
| [10] |
Dalzell JJ, McMaster S, Johnston MJ, et al. Non-nematode-derived double-stranded RNAs induce profound phenotypic changes in Meloidogyne incognita and Globodera pallida infective juveniles[J]. Int J Parasitol, 2009, 39(13): 1503-1516. DOI:10.1016/j.ijpara.2009.05.006 |
| [11] |
Kunte N, McGraw E, Bell S, et al. Prospects, challenges and current status of RNAi through insect feeding[J]. Pest Manag Sci, 2020, 76(1): 26-41. DOI:10.1002/ps.5588 |
| [12] |
Lin GGH, Scott JG. Investigations of the constitutive overexpression of CYP6D1 in the permethrin resistant LPR strain of house fly (Musca domestica)[J]. Pestic Biochem Physiol, 2011, 100(2): 130-134. DOI:10.1016/j.pestbp.2011.02.012 |
| [13] |
Gao JW, Scott JG. Role of the transcriptional repressor mdGfi-1 in CYP6D1v1-mediated insecticide resistance in the house fly, Musca domestica[J]. Insect Biochem Mol Biol, 2006, 36(5): 387-395. DOI:10.1016/j.ibmb.2006.02.001 |
| [14] |
Pan J, Yang C, Liu Y, et al. Novel cytochrome P450(CYP6D1) and voltage sensitive sodium channel (Vssc) alleles of the house fly (Musca domestica) and their roles in pyrethroid resistance[J]. Pest Manag Sci, 2018, 74(4): 978-986. DOI:10.1002/ps.4798 |
 2020, Vol. 31
2020, Vol. 31

