扩展功能
文章信息
- 张琳, 文书, 侯学霞, 李沙, 杨小娜, 陈婷, 苗广青, 符晓莹, 郝琴, 朱雄
- ZHANG Lin, WEN Shu, HOU Xue-xia, LI Sha, YANG Xiao-na, CHEN Ting, MIAO Guang-qing, FU Xiao-ying, HAO Qin, ZHU Xiong
- 海南省琼中地区寄生蜱携带伯氏疏螺旋体的检测及基因分型研究
- Detection and genotyping of Borrelia burgdorferi in parasitic ticks in Qiongzhong area of Hainan province, China
- 中国媒介生物学及控制杂志, 2020, 31(4): 426-429
- Chin J Vector Biol & Control, 2020, 31(4): 426-429
- 10.11853/j.issn.1003.8280.2020.04.009
-
文章历史
- 收稿日期: 2020-02-05
2 海南省琼中黎族苗族自治县人民医院, 海南 琼中 572900;
3 海南省三亚人民医院, 海南 三亚 572000
2 People's Hospital of Qiongzhong Li and Miao Autonomous County;
3 People's Hospital of Sanya
莱姆病是一种重要的自然疫源性疾病,它的病原体为伯氏疏螺旋体(Borrelia burgdorferi)[1]。莱姆病主要是通过感染了伯氏疏螺旋体的蜱叮咬人或动物皮肤而传播,其自然疫源地主要位于美国、欧洲和亚洲,感染伯氏疏螺旋体的动物和媒介蜱主要分布于温带地区[2-5]。1987年艾承绪等[6]首次报道了我国黑龙江省海林县第1例莱姆病。随后在新疆、内蒙古、辽宁、吉林、贵州、河北、北京和河南省(自治区、直辖市)等地开展了该疾病的人群流行病学调查。目前证实莱姆病分布在我国30多个省(自治区、直辖市)[7]。北方以黑龙江、吉林、新疆、内蒙古、河南省(自治区)等为主,南方则以四川、贵州、江西和云南省等地为主[8-11]。
海南省位于我国最南端,与广东省的雷州半岛以琼州海峡相隔。海南省是我国唯一的位于热带地区的省份,气候等自然条件与内地差异极大。近几年,有学者研究表明,海南省存在蜱传斑点热群立克次体病,蜱作为多种疾病的传播媒介,在海南省引起了人们的重视[12]。2015年,我们调查了海南省三亚地区人群莱姆病的流行情况,首次证实海南省人群存在莱姆病[13],但海南省尚未有莱姆病媒介的相关报道。琼中地区位于海南省中部,森林草地覆盖率高,合适的气温和湿度有利于蜱的存活。我们收集整理了海南省蜱种分布,发现琼中黎族苗族自治县(琼中县)是蜱种分布数量最多的区域之一,多达12种。随着全球气候变化及人为活动的影响[14-15],蜱与人接触可能更加密切,并且蜱携带伯氏疏螺旋体的多样性,直接影响人感染莱姆病所致症状与严重程度[16]。因此调查琼中地区媒介蜱的伯氏疏螺旋体感染状况与分型分析,对于该地区莱姆病的防控具有指导意义。
rrf-rrl基因是根据伯氏疏螺旋体独特的rRNA基因结构,其rrs(16 S)只有一个拷贝,而rrl(23 S)和rrf(5 S)则各有2个拷贝,前后重复排列为rrlA-rrfA-rrlB-rrfB,选择保守的rrf 3′端和rrl 5′端设计引物,以扩增高变的rrfA-rrlB间隔区[17]。目前,rrf-rrl基因间隔区普遍用于标本的检测和伯氏疏螺旋体的单位点分型研究[18-19]。本研究应用巢式PCR方法,对伯氏疏螺旋体rrf-rrl基因间隔区设计引物,检测海南省琼中地区蜱的带菌率,并对测序结果进行分型分析,可为莱姆病的预警和监测提供理论依据。
1 材料与方法 1.1 蜱样本采集蜱的采集地点位于海南省琼中县。从调查点自然放牧的牛、羊体表采集寄生蜱,放入标本瓶保存于4 ℃。
1.2 主要试剂DNA提取试剂盒(DNeasyⓇ Blood & Tissue Kit)由德国QIAGEN公司提供。引物由擎科生物公司合成。PCR相关试剂由宝生物工程(大连)有限公司提供。
1.3 阳性对照伯氏疏螺旋体DNA的提取将中国疾病预防控制中心传染病预防控制所莱姆病室实验室保存的PD91菌株于BSK培养基中传代培养,当菌体浓度达到107/ml时,将全部培养基装至Nalgene离心管中,19 802×g离心30 min,弃去上清液,然后用0.01 mol/L pH 7.4磷酸盐缓冲液(PBS)洗涤3遍,弃去上清液,然后加入100 μl ddH2O重悬,恒温金属浴上100 ℃水煮10 min,最后1 685×g离心5 min,吸取上清液保存于-80 ℃冰箱,备用。
1.4 蜱标本DNA的提取使用75%乙醇溶液浸泡清洗蜱标本,再使用无菌水清洗3次。采用DNeasyⓇ Blood & Tissue Kit(DNA提取试剂盒),按照说明书步骤,提取120只蜱标本DNA。
1.5 蜱种鉴定参照文献[20],采用PCR法,扩增蜱的16S rRNA,对产物测序,测序结果与美国国立生物技术信息中心(NCBI)上的参考序列比对,结合形态判别蜱种。
1.6 伯氏疏螺旋体检测采用巢式PCR方法。
1.6.1 引物设计引物参照文献[17]的rrf(5 S)-rrl(23 S)rRNA基因间隔区巢式PCR的引物,引物序列见表 1。

|
50 μl反应体系:2×Taq MasterMix 25 μl,正、反向引物(100 μmol/L)各1 μl,第1轮模板4 μl,第2轮模板0.5 μl。
1.6.3 巢式PCR反应条件94 ℃预变性5 min;94 ℃变性45 s,53 ℃退火45 s(第2轮退火温度为55 ℃),72 ℃延伸45 s,35个循环后72 ℃延伸5 min。
1.6.4 巢式PCR产物检测巢式PCR产物经2%琼脂糖凝胶电泳,凝胶成像仪成像拍照。阳性片段为250 bp左右。
1.7 PCR阳性产物测序及分型分析PCR阳性产物送北京奥科鼎盛生物技术有限公司进行双向测序,根据测序峰图分析测序结果的准确性,然后使用SeqMan软件进行拼接。将拼接的序列提交到GeneBank中进行比对,下载同源性高且正式发表的序列,用MEGA 6.0软件分析遗传进化距离并构建系统进化树。
2 结果 2.1 蜱的采集、蜱种鉴定及伯氏疏螺旋体的检测应用普通PCR方法,检测蜱中16S rRNA基因序列,通过NCBI比对,发现琼中地区牛体表寄生的120只蜱均为微小牛蜱(Rhipicephalus microplus)。采用巢式PCR方法检测游离蜱共120只,其中伯氏疏螺旋体阳性44只,阳性率为36.67%。
2.2 基因多态性分析 2.2.1 rrf-rrl基因序列特征分析人工对双向测序结果峰图进行校正后,用SeqMan软件进行拼接,44份样本rrf-rrl基因片段序列长度为239~256 bp。序列中碱基A、T、G、C的平均含量分别为37.92%、40.35%、7.06%和14.67%,A+T含量高于G+C含量,碱基组成具有显著的偏倚性。44份阳性标本rrf-rrl基因序列与B31比对,在46个位置有单核苷酸多态性(SNP)的变化。
2.2.2 序列同源性分析将44条序列分别通过NCBI网站中的blastn软件进行比对,发现它们与GeneBank中伯氏疏螺旋体菌株的5S~23S rRNA序列具有高度同源性。在44份样本扩增序列中,有25份样本序列与B. afzelii(B. a)基因型同源性较高(98.44%~100%);有11份样本序列与Borrelia sp.(B. yangze)基因型同源性较高(99.20%~100%);有8份样本序列与B. garinii(B. g)基因型同源性较高(99.20%~100%)。
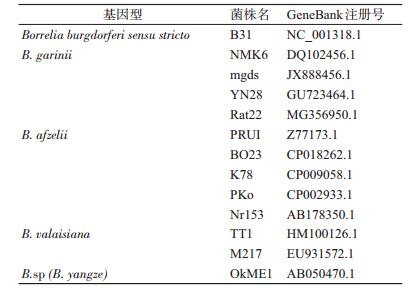
2.2.3 进化树的构建下载15条国际国内标准菌株序列(表 2),包含B. burgdorferi sensu stricto(B.b.s.s)B31菌株序列,B. g基因型4株菌株的序列,B. a基因型5株菌株的序列,B. valaisiana(B.v)基因型2株菌株的序列,B. sp(B. yangze)基因型1株菌株的序列。
采用Neighbor-Joining(NJ)法(bootstrap为1 000)构建进化树(图 1),结果显示,有25份样本与B. a基因型菌株PRUI、BO23、K78、PKo和Nr153分布在一支。11份样本与B. sp菌株OkME1分布在一支,并且这一支与B. v基因型菌株TT1和M217同源性高。有8份样本与B. g基因型菌株同源性高,所有样本与B. g基因型菌株Rat22、NMK6、mgds和YN28分在一支,但是从树图看分支较为复杂。

|
| 图 1 基于rrf-rrl基因的分型分析 Figure 1 Genotype analysis based on the rrf-rrl intergenic spacer gene |
| |
蜱的种类繁多,仅在我国就有100多种,其中60%左右的种类具有病原体传播潜能,蜱的分布与生态环境、海拔、经纬度和人类活动等因素密切相关[18-19, 21]。据报道,琼中地区蜱种多达12种,这可能与该地高达60%的森林覆盖率,合适的气温和湿度更有利于蜱的存活有关。本次调查海南省琼中县牛体表的优势蜱种为微小牛蜱,可能与调查时间和调查地区的植被种类及区域局限性等因素有关。
伯氏疏螺旋体基因型的鉴定常用目标基因有16S rRNA、rrs、hbb、groEL、recA、ospA和rrf-rrl基因间隔区。其中,rrf-rrl基因间隔区进化速度适中,被广泛应用于伯氏疏螺旋体分类中。本研究中以rrf-rrl基因间隔区为靶基因检测蜱中伯氏疏螺旋体的感染情况,发现海南省琼中地区蜱的伯氏疏螺旋体带菌率为36.67%,蜱的带菌率较高,可能与宿主动物的带菌率有密切关系[22-23],应对当地的宿主动物进行莱姆病感染状况调查。
从我国分离到的102株伯氏疏螺旋体菌株的分型结果来看,我国主要的基因型为B. b. s. s.、B. g、B. a和B. yangze[19]。我国北方媒介以全沟硬蜱(Ixodes persulcatus)为主,主要携带B. g和B. a基因型[19]。南方较为复杂,媒介以粒形硬蜱(Ⅰ. granulatus)和二棘血蜱(Haemaphysalis bispinosa)为主,已报道的伯氏疏螺旋体基因型包含B. a、B. yangze和B. sinica 3种基因型[19-21]。海南省位于中国最南部,与大陆以海相隔,琼中地区位于海南省中部,具有与大陆不同的地理气候环境。本次调查表明,海南省琼中地区微小牛蜱中伯氏疏螺旋体主要存在3个基因型,分别为B. a、B. sp和B. g基因型。其中,B. sp基因型参考株OkME1是2001年在日本检测到的,被认为与B. v基因型相似,目前,这类伯氏疏螺旋体被命名为B. yangtze sp. nov[24]。并且rrf-rrl基因序列分析表明,此次调查的蜱中有8份样本与B. g基因型菌株同源性高,但是从树图看分支较为复杂,可能存在多种潜在的亚型,符合伯氏疏螺旋体B. g基因型多态性比较大的特点。
本次研究结果表明,海南省琼中地区蜱中存在多种基因型的伯氏疏螺旋体,其中包括我国的主要致病基因型B. a和B. g基因型,所以该地区可能存在多种型别感染的人群,当地应重视莱姆病的监测与防控。
| [1] |
Burgdorfer W, Barbour AG, Hayes SF, et al. Lyme disease-a tick-borne spirochetosis?[J]. Science, 1982, 216(4552): 1317-1319. DOI:10.1126/science.7043737 |
| [2] |
Hengge UR, Tannapfel A, Tyring SK, et al. Lyme borreliosis[J]. Lancet Infect Dis, 2003, 3(8): 489-500. DOI:10.1016/S1473-3099(03)00722-9 |
| [3] |
Stanek G, Wormser GP, Gray J, et al. Lyme borreliosis[J]. Lancet, 2012, 379(9814): 461-473. DOI:10.1016/S0140-6736(11)60103-7 |
| [4] |
Steere AC, Coburn J, Glickstein L. The emergence of Lyme disease[J]. J Clin Invest, 2004, 113(8): 1093-1101. DOI:10.1172/JCI21681 |
| [5] |
Kilpatrick AM, Dobson ADM, Levi T, et al. Lyme disease ecology in a changing world:consensus, uncertainty and critical gaps for improving control[J]. Philos Trans R Soc Lond B Biol Sci, 2017, 372(1722): 20160117. DOI:10.1098/rstb.2016.0117 |
| [6] |
艾承绪, 温玉欣, 张永国, 等. 黑龙江省海林县林区莱姆病的流行病学调查[J]. 中国公共卫生, 1987, 6(2): 82-85. Ai CX, Wen YX, Zhang YG, et al. An epidemiological study of Lyme disease in Hailin county, Heilongjiang province, China[J]. Chin J Public Health, 1987, 6(2): 82-85. |
| [7] |
Fang LQ, Liu K, Li XL, et al. Emerging tick-borne infections in mainland China:an increasing public health threat[J]. Lancet Infect Dis, 2015, 15(12): 1467-1479. DOI:10.1016/S1473-3099(15)00177-2 |
| [8] |
Qin H, Geng Z, Hou XX, et al. Seroepidemiological investigation of Lyme disease and human granulocytic anaplasmosis among people living in forest areas of eight provinces in China[J]. Biomed Environ Sci, 2013, 26(3): 185-189. |
| [9] |
杜占森, 万康林, 王春生, 等. 吉林省莱姆病流行病学调查[J]. 中国人兽共患病学报, 2007, 23(8): 836-838. Du ZS, Wan KL, Wang CS, et al. Epidemiological investigation and gene classification of Lyme disease in Jilin province[J]. Chin J Zoonoses, 2007, 23(8): 836-838. DOI:10.3969/j.issn.1002-2694.2007.08.024 |
| [10] |
谭毓绘, 刘勇, 孙荷, 等. 2000-2004年新疆维吾尔自治区莱姆病的监测[J]. 中国临床神经学, 2007, 15(2): 158-161. Tan YH, Liu Y, Sun H, et al. Surveillance of Lyme disease in Xinjiang Uygur autonomous region during 2000-2004[J]. Chin J Clin Neurosci, 2007, 15(2): 158-161. |
| [11] |
冯邦强, 陈戊申, 杜志明, 等. 广东省1992年莱姆病调查结果[J]. 华南预防医学, 1993, 19(4): 7-8. Feng BQ, Chen WS, Du ZM, et al. Investigation of Lyme disease in Guangdong in 1992[J]. South China J Prevent Med, 1993, 19(4): 7-8. |
| [12] |
金玉明, 张丽娟, 孙莲英, 等. 海南省澄迈县新发斑点热流行病学调查[J]. 疾病监测, 2011, 26(1): 18-22. Jin YM, Zhang LJ, Sun LY, et al. Epidemiologyical investigation of emerging spotted fever in Chengmai county, Hainan province[J]. Dis Surveill, 2011, 26(1): 18-22. DOI:10.3784/j.issn.1003-9961.2011.01.007 |
| [13] |
Zhang L, Zhu X, Hou XX, et al. Test of 259 serums from patients with arthritis or neurological symptoms confirmed existence of Lyme disease in Hainan province, China[J]. Int J Clin Exp Med, 2015, 8(6): 9531-9536. |
| [14] |
Simon JA, Marrotte RR, Desrosiers N, et al. Climate change and habitat fragmentation drive the occurrence of Borrelia burgdorferi, the agent of Lyme disease, at the northeastern limit of its distribution[J]. Evol Appl, 2014, 7(7): 750-764. DOI:10.1111/eva.12165 |
| [15] |
Ostfeld RS, Levi T, Keesing F, et al. Tick-borne disease risk in a forest food web[J]. Ecology, 2018, 99(7): 1562-1573. DOI:10.1002/ecy.2386 |
| [16] |
Little EAH, Anderson JF, Stafford Ⅲ KC, et al. Predicting spatiotemporal patterns of Lyme disease incidence from passively collected surveillance data for Borrelia burgdorferi sensu lato-infected Ixodes scapularis ticks[J]. Ticks Tick Borne Dis, 2019, 10(5): 970-980. DOI:10.1016/j.ttbdis.2019.04.010 |
| [17] |
Postic D. Diversity of Borrelia burgdorfeii sensu lato evidenced by restriction fragment length polymorphism of rrf (5S)-rrl (23S) intergenic spacer amplicons[J]. Int J Syst Bacteriol, 1994, 44(4): 743-752. DOI:10.1099/00207713-44-4-743 |
| [18] |
Chu CY, Jiang BG, Liu W, et al. Presence of pathogenic Borrelia burgdorferi sensu lato in ticks and rodents in Zhejiang, south- east China[J]. J Med Microbiol, 2008, 57(8): 980-985. DOI:10.1099/jmm.0.47663-0 |
| [19] |
Hao Q, Hou XX, Geng Z, et al. Distribution of Borrelia burgdorferi sensu lato in China[J]. J Clin Microbiol, 2011, 49(2): 647-650. |
| [20] |
Wang YZ, Wu LM, Zhang K, et al. A broad-range survey of ticks from livestock in Northern Xinjiang:changes in tick distribution and the isolation of Borrelia burgdorferi sensu stricto[J]. Parasit Vectors, 2015, 8: 449. DOI:10.1186/s13071-015-1021-0 |
| [21] |
Ni XB, Jia N, Jiang BG, et al. Lyme borreliosis caused by diverse genospecies of Borrelia burgdorferi sensu lato in northeastern China[J]. Clin Microbiol Infect, 2014, 20(8): 808-814. DOI:10.1111/1469-0691.12532 |
| [22] |
Halsey SJ, Allan BF, Miller JR. The role of Ixodes scapularis, Borrelia burgdorferi and wildlife hosts in Lyme disease prevalence:a quantitative review[J]. Tick Tick Borne Dis, 2018, 9(5): 1103-1114. DOI:10.1016/j.ttbdis.2018.04.006 |
| [23] |
Embers ME, Hasenkampf NR, Jacobs MB, et al. Variable manifestations, diverse seroreactivity and post-treatment persistence in non-human primates exposed to Borrelia burgdorferi by tick feeding[J]. PLoS One, 2017, 12(12). |
| [24] |
Chu CY, Liu W, Jiang BG, et al. Novel genospecies of Borrelia burgdorferi sensu lato from rodents and ticks in southwestern China[J]. J Clin Microbiol, 2008, 46(9): 3130-3133. DOI:10.1128/JCM.01195-08 |
 2020, Vol. 31
2020, Vol. 31