扩展功能
文章信息
- 贯长辉, 王吉顺, 杨年忠
- GUAN Chang-hui, WANG Ji-shun, YANG Nian-zhong
- 浙江省台州市椒江区2011-2018年布鲁氏菌病监测结果分析
- An analysis of surveillance results of brucellosis in Jiaojiang district, Taizhou, Zhejiang province, China, 2011-2018
- 中国媒介生物学及控制杂志, 2020, 31(3): 350-352, 357
- Chin J Vector Biol & Control, 2020, 31(3): 350-352, 357
- 10.11853/j.issn.1003.8280.2020.03.021
-
文章历史
- 收稿日期: 2019-12-31
布鲁氏菌病(布病)是一种由布鲁氏菌引起的严重危害人民健康和畜牧业发展的人畜共患传染病, 易发展为慢性疾病, 严重影响生活质量。家畜感染布鲁氏菌后可引起大部分的母家畜不怀孕、流产或死胎, 严重影响畜牧业的扩大和发展。浙江省布病疫情呈稳定趋势[1], 但周边广东、福建等南方省份的发病率在逐渐上升[2], 椒江区布病的监测和防治形势依旧严峻[3]。自2003年辖区首次发现畜间(奶牛)布病以来, 奶牛布鲁氏菌感染情况一直存在, 人间布鲁氏菌感染(隐性感染)持续存在。为保障椒江区从业人员身体健康, 根据《全国布鲁氏菌病监测方案》和浙江省布病监测要求, 开展布病监测。本文对2011-2018年椒江区人间布病血清学检测结果进行了分析, 为今后制定布病防控策略和措施提供科学依据。
1 材料与方法 1.1 资料来源人间疫情资料来源于中国疾病预防控制信息系统, 重点人群监测资料来自于辖区各牧场内饲养、挤奶接产等相关人员的监测资料。
1.2 调查对象根据《全国布鲁氏菌病监测方案》和浙江省布病监测要求, 椒江区各街道与牲畜及畜产品有接触的职业人群, 包括奶牛及羊饲养人员, 挤乳及接产人员。
1.3 方法 1.3.1 标本采集严格按照方案要求按人口比例概率抽样(PPS), 对全区街道的高危人群进行布病的血清筛查和检测。高危人群包括养殖场工人、养殖户、兽医和散养户。为发现新发病例, 采用虎红平板凝集试验初筛, 阳性者采用试管凝集试验确诊。采集高危人群静脉血5 ml, 分离血清后24 h内送至椒江区疾病预防控制中心(CDC), 血清冷藏或冷冻保存待检。采集及运送要求使用生物安全运输箱冷藏运送, 避免反复冻融, 包装完整、无溶血、无渗漏、编号清楚且与调查登记表对应。辖区各牧场内饲养、挤奶及接产相关人员都已签署知情同意书。
1.3.2 检测方法采用虎红平板凝集试验初筛, 阳性者采用试管凝集试验, 试剂来源于中国CDC传染病预防控制所。按试剂盒说明书操作, 试管凝集试验抗体滴度≥ 1:100(++)判定为阳性。病例依据《布鲁氏菌病诊断标准》(WS269-2019)诊断。
1.4 统计学分析采用Excel 2010软件整理资料, 用SPSS 21.0软件进行统计学分析, χ2检验用于率的比较, P < 0.05为差异有统计学意义。
2 结果 2.1 布病抗体阳性情况全区共检测275人, 抗体阳性15例, 抗体阳性率为5.45%, 见表 1。
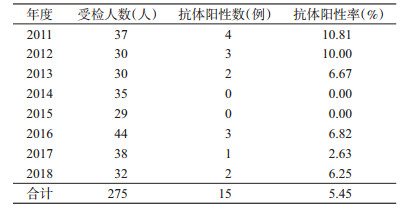
|
2011-2018年三甲街道检测人数最多, 共检测150人, 阳性率为5.33%, 见表 2。
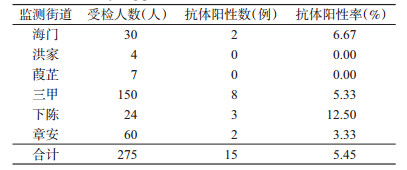
|
本次检测中男性195人, 女性80人, 平均年龄(50.09±12.97)岁。40~49岁年龄组人群抗体阳性率最高, 为11.43%, 见表 3。不同接触时间的抗体阳性率差异有统计学意义(χ2=12.744, P=0.013)。
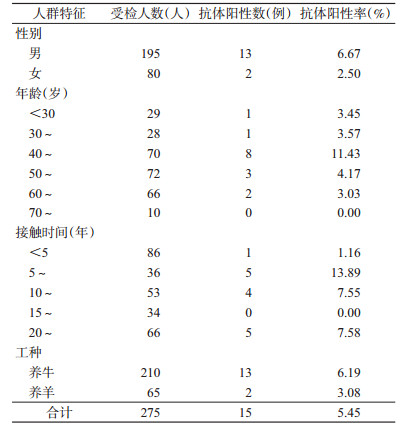
|
2011-2018年椒江区畜牧检测奶牛9 147头, 感染布病167头, 感染率为1.83%。2011年感染率最高, 为10.75%, 见表 4。
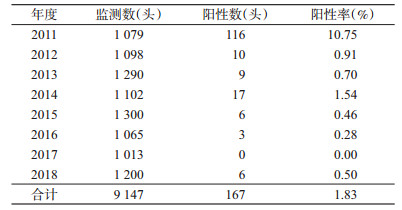
|
奶牛感染情况自2011年以后开始出现下降并逐渐平稳, 人群中布病抗体阳性率处于相对平稳状况, 见图 1。

|
| 图 1 2011-2018年浙江省台州市椒江区奶牛种群和人群中布鲁氏菌感染情况 Figure 1 Prevalence of Brucella infection in dairy cow population and human population in Jiaojiang district, 2011-2018 |
| |
布病是最常见的人畜共患病之一[4], 不仅对人类健康构成严重威胁, 同时还会造成严重的经济损失[5]。近年来, 在各种惠农政策的鼓励扶持下, 农村发展种植养殖业的积极性空前高涨, 尤其是家庭农场、农民专业合作社等新型经营主体发展迅速地区, 从事接触牛羊养殖、贩卖、屠宰的人员也迅速增加, 感染布病的机会也显著增加。椒江区人间布鲁氏菌感染(隐性感染)持续存在。2011-2018年椒江区布病处于相对平稳状态, 平均感染阳性率(5.45%)高于2005-2010年(5.26%)水平, 同时高于同为浙东地区宁波市2002-2012年平均阳性率(1.68%)水平[6], 但明显低于全国2005-2018年平均18.11%的阳性水平[7]。2011-2018年平均感染阳性率的升高可能与农民专业合作社等新型经营主体发展迅速有关。
布病通常通过受感染动物或未经巴氏杀菌牛奶的直接接触以及通过兽医、屠宰场工人和农民的职业接触传染给人类[8-9]。主要症状是发热、出汗、不适、厌食、头痛、关节痛、肌痛、背痛和体质量减轻等。本次监测发现, 全区监测年限、高危人群性别、年龄及工种的布病阳性率差异无统计学意义, 但不同接触时间的高危人群抗体阳性率差异有统计学意义, 5~10年的阳性率最高为13.89%, 可能与防护意识低有关, 在接产等环节出现直接接触病牛的皮肤黏膜情况。全区以养殖牛的工人最多, 占全部工种的76.36%, 饲养人员在奶牛分娩时存在徒手清洗羊水、血液等不规范操作, 可能出现工人直接接触病牛的皮肤黏膜引起感染[10], 相关情况有待进一步追踪监测。应加强职业人群布病防治知识的培训和健康促进工作, 提高他们的自我防护意识, 在饲养牲畜和加工牛羊肉时做好防护, 减轻布病感染情况。
世界卫生组织和世界动物卫生组织都提出过控制或根除布病的措施, 近几年椒江区畜牧兽医局加强奶牛的布病监测, 及时扑杀患布病奶牛。椒江区CDC也加强布病防治知识宣传工作, 养殖户提高防病意识, 严格掌握奶牛引进标准, 奶牛饲养人员加强职业防护等工作, 但2011-2018年奶牛布鲁氏菌抗体阳性率为1.83%, 略低于2008-2018年全国的1.90%[11]。感染情况依旧存在。动物布病的防治措施中, 单独接种及联合接种的疫苗接种和检测与优化屠宰程序都能有效降低畜间布病的患病率[12]。但椒江区尚未开展全面的畜间布鲁氏菌疫苗接种, 与我国尚未开展畜间布病疫苗强制接种有关[13], 即使目前可用的疫苗存在着一定的缺陷[14], 实施疫苗接种仍是预防布病的有效补充措施, 有待引起重视。同时, 椒江区主要的动物监测以输入性家畜奶牛为主, 如羊等常见本土宿主及传染源监测仍存在不足, 扩大监测宿主及传染源的范围仍是椒江区的动物监测重点。
| [1] |
施旭光, 孙继民, 凌锋. 2015年浙江省人间布鲁氏菌病监测结果分析[J]. 疾病监测, 2017, 32(3): 203-205. Shi XG, Sun JM, Ling F. Surveillance for brucellosis in Zhejiang province, 2015[J]. Dis Surveil, 2017, 32(3): 203-205. DOI:10.3784/j.issn.1003-9961.2017.03.009 |
| [2] |
Zhong ZJ, Yu S, Wang XC, et al. Human brucellosis in the People's Republic of China during 2005-2010[J]. Int J Infect Dis, 2013, 17(5): e289-292. DOI:10.1016/j.ijid.2012.12.030 |
| [3] |
郑琼, 杨年忠, 陈欢. 2005-2010年台州市椒江区布鲁菌病监测结果分析[J]. 中国预防医学杂志, 2012, 13(6): 473-474. Zheng Q, Yang NZ, Chen H. Analysis of the results of brucellosis surveillance in Jiaojiang district of Taizhou city from 2005 to 2010[J]. Chin Prev Med, 2012, 13(6): 473-474. DOI:10.16506/j.1009-6639.2012.06.014 |
| [4] |
Boschiroli ML, Foulongne V, O'Callaghan D. Brucellosis:a worldwide zoonosis[J]. Curr Opin Microbiol, 2001, 4(1): 58-64. DOI:10.1016/s1369-5274(00)00165-x |
| [5] |
Zeng JY, Robertson ID, Ji QM, et al. Evaluation of the economic impact of brucellosis in domestic yaks of Tibet[J]. Transbound Emerg Dis, 2019, 66(1): 476-487. DOI:10.1111/tbed.13049 |
| [6] |
孙亚维, 张颉楠, 赵薛飞, 等. 2002-2012年宁波市人间布鲁氏菌病监测结果分析[J]. 中国卫生检验杂志, 2013, 23(5): 1262-1263, 1268. Sun YW, Zhang JN, Zhao XF, et al. Surveillance analysis of human brucellosis in Ningbo from 2002 to 2012[J]. Chin J Health Lab Technol, 2013, 23(5): 1262-1263, 1268. |
| [7] |
崔步云, 姜海. 2005-2016年全国布鲁氏菌病监测数据分析[J]. 疾病监测, 2018, 33(3): 188-192. Cui BY, Jiang H. Surveillance data of brucellosis in China, 2005-2016[J]. Dis Surveil, 2018, 33(3): 188-192. DOI:10.3784/j.issn.1003-9961.2018.03.005 |
| [8] |
Pappas G, Papadimitriou P, Akritidis N, et al. The new global map of human brucellosis[J]. Lancet Infect Dis, 2006, 6(2): 91-99. DOI:10.1016/S1473-3099(06)70382-6 |
| [9] |
Franco MP, Mulder M, Gilman RH, et al. Human brucellosis[J]. Lancet Infect Dis, 2007, 7(12): 775-786. DOI:10.1016/S1473-3099(07)70286-4 |
| [10] |
Lytras T, Danis K, Dounias G. Incidence patterns and occupational risk factors of human brucellosis in Greece, 2004-2015[J]. Int J Occup Environ Med, 2016, 7(4): 221-226. DOI:10.15171/ijoem.2016.806 |
| [11] |
Ran XH, Cheng JJ, Wang MM, et al. Brucellosis seroprevalence in dairy cattle in China during 2008-2018:a systematic review and meta-analysis[J]. Acta Trop, 2019, 189: 117-123. DOI:10.1016/j.actatropica.2018.10.002 |
| [12] |
Zhang N, Huang DS, Wu W, et al. Animal brucellosis control or eradication programs worldwide:a systematic review of experiences and lessons learned[J]. Prev Vet Med, 2018, 160: 105-115. DOI:10.1016/j.prevetmed.2018.10.002 |
| [13] |
Madzingira O, Sezuni PM. Serological prevalence and public health significance of brucellosis on a dairy farm in Namibia from 2011 to 2014[J]. BMC Res Notes, 2017, 10: 620. DOI:10.1186/s13104-017-2933-x |
| [14] |
Dougherty AMF, Cornish TE, O'Toole D, et al. Abortion and premature birth in cattle following vaccination with Brucella abortus strain RB51[J]. J Vet Diagn Invest, 2013, 25(5): 630-635. DOI:10.1177/1040638713499570 |
 2020, Vol. 31
2020, Vol. 31


