扩展功能
文章信息
- 黄晓丹, 杨琳琳, 刘鲁宏, 程鹏, 刘宏美
- HUANG Xiao-dan, YANG Lin-lin, LIU Lu-hong, CHENG Peng, LIU Hong-mei
- 白纹伊蚊吸血前后气味受体OR10基因表达水平的比较研究
- Expression level of olfactory receptor 10 gene in Aedes albopictus before and after blood sucking
- 中国媒介生物学及控制杂志, 2020, 31(3): 331-334
- Chin J Vector Biol & Control, 2020, 31(3): 331-334
- 10.11853/j.issn.1003.8280.2020.03.017
-
文章历史
- 收稿日期: 2019-12-21
2 济宁市疾病预防控制中心, 山东 济宁 2720332
2 Jining City Center for Disease Control and Prevention
白纹伊蚊(Aedes albopictus)是登革病毒和寨卡病毒等的重要传播媒介[1]。蚊虫对周围环境的识别主要依赖于感官系统, 尤其依赖于嗅觉系统。嗅觉系统在蚊虫吸血和寻找产卵地等活动中发挥着举足轻重的作用。长期以来, 由于杀虫剂的大量不规范使用, 蚊虫抗药性与日俱增[2-3]。随着自然界中蚊虫抗药性的不断增长, 有效地利用气味介导的蚊虫嗅觉行为特征来找寻新的防治方法逐渐成为研究热点。
目前研究的蚊虫嗅觉系统主要包括嗅觉受体(olfactory receptors, ORs)、气味结合蛋白(odorant-binding proteins, OBPs)以及相关的嗅觉神经元(olfactory receptor neuron)[4]。ORs在嗅觉系统中起到识别气味, 将外界的化学信号刺激转化为电信号的作用[5]。1999年, Clyne等[6]、Vosshall等[7]在果蝇(Drosophila melanogaster)中首次发现嗅觉受体OR蛋白。目前已从冈比亚按蚊(Anopheles gambiae)[8]、埃及伊蚊(Ae. aegypti)[9]、白纹伊蚊[10]和致倦库蚊(Culex pipiens quinquefasciatus)[11]的基因组中分别鉴定出ORs基因79、131、158和158个。这些ORs分为2类:一类是传统的配体型嗅觉受体(odorant receptors, ORx)[12], 另外一类是嗅觉受体共表达受体(odorant receptor co-receptor, Orco)。其中, OR2-10家族参与蚊虫的吸血宿主寻找和产卵地的选择成为研究的热点。研究已经证明OR10可能与白纹伊蚊寻找产卵地有关[4]。但是现有的报道只研究了蚊虫羽化后以10%的葡萄糖为食的5 d内以及RNA干扰后的OR10基因的表达水平, 而蚊虫吸血对OR10基因的表达有无影响还未见阐述。本文对蚊虫吸血前后体内OR10基因表达变化进行了研究。
1 材料与方法 1.1 供试蚊虫白纹伊蚊实验品系为山东省寄生虫病防治研究所常规饲养, 实验室条件为相对湿度70%, 温度26℃, 日光灯照射12 h/d。幼蚊以酵母片为食, 成蚊以10%葡萄糖溶液为食, 产卵前白纹伊蚊雌蚊喂饲小白鼠血。
1.2 实验方法 1.2.1 样品准备将单只白纹伊蚊蛹放于试管中, 待羽化为成蚊5~7 d后, 收集雌蚊80~90只, 期间以葡萄糖溶液为食, 标记为未吸血雌蚊。挑选与雄蚊共同饲养羽化3~5 d的雌蚊, 饲喂以小白鼠血, 1~2 d后收集该吸血雌蚊80~90只, 标记为吸血雌蚊。收集羽化5~7 d雄蚊80~90只, 标记为雄蚊。
1.2.2 总RNA提取使用Rneasy MiNi Kit分别提取雄蚊、未吸血雌蚊和吸血雌蚊总RNA, 每组20~25只提取雄、雌蚊总RNA。经TURBO DNA-freeTMKit去除残余DNA后, 使用Prime ScriptR RTase试剂盒合成cDNA。每组实验重复3次。
1.2.3 反转录-聚合酶链式反应(RT-PCR)法根据已发表的白纹伊蚊OR10基因序列[14]使用Primer 5设计引物, 正向引物:5'-ATGGAAAGCATTCTAA GCTGTCCGA-3';反向引物:5'-TTAATTATAAAC CCGACGCAG-3'。引物由英潍捷基公司合成。以吸血雌蚊cDNA为模板, 反应体系为50 μl, 其中含10×Probest Buffer 5 μl, Probest DNA Polymerase 0.25 μl, dNTP 4 μl, cDNA 1 μl, 正、反向引物各1 μl, ddH2O 37.75 μl。反应程序:94℃ 1 min; 94℃ 30 s, 55℃ 30 s, 72℃ 1 min, 共40个循环; PCR产物4℃保存。取5 μl PCR产物进行1%琼脂糖凝胶电泳。PCR产物切胶回收后连接到TA克隆载体上送英潍捷基公司测序。
1.2.4 序列分析通过软件DNAMan将获得的OR10基因氨基酸序列与其他蚊种的OR10基因氨基酸序列进行比对分析。
1.2.5 荧光定量PCR使用Script SYBR Green PCR Kit对雄蚊、吸血雌蚊和未吸血雌蚊OR10基因进行检测。根据白纹伊蚊OR10基因序列设计引物, 正向引物OR10-qF:5'-GCTAACGAGGTACGG GAGGAAAG-3';反向引物OR10-qR:5'-TGCTGA GCCCGCAGGATTAT -3'。引物由英潍捷基公司合成。荧光定量PCR反应条件为:95℃ 2 min, 95℃ 15 s, 60℃ 15 s, 72℃ 1 min, 共40个循环。β-actin为内参基因。引物序列为β-actin-qF:5'-GCCGTC TTCCCGTCCAT-3', β-actin-qR:5'-GGCGACACG CAGCTCATT-3'。实验进行3次生物学重复, 每次实验重复3次。
1.3 统计学分析实验数据采用单因素方差分析, 总体差异有统计学意义时进行多重比较分析。当方差不齐(P < 0.05)时, 采用Dunnett T3 tests法进行多重比较, 当方差齐(P>0.05)时, 采用post-hoc Tukey's HSD tests法进行多重比较。P < 0.05为差异有统计学意义。
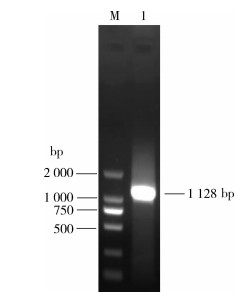
2 结果 2.1 序列扩增结果白纹伊蚊OR10基因克隆以吸血雌蚊cDNA为模板扩增得到约1 100 bp的条带, 与目的片段的理论值相符(图 1)。TA载体克隆测序后发现扩增获得OR10基因的开放阅读框全长为1 128 bp, 编码376个氨基酸。通过氨基酸序列进行比对分析发现其与已知序列一致性为100%[13]。白纹伊蚊与埃及伊蚊和冈比亚按蚊OR10基因的氨基酸序列一致性分别为86.13%和69.69%, 氨基酸序列比对结果见图 2。
|
| M. DL2000 DNA Marker;1. OR10。 图 1 目的基因的PCR扩增结果 Figure 1 Results of PCR amplification of the target gene |
| |

|
| 图 2 白纹伊蚊OR10与其他蚊种OR10氨基酸序列比对 Figure 2 Amino acid sequence alignment of olfactory receptor 10 in Aedes albopictus (AalbOR10), Ae. aegypti (AaegOR10) and Anopheles gambiae (AgamOR10) |
| |
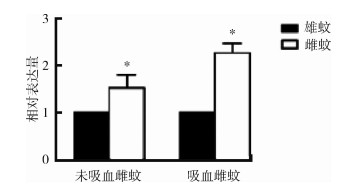
使用荧光定量PCR方法检测雄蚊、吸血雌蚊和未吸血雌蚊OR10基因的表达量, 设定雄蚊OR10基因的表达量为1, 以β-actin为内参基因。结果显示(图 3), 雄蚊OR10基因的表达量最低为1, 雌蚊OR10基因的表达量为1.535±0.274, 高于雄蚊, 吸血后的雌蚊OR10基因的表达量最高为2.284±0.203, 且未吸血与吸血后的雌蚊OR10基因的表达量差异有统计学意义(F=32.067, P=0.001)。
|
| 注:*未吸血雌蚊与雄蚊OR10基因比较,P<0.001;吸血雌蚊与雄蚊OR10基因比较,P<0.001。 图 3 白纹伊蚊OR10的表达差异 Figure 3 Different expression levels of olfactory receptor 10 in Aedes albopictus (AalbOR10) (F=32.067, P=0.001) |
| |
嗅觉感知是由ORs被气味分子激活, 引起细胞内的信号转导, 将气味的化学信号转变成电信号, 最后传到更高的中枢神经完成气味感知的生理功能, 对昆虫ORs相关蛋白的研究是阐明昆虫嗅觉机制的基础。嗅觉在蚊虫的目标寄主搜寻、产卵和糖源搜寻行为中起重要作用, 不同昆虫种类都会出现种类特异的新的OR基因亚族, 正是这些种类特异的ORs, 决定了它们各自不同的吸血偏好[13-14], 这些ORs对应的配体有可能就是不同的寄主释放的化合物[7]。而那些在昆虫中同源性高的、在进化中保留下来的OR, 则可能在昆虫的嗅觉中起着基础和特殊的作用。据报道, 致倦库蚊CquiOR10和中华按蚊(An. sinensis)AsinOR10可以识别产卵地挥发出的3-Methylindole[15-16], 这可能与蚊虫寻找产卵地有关。在异源表达载体HEK293细胞膜上表达后, 白纹伊蚊OR10可以识别吲哚(indole)、1-辛烯-3-醇(1-octen-3-ol)和3-甲基吲哚(3-methyindole)。Indole是人体汗液的主要挥发物[17], 也存在于蚊虫的产卵地中。1-octen-3-o属于大型食草动物和人类的挥发物l[18], 3-methyindole是蚊虫产卵地和卵块的挥发物[19]。据此推断, 白纹伊蚊OR10可能与蚊虫吸血或者寻找产卵地有关。
本研究从白纹伊蚊雌性成蚊中扩增获得OR10基因, 其开放阅读框全长为1 128 bp, 编码376个氨基酸; 经与埃及伊蚊和冈比亚按蚊OR10基因的氨基酸序列比对, 一致性分别为86.13%和69.69%。荧光定量PCR结果发现白纹伊蚊雌蚊OR10基因的表达量明显高于雄蚊, 且吸血后的雌蚊表达量最高。本研究发现吸血的雌蚊OR10基因的表达量明显高于未吸血雌蚊, 由于雌蚊吸血后卵巢发育1~2 d后要寻找合适的产卵地产卵, 因此, 本研究从侧面辅证了白纹伊蚊OR10可能参与蚊虫产卵地寻找的功能, 从而为蚊虫防治提供新的思路。
| [1] |
Petersen EE, Polen KND, Meaney-Delman D, et al. Update:interim guidance for health care providers caring for women of reproductive age with possible zika virus exposure-United States, 2016[J]. MMWR Morb Mortal Wkly Rep, 2016, 65(5): 315-322. DOI:10.15585/mmwr.mm6512e2 |
| [2] |
Liu HM, Xie LH, Cheng P, et al. Trends in insecticide resistance in Culex pipiens pallens over 20 years in Shandong, China[J]. Parasit Vectors, 2019, 12(1): 167. DOI:10.1186/s13071-019-3416-9 |
| [3] |
Liu HM, Liu LH, Cheng P, et al. Bionomics and insecticide resistance of Aedes albopictus in Shandong, a high latitude and high-risk dengue transmission area in China[J]. Parasit Vectors, 2020, 13(1): 11. DOI:10.1186/s13071-020-3880-2 |
| [4] |
Liu HM, Liu T, Xie LH, et al. Functional analysis of Orco and odorant receptors in odor recognition in Aedes albopictus[J]. Parasit Vectors, 2016, 9: 363. DOI:10.1186/s13071-016-1644-9 |
| [5] |
Hallem EA, Carlson JR. Coding of odors by a receptor repertoire[J]. Cell, 2006, 125(1): 143-160. DOI:10.1016/j.cell.2006.01.050 |
| [6] |
Clyne PJ, Warr CG, Freeman MR, et al. A novel family of divergent seven-transmembrane proteins:candidate odorant receptors in Drosophila[J]. Neuron, 1999, 22(2): 327-338. DOI:10.1016/S0896-6273(00)81093-4 |
| [7] |
Vosshall LB, Amrein H, Morozov PS, et al. A spatial map of olfactory receptor expression in the Drosophila antenna[J]. Cell, 1999, 96(5): 725-736. DOI:10.1016/S0092-8674(00)80582-6 |
| [8] |
Fox AN, Pitts RJ, Zwiebel LJ. A cluster of candidate odorant receptors from the malaria vector mosquito, Anopheles gambiae[J]. Chem Senses, 2002, 27(5): 453-459. DOI:10.1093/chemse/27.5.453 |
| [9] |
Bohbot J, Pitts RJ, Kwon HW, et al. Molecular characterization of the Aedes aegypti odorant receptor gene family[J]. Insect Mol Biol, 2007, 16(5): 525-537. DOI:10.1111/j.1365-2583.2007.00748.x |
| [10] |
Chen XG, Jiang XT, Gu JB, et al. Genome sequence of the Asian Tiger mosquito, Aedes albopictus, reveals insights into its biology, genetics, and evolution[J]. Proc Natl Acad Sci USA, 2015, 112(44): E5907-E5915. DOI:10.1073/pnas.1516410112 |
| [11] |
Pelletier J, Hughes DT, Luetje CW, et al. An odorant receptor from the southern house mosquito Culex pipiens quinquefasciatus sensitive to oviposition attractants[J]. PLoS One, 2010, 5(4): e10090. DOI:10.1371/journal.pone.0010090 |
| [12] |
Carey AF, Carlson JR. Insect olfaction from model systems to disease control[J]. Proc Natl Acad Sci USA, 2011, 108(32): 12987-12995. DOI:10.1073/pnas.1103472108 |
| [13] |
Liu Z, Smagghe G, Lei ZR, et al. Identification of male- and female-specific olfaction genes in antennae of the oriental fruit fly (Bactrocera dorsalis)[J]. PLoS One, 2016, 11(2): e0147783. DOI:10.1371/journal.pone.0147783 |
| [14] |
Chen Q, Pei D, Li JY, et al. The antenna transcriptome changes in mosquito Anopheles sinensis, pre- and post-blood meal[J]. PLoS One, 2017, 12(7): e0181399. DOI:10.1371/journal.pone.0181399 |
| [15] |
Hughes DT, Pelletier J, Luetje CW, et al. Odorant receptor from the southern house mosquito narrowly tuned to the oviposition attractant skatole[J]. J Chem Ecol, 2010, 36(8): 797-800. DOI:10.1007/s10886-010-9828-9 |
| [16] |
Liu HM, Liu LH, Cheng P, et al. An odorant receptor from Anopheles sinensis in China is sensitive to oviposition attractants[J]. Malar J, 2018, 17(1): 348. DOI:10.1186/s12936-018-2501-4 |
| [17] |
Carey AF, Wang GR, Su CY, et al. Odorant reception in the malaria mosquito Anopheles gambiae[J]. Nature, 2010, 464(7285): 66-71. DOI:10.1038/nature08834 |
| [18] |
Xu PX, Zhu F, Buss GK, et al. 1-Octen-3-ol-the attractant that repels[J]. F1000Res, 2015, 4: 156. DOI:10.12688/f1000research.6646.1 |
| [19] |
Millar JG, Chaney JD, Mulla MS. Identification of oviposition attractants for Culex quinquefasciatus from Fermented Bermuda Grass Infusions[J]. J Am Mosq Control Assoc, 1992, 8(1): 11-17. |
 2020, Vol. 31
2020, Vol. 31


