扩展功能
文章信息
- 常锐锐, 陈海敏, 陈宏敏, 万晴, 乐倩倩, 张瑞玲, 张忠
- CHANG Rui-rui, CHEN Hai-min, CHEN Hong-min, WAN Qing, LE Qian-qian, ZHANG Rui-ling, ZHANG Zhong
- 家蝇幼虫肠道可培养非厌氧细菌对家蝇成虫取食及产卵的影响
- Effects of intestinal culturable non-anaerobic bacteria in Musca domestica larvae on feeding and oviposition of M. domestica adults
- 中国媒介生物学及控制杂志, 2020, 31(3): 294-299
- Chin J Vector Biol & Control, 2020, 31(3): 294-299
- 10.11853/j.issn.1003.8280.2020.03.010
-
文章历史
- 收稿日期: 2020-02-05
2 山东省新发传染病溯源与防控协同创新中心, 山东 泰安 271016;
3 山东第一医科大学基础医学院, 山东 泰安 271016
2 Shandong New Infectious Diseases Traceability and Cooperative Innovation Center for Prevention and Control;
3 Basic Medical College of Shandong First Medical University
在长期的协同进化过程中, 昆虫与其体内的共生菌形成了密切的共生关系, 它们相互影响、相互依赖、互不可缺[1-2]。这些共生菌调控着寄主的生殖、免疫、生长发育、寄主适应等功能[3-5], 还可影响昆虫的系统发育、生物地理学及分子系统学研究[6-9]。昆虫体内的共生菌可分为初级共生菌和次级共生菌, 前者主要与寄主的生殖或发育有关, 并进行严格的垂直传播, 如蚜虫体内的内共生菌(Buchnera)[10]、采采蝇体内的魏格沃斯菌(Wigglesworthia)[11]、飞虱体内的类酵母菌(Yeastlike symbiont)[12]及在昆虫体内普遍存在的沃尔巴克氏体(Wolbachia)等[13];后者多存在于昆虫肠道内, 主要与寄主的适应性有关, 可通过水平传播, 也可通过垂直传播, 为肠道共生菌[14-15]。肠道共生菌已成为昆虫学的研究热点之一[16-18], 肠道共生菌具有为昆虫提供营养[19]、延长寿命[20]、降解纤维素[21]、合成昆虫信息素成分[22]、利用拓殖抗性抵抗外来微生物侵袭、增强昆虫免疫反应和合成抗菌肽等功能[23-27], 对昆虫的生长、发育和繁殖等至关重要[28-30]。
蝇类肠道细菌对家蝇(Musca domestica)幼虫的生长发育、种群增长和体内酶活力均有显著影响。同时, 我们前期研究发现, 家蝇有聚集产卵和取食习性, 且喜欢聚集幼虫孳生的基质并产卵于其中。由于家蝇幼虫取食过程中, 边进食边排泄, 基质中可能存在其肠道中随食物排出的细菌, 这些细菌可能是吸引家蝇产卵或取食的重要因素。有鉴于此, 我们探索家蝇幼虫肠道细菌对其成虫的吸引现象及诱导产卵结果的影响。
1 材料与方法 1.1 材料 1.1.1 供试虫源家蝇为山东第一医科大学(山东省医学科学院)病媒生物与虫媒病实验室饲养的品系, 自2005年饲养至今。
1.1.2 主要试剂牛肉浸膏(天津市英博生化试剂有限公司生产), 蛋白胨(北京奥博星生物技术有限公司生产), 琼脂, Tris Base, Tris平衡酚, EDTA·Na2·2H2O, 50×TAE, 十六烷基三甲基溴化铵(CTAB), 十二烷基磺酸钠(SDS)(北京索来宝科技有限公司生产), NaOH(天津市巴斯夫化工有限公司生产), 胰蛋白胨, 酵母粉(Oxoid公司生产), 琼脂糖(BIOWEST公司生产), GoldviewⅡ型(上海翊圣生物科技有限公司生产), 蛋白酶K(Merck KGaA公司生产), 2K DNA Marker(北京全式金生物技术有限公司生产), 6×loading Buffer(北京全式金生物技术有限公司生产), 氯仿(北京化工厂生产), Tris平衡酚(北京索来宝科技有限公司生产), NaCl, 异丙醇, 异戊醇(天津市凯通化学试剂有限公司生产), 无水乙醇(天津市永大化学试剂有限公司生产), 高压后麦麸, 红糖, 全脂奶粉, 浸水脱脂棉, 无菌水, 养虫盒, 养虫笼, 培养皿, 离心管。
1.1.3 主要仪器设备GZX-250BS-Ⅲ光照培养箱(上海新苗医疗器械制造有限公司), PCR System 9700(美国), JS-Power300电泳仪(上海培清科技有限公司), JS-680D全自动凝胶成像分析仪(上海培清科技有限公司), 立式压力蒸汽灭菌器YXQ-LS-50G(上海博讯实业有限公司医疗设备厂), 电热恒温水浴锅HWS-28(上海一恒科学仪器有限公司), 恒温培养振荡器HNY-2102C(天津市欧诺仪器仪表有限公司)。
1.2 方法 1.2.1 家蝇幼虫肠道可培养细菌的分离与鉴定取5只3日龄自然条件下饲养的家蝇幼虫, 去除表面杂物后置于含75%乙醇溶液的1.5 ml离心管内, 浸泡消毒10 min, 然后用无菌去离子水漂洗3遍, 用于去除表面黏附的细菌。严格体表消毒完毕后将研磨器接入研磨棒, 充分研磨虫体。研磨液3倍稀释后, 取研磨液三区划线接种于牛肉膏蛋白胨固体培养基上, 将培养基平板倒置于37 ℃恒温培养箱内培养24~48 h。挑取单一菌落于新的培养基上, 不断分离纯化培养至分离到单一菌种。
挑取分离纯化的单菌落, 接种于5 ml LB液体中, 在恒温培养振荡器内37 ℃ 110 r/min培养过夜。取过夜培养的菌液1.5 ml于2.0 ml离心管中, 离心半径4 cm, 4 500 r/min离心5 min。弃去上清, 收集菌体。500 μl TE缓冲液使菌体充分重悬, 反复冻融3次, 然后加入10% SDS 60 μl和10 μl 20 mg/ml蛋白酶K, 轻轻颠倒混匀, 置于37 ℃水浴锅内水浴1 h。再加入80 μl 5 mol/L NaCl和100 μl 10 mol/L CTAB, 轻轻颠倒混匀, 置于65 ℃水浴锅内水浴0.5 h。在此粗提取液中加入750 μl酚:氯仿:异戊醇(体积比25:24:1), 颠倒混匀约10 min, 离心半径4 cm, 12 000 r/min离心10 min。取500 μl上清液, 并于上清液中加入750 μl氯仿:异戊醇(体积比24:1), 颠倒混匀约10 min, 离心半径4 cm, 12 000 r/min离心10 min, 取500 μl上清液, 此步骤重复2次。在上清液中加入500 μl异丙醇, 置于-20 ℃保持反应30 min后, 离心半径4 cm, 12 000 r/min离心10 min, 弃上清。用70%乙醇溶液1 000 μl洗涤沉淀DNA, 离心半径4 cm, 5 000 r/min离心30 s。弃液, 用移液枪吸去残留液体, 避免触碰管底DNA, 在空气中自然风干。最后加入灭菌去离子水40 μl溶解DNA, 于-20 ℃保存。
将提取的菌株DNA, 以27F/1527R细菌通用引物进行PCR扩增。引物序列:27F:5′-GAG TTT GAT CCT GGC TCA G-3′, 1527R:5′-AGA AAG GAG GTG ATC CAG CC-3′, 目标片段约1.5 kb。PCR反应体系如下:引物27F/1527R各1 μl;dNTP 4 μl;EasyTaq Buffer 5 μl;EasyTaq 0.5 μl;模板DNA 7 μl;以ddH2O补足体积至50 μl。PCR反应条件:94 ℃预变性4 min;94 ℃变性1 min, 55 ℃退火1 min, 72 ℃延伸2 min, 共计32个循环;72 ℃延伸10 min。扩增产物通过1.0%的琼脂糖凝胶电泳检测, 有目的条带的PCR产物送华大基因公司测序。
将从测序公司获得的序列在美国国立生物技术信息中心(NCBI)网站的GenBank上进行BLAST分析, 确定细菌的种或属。
1.2.2 家蝇幼虫肠道细菌对其成虫取食的选择将家蝇幼虫肠道菌发酵液和LB培养基原液分别加入红色和蓝色食用色素并混匀。在无菌环境下, 灭菌培养皿中放入均等的灭菌脱脂棉, 分别取3 ml菌液和LB培养基充分润湿脱脂棉并标记。将培养皿放入含有15只家蝇(饥饿处理24 h)的昆虫饲养笼中。置于温度为(25±1)℃, 相对湿度为(70±5)%, 光照周期(L:D)=12 h:12 h的恒温培养箱内。1 h后, 随机取家蝇5只, 转移至含有裁剪适当滤纸的培养皿中, 盖好上盖, 并标记。室温放置24 h后, 记录滤纸上红色和蓝色粪便的数量。同时, 对调菌液与LB培养基所染颜色, 重复上述操作, 以消除颜色对实验结果的影响(图 1)。

|
| 图 1 家蝇成虫取食选择实验设计结果 Figure 1 Design of feeding preference experiment on Musca domestica adults |
| |
用家蝇幼虫肠道菌发酵液作为实验组、LB培养基原液作为阴性对照组、无菌水作为空白对照组, 分别以1:2的比例与灭菌麦麸在50 ml烧杯中拌匀、标记并封上保鲜膜使其发酵12 h, 分别命名为肠道细菌产卵基质、LB产卵基质和无菌水产卵基质。将发酵完成的3种产卵基质, 呈等边三角形放置于30 cm×30 cm×30 cm的养虫笼内, 接入80只家蝇, 置于温度为(25±1)℃, 相对湿度(70±5)%, 光照周期(L:D)=12 h:12 h的恒温培养箱内, 每组均设3组重复, 且每次更换不同产卵基质所放位置不同。产卵2 h后, 取出盛有不同产卵基质的烧杯, 计数不同基质中的卵粒数(图 2)。

|
| 图 2 家蝇成虫产卵选择实验设计结果 Figure 2 Design of oviposition preference experiment on Musca domestica adults |
| |
利用SPSS 20.0软件对数据进行统计分析, 两两比较采用t检验, 多组比较采用多重比较。P<0.05为差异有统计学意义。
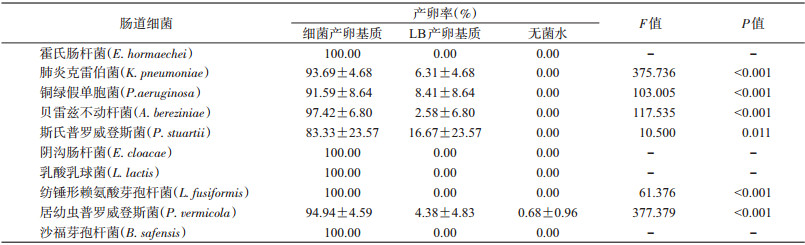
2 结果 2.1 家蝇幼虫肠道内分离出的可培养细菌从家蝇幼虫肠道内共分离出9属10种可培养非厌氧细菌, 分别为霍氏肠杆菌(Enterobacter hormaechei)、肺炎克雷伯菌(Klebsiella pneumoniae)、铜绿假单胞菌(Pseudomonas aeruginosa)、贝雷兹不动杆菌(Acinetobacter bereziniae)、斯式普罗威登斯菌(Providencia stuartii)、阴沟肠杆菌(E. cloacae)、乳酸乳球菌(Lactococcus lactis)、纺锤形赖氨酸芽孢杆菌(Lysinibacillus fusiformis)、居幼虫普罗威登斯菌(P. vermicola)和沙福芽孢杆菌(Bacillus safensis)。
2.2 家蝇幼虫肠道细菌对其成虫取食选择的影响实验结果表明, 有3种细菌对其取食有显著的吸引作用, 分别为霍氏肠杆菌(t=10.956, df=2, P<0.001), 取食菌液排泄粪便占总粪便数的(80.88±5.60)%;乳酸乳球菌(t=5.619, df=2, P=0.005), 取食菌液排泄粪便占总粪便数的(60.77±4.13)%;阴沟肠杆菌(t=5.619, df=2, P=0.005), 取食菌液排泄粪便占总粪便数的(61.59±4.13)%。而铜绿假单胞菌(t=6.413, df=2, P=0.003)、肺炎克雷伯菌(t=8.451, df=2, P=0.001)、斯式普罗威登斯菌(t=7.918, df=2, P=0.001)、贝雷兹不动杆菌(t=8.507, df=2, P=0.001)、居幼虫普罗威登斯菌(t=44.268, df=2, P<0.001)、纺锤形赖氨酸芽孢杆菌(t=3.640, df=2, P=0.022)和沙福芽孢杆菌(t=5.138, df=2, P=0.007)对家蝇成虫取食有显著抑制作用(表 1)。

|
家蝇幼虫细菌对成虫产卵均有显著吸引作用。其中, 霍氏肠杆菌、阴沟肠杆菌、乳酸乳球菌、纺锤形赖氨酸芽孢杆菌和沙福芽孢杆菌对家蝇成虫产卵吸引率可达100%(表 2)。实验表明, 家蝇成虫取食主要受营养调控, 产卵主要受气味调控(图 3)。

|
| 图 3 实验结论推断过程图 Figure 3 Diagram of the inferential process leading to the experimental conclusion |
| |
本研究应用对象为在开放环境(即非低氧分压状态)下生存的家蝇, 厌氧菌不可在开放环境下生存或生长, 因此本文仅对非厌氧菌进行探讨。
根据对家蝇取食不同颜色食物后, 排泄粪便数量的统计表明, 家蝇幼虫肠道中分离出的9属10种细菌中, 3种细菌对家蝇成虫取食有明显的吸引作用, 7种细菌对家蝇成虫取食有抑制作用。而家蝇成虫对含有家蝇幼虫肠道细菌的产卵基质均有显著的趋向性, 说明家蝇幼虫肠道细菌对成虫产卵具有明显的吸引作用。
家蝇幼虫和成虫均有群体孳生的习性, 当家蝇幼虫在一定的食物中进行孳生时, 其可能耗费大量的食物营养。因此, 对家蝇成虫的吸引力下降, 这可能是大部分家蝇幼虫肠道细菌驱避家蝇成虫的原因所在。同时, 家蝇幼虫孳生过程中, 其肠道中的共生细菌也会随其粪便排泄至孳生介质, 这些细菌可能也是驱避家蝇成虫取食的重要信号物质。而家蝇幼虫孳生过程中, 排泄产物(包括其中的肠道细菌)在孳生介质中散发出的气味, 可为家蝇成虫产卵时提供气味源, 因此对其产卵产生吸引作用。在家蝇自然孳生或人工饲养过程中, 均可在同一孳生场所发现不同龄期的幼虫, 这可能与家蝇幼虫孳生过程中产生的气味吸引成虫多次产卵有关。因此, 家蝇成虫取食主要受食物源中的营养调控, 而产卵主要受产卵介质中气味调控(图 3)。
对家蝇成虫取食有驱避作用的细菌可用于食物腌制时的蝇类驱避剂;对家蝇成虫取食有显著吸引作用的细菌, 则可用于家蝇成虫的新型引诱剂的研发, 这种细菌引诱剂特异性强, 持效期长, 可代替现有的腐鱼、馊饭或糖水等食物引诱剂, 同时与化学引诱剂如诱虫烯等相比成本低廉, 是一种有开发前景的新型家蝇引诱剂。家蝇幼虫肠道细菌对成虫产卵均有显著引诱效果, 可作为家蝇人工饲养过程中的诱卵剂, 可使家蝇定向集中产卵, 既可提高养殖效率, 又可降低劳动强度, 也有良好的应用前景。
| [1] |
Dillon RJ, Dillon VM. The gut bacteria of insects:nonpathogenic interactions[J]. Annu Rev Entomol, 2004, 49: 71-92. DOI:10.1146/annurev.ento.49.061802.123416 |
| [2] |
Chang PT, Rao K, Longo LO, et al. Thiopeptide defense by an ant's bacterial symbiont[J]. J Nat Prod, 2020. DOI:10.1021/acs.jnatprod.9b00897 |
| [3] |
Chung SH, Parker BJ, Blow F, et al. Host and symbiont genetic determinants of nutritional phenotype in a natural population of the pea aphid[J]. Mol Ecol, 2020. DOI:10.1111/mec.15355 |
| [4] |
Munzone A, El Kerdi B, Fanuel M, et al. Characterization of a bacterial copper-dependent lytic polysaccharide monooxygenase with an unusual second coordination sphere[J]. FEBS J, 2020. DOI:10.1111/febs.15203 |
| [5] |
Jones JE, Hurst GDD. Symbiont-mediated protection varies with wasp genotype in the Drosophila melanogaster-Spiroplasma interaction[J]. Heredity, 2020. DOI:10.1038/s41437-019-0291-2 |
| [6] |
Juárez ML, Pimper LE, Bachmann GE, et al. Gut bacterial diversity and physiological traits of Anastrepha fraterculus Brazilian-1 morphotype males are affected by antibiotic treatment[J]. BMC Microbiol, 2019, 19(Suppl 1): 283. DOI:10.1186/s12866-019-1645-x |
| [7] |
Kobiałka M, Michalik A, Świerczewski D, et al. Complex symbiotic systems of two treehopper species:Centrotus cornutus (Linnaeus, 1758) and Gargara genistae (Fabricius, 1775) (Hemiptera:Cicadomorpha:Membracoidea:Membracidae)[J]. Protoplasma, 2019. DOI:10.1007/s00709-019-01466-z |
| [8] |
Xu TT, Chen J, Jiang LY, et al. Diversity of bacteria associated with Hormaphidinae aphids (Hemiptera:Aphididae)[J]. Insect Sci, 2019. DOI:10.1111/1744-7917.12746 |
| [9] |
Blow F, Gioti A, Goodhead IB, et al. Functional genomics of a symbiotic community:shared traits in the olive fruit fly gut microbiota[J]. Genome Biol Evol, 2020, 12(2): 3778-3791. DOI:10.1093/gbe/evz258 |
| [10] |
Zhang B, Leonard SP, Li YY, et al. Obligate bacterial endosymbionts limit thermal tolerance of insect host species[J]. Proc Natl Acad Sci USA, 2019, 116(49): 24712-24718. DOI:10.1073/pnas.1915307116 |
| [11] |
Hall RJ, Flanagan LA, Bottery MJ, et al. A tale of three species:adaptation of Sodalis glossinidius to tsetse biology, Wigglesworthia metabolism, and host diet[J]. mBio, 2019, 10(1): e02106-18. DOI:10.1128/mBio.02106-18 |
| [12] |
Yukuhiro F, Miyoshi T, Noda H. Actin-mediated transovarial transmission of a yeastlike symbiont in the brown planthopper[J]. J Insect Physiol, 2014, 60: 111-117. DOI:10.1016/j.jinsphys.2013.11.010 |
| [13] |
Bing XL, Zhao DS, Sun JT, et al. Genomic analysis of Wolbachia from Laodelphax striatellus (Delphacidae, Hemiptera) reveals insights into its "Jekyll and Hyde" mode of infection pattern[J]. Genome Biol Evol, 2020. DOI:10.1093/gbe/evaa006 |
| [14] |
Kyritsis GA, Augustinos AA, Ntougias S, et al. Enterobacter sp. AA26 gut symbiont as a protein source for Mediterranean fruit fly mass-rearing and sterile insect technique applications[J]. BMC Microbiol, 2019, 19(Suppl 1): S288. DOI:10.1186/s12866-019-1651-z |
| [15] |
Lee J, Mao XR, Lee YS, et al. Putative host-derived growth factors inducing colonization of Burkholderia gut symbiont in Riptortus pedestris insect[J]. Dev Comp Immunol, 2020, 104: 103570. DOI:10.1016/j.dci.2019.103570 |
| [16] |
Hegde S, Nilyanimit P, Kozlova E, et al. CRISPR/Cas9-mediated gene deletion of the ompA gene in symbiotic Cedecea neteri impairs biofilm formation and reduces gut colonization of Aedes aegypti mosquitoes[J]. PLoS Negl Trop Dis, 2019, 13(12): e0007883. DOI:10.1371/journal.pntd.0007883 |
| [17] |
Michaud C, Hervé V, Dupont S, et al. Efficient but occasionally imperfect vertical transmission of gut mutualistic protists in a wood-feeding termite[J]. Mol Ecol, 2020, 29(2): 308-324. DOI:10.1111/mec.15322 |
| [18] |
Itoh H, Jang S, Takeshita K, et al. Host-symbiont specificity determined by microbe-microbe competition in an insect gut[J]. Proc Natl Acad Sci USA, 2019, 116(45): 22673-22682. DOI:10.1073/pnas.1912397116 |
| [19] |
Morrison M, Pope PB, Denman SE, et al. Plant biomass degradation by gut microbiomes:more of the same or something new?[J]. Curr Opin Biotechnol, 2009, 20(3): 358-363. DOI:10.1016/j.copbio.2009.05.004 |
| [20] |
Kashkouli M, Fathipour Y, Mehrabadi M. Heritable gammaproteobacterial symbiont improves the fitness of Brachynema germari Kolenati (Hemiptera:Pentatomidae)[J]. Environ Entomol, 2019, 48(5): 1079-1087. DOI:10.1093/ee/nvz089 |
| [21] |
Meng FQ, Bar-Shmuel N, Shavit R, et al. Gut bacteria of weevils developing on plant roots under extreme desert conditions[J]. BMC Microbiol, 2019, 19: 311. DOI:10.1186/s12866-019-1690-5 |
| [22] |
Schmidtberg H, Shukla SP, Halitschke R, et al. Symbiont-mediated chemical defense in the invasive ladybird Harmonia axyridis[J]. Ecol Evol, 2019, 9(4): 1715-1729. DOI:10.1002/ece3.4840 |
| [23] |
Gonella E, Mandrioli M, Tedeschi R, et al. Activation of immune genes in leafhoppers by phytoplasmas and symbiotic bacteria[J]. Front Physiol, 2019, 10: 795. DOI:10.3389/fphys.2019.00795 |
| [24] |
Bai L, Wang LL, Vega-Rodríguez J, et al. A gut symbiotic bacterium Serratia marcescens renders mosquito resistance to Plasmodium infection through activation of mosquito immune responses[J]. Front Microbiol, 2019, 10: 1580. DOI:10.3389/fmicb.2019.01580 |
| [25] |
Zhang YL, Kong LC, Jiang DH, et al. Phytotoxic and antifungal metabolites from Curvularia sp. FH01 isolated from the gut of Atractomorpha sinensis[J]. Bioresour Technol, 2011, 102(3): 3575-3577. DOI:10.1016/j.biortech.2010.10.028 |
| [26] |
Shao YQ, Chen BS, Sun C, et al. Symbiont-derived antimicrobials contribute to the control of the Lepidopteran gut microbiota[J]. Cell Chem Biol, 2017, 24(1): 66-75. DOI:10.1016/j.chembiol.2016.11.015 |
| [27] |
谭周进, 肖启明, 谢丙炎, 等. 昆虫内共生菌研究概况[J]. 微生物学通报, 2005, 32(4): 140-143. Tan ZJ, Xiao QM, Xie BY, et al. A review on endosymbionts in insects[J]. Microbiol China, 2005, 32(4): 140-143. DOI:10.3969/j.issn.0253-2654.2005.04.028 |
| [28] |
Li Q, Fan J, Sun JX, et al. Anti-plant defense response strategies mediated by the secondary symbiont Hamiltonella defensa in the wheat aphid Sitobion miscanthi[J]. Front Microbiol, 2019, 10: 2419. DOI:10.3389/fmicb.2019.02419 |
| [29] |
Lee JB, Park KE, Lee SA, et al. Gut symbiotic bacteria stimulate insect growth and egg production by modulating hexamerin and vitellogenin gene expression[J]. Dev Comp Immunol, 2017, 69: 12-22. DOI:10.1016/j.dci.2016.11.019 |
| [30] |
Devescovi F, Conte CA, Augustinos A, et al. Symbionts do not affect the mating incompatibility between the Brazilian-1 and Peruvian morphotypes of the Anastrepha fraterculus cryptic species complex[J]. Sci Rep, 2019, 9: 18319. DOI:10.1038/s41598-019-54704-y |
 2020, Vol. 31
2020, Vol. 31