扩展功能
文章信息
- 王博, 李鑫, 毛玲玲, 孙英伟, 王子江, 于维君, 姚文清
- WANG Bo, LI Xin, MAO Ling-ling, SUN Ying-wei, WANG Zi-jiang, YU Wei-jun, YAO Wen-qing
- 辽宁省间日疟原虫裂殖子表面蛋白1基因型及同源性分析
- A genotype and homology analysis of Plasmodium vivax merozoite surface protein 1 in Liaoning province, China
- 中国媒介生物学及控制杂志, 2020, 31(2): 194-198
- Chin J Vector Biol & Control, 2020, 31(2): 194-198
- 10.11853/j.issn.1003.8280.2020.02.015
-
文章历史
- 收稿日期: 2019-10-25
- 网络出版时间: 2020-03-03 16:28
疟疾(Malaria)是热带地区和亚热带地区流行且能够严重威胁到生命的疾病。在4种感染人体的疟原虫中,间日疟原虫在过去几十年里最为常见、分布范围最广[1]。在非洲大陆以外地区,间日疟的流行程度要大于恶性疟,在拉丁美洲国家报告的病例中有70%为间日疟[2-3],但由于间日疟存在一些结构性或功能性的蛋白基因,如间日疟原虫裂殖子表面蛋白1(Plasmodium vivax merozoite surface protein-1,PvMSP-1)、间日疟原虫环子孢子蛋白(Plasmodium vivax circumsporozoite protein,PvCSP)等基因,这些多种等位基因不断地发生突变,随之导致了间日疟原虫的免疫性和致病性也持续地发生改变。研究结果表明,这种不同种群间的结构变化和疟原虫自身的遗传生物学特征性变异两者之间的关系逐渐引起了学者们的重视,它为预测间日疟原虫的根本溯源和流行病的传播轨迹提供了重要的基本实验数据。本研究的PvMSP-1存在于疟原虫的红内期,是属于十分活跃的功能性蛋白,本身积累的多态性信息足以用来诊断间日疟原虫比较基因组学研究[4],它具有很强的抗原性和免疫原性,能够广泛表达在间日疟原虫裂殖子的表面上并且参与到一切免疫反应的优势抗原,是研究间日疟原虫的重要标记靶抗原之一,也是检测疟原虫较为有价值的多态性标记物之一[5]。它的基因发生改变,也会导致间日疟致病性发生改变。不仅在国与国之间,间日疟的分离基因型不同,我国间日疟的分离株亦存在不同的基因型[6-8]。间日疟原虫在显微镜下的形态区分上并不明显,单纯依靠形态学进行鉴定十分困难。应用研究PvMSP-1保守区的两侧ICB5和ICB6区组成第5区域的变异多态性的特征,根据该区域氨基酸组成的类型分成Sal型和Belem型[9]。本研究收集了2008-2018年输入性和本地感染间日疟原虫患者的病例样本,对其进行PvMSP-1基因型和同源性分析。
1 材料与方法 1.1 样本采集收集2008-2018年期间辽宁省网报输入性和本地感染的间日疟患者全血标本,样本病例输入性病例主要来自于印度尼西亚、尼日利亚、赤道几内亚、印度、朝鲜、刚果金、缅甸和柬埔寨,本地病例来自于辽宁省丹东市。用DNA提取试剂盒(QIAgen Minikit)提取样本核酸100 μl,有效扩增并完成测序标本共31份。
1.2 主要试剂DNA提取试剂盒(QIAgen Minikit)购自德国QIAgen公司,Ex Taq DNA聚合酶和DNA Marker购自宝生物工程(大连)有限公司10×Loading Buffer(R0001A),PCR仪T Gradient 96(Biometra,德国),稳压稳流电泳仪DYY-8B(北京六一仪器厂),凝胶成像系统为Universal Hood Ⅱ(BIO-RAD,Amreica),琼脂糖为西班牙品牌SIGMA VETEC,电子天平METTLER TOLEPO AL104。
1.3 实验方法PvMSP-1基因型巢氏PCR的扩增依据参考文献[10]的方法,根据其目的片段的保守区ICB5-ICB6设计扩增引物,引物见表 1,WF和WR为外套引物,位于PvMSP-1基因ICB5-ICB6两端的位置;NF和NR为内套引物。用外套引物WF和WR进行第1轮PCR反应,反应的总体积为50 μl,其中10×Buffer 5 μl,脱氧核苷三磷酸(dNTP,2.5 mmol/L)4 μl,Taq DNA聚合酶(5 U/μl)0.5 μl,WF和WR引物各1μl,核酸DNA模板5 μl,无RNA酶水33.5 μl。反应条件:94 ℃预变性3 min;94 ℃变性60 s,58 ℃退火60 s,72 ℃延伸1.5 min,共35个循环;72 ℃总延伸5 min。取第1轮的产物5 μl为模板,用内套引物NF和NR作套式PCR检测,反应总体积为50 μl,其中10×Loading Buffer 5 μl,脱氧核苷三磷酸(dNTP,2.5 mmol/L)4 μl,Taq DNA聚合酶(5 U/μl)0.5 μl,WF和WR引物各1 μl,DNA模板6 μl,无RNA酶水32.5 μl。PCR的反应条件:94 ℃预变性3 min;94 ℃变性60 s,58 ℃退火60 s,72 ℃延伸60 s,共35个循环;72 ℃总延伸5 min。第2轮PCR产物6 μl进行琼脂糖凝胶电泳,置于凝胶成像系统为Universal Hood Ⅱ(BIO-RAD,Amreica)中观察结果并拍照扩增出的产物,如果在470 bp左右出现条带为Sal-1型,在400 bp出现条带则为Belem型。
将PCR扩增出的片段位置大小在470和400 bp的2种阳性产物进行电泳后,使用纯化DNA的试剂盒对其扩增的阳性产物进行纯化,按照试剂盒的使用说明书进行操作,送交Invitrogen(上海维基)基因测序公司进行测序分析。根据测得的序列结果进行BLAST相似性比对,从GenBank中选取具有代表性的标准序列,并与样品序列共同导入Bioedit 7.0软件中进行序列比对。以GenBank中选取部分间日疟原虫分离株的序列作为参考,并与样品序列共同导入MEGA 6.0软件中构建进化树,用DNAStar软件进行同源性分析。PvMSP-1基因参考株为Belem型参考株M60807和HB02-AY465380;Sal-1型参考株为M75674、AY538671、AY538667、GQ890955、AY465382、EU048259、AY465377、AY229866、AY465395、AY46538、AY465389、AY465398、AY538669和HQ171940,Ⅲ型为AY465391、AY465386、AF502161、AF216677、AY465400和AY538673。
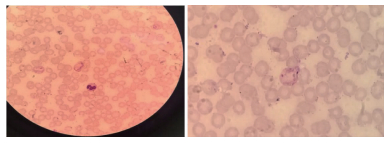
2 结果 2.1 显微镜下间日疟原虫的形态感染间日疟原虫的红细胞要比正常的红细胞明显胀大,红细胞颜色明显变成浅染,红细胞内充满薛氏点(图 1)。
|
| 注:M. DNA标志物;1~33.间日疟病例检测样本。 图 1 感染间日疟原虫的红细胞形态(吉氏染色,×1 000) Figure 1 Red blood cell morphology of Plasmodium vivax (Giemsa staining, ×1 000) |
| |
由图 2可以看出,在分析的31份间日疟核酸样本中,其中Sal-1型有13份,片段位置在470 bp左右;Belem型有18份,片段位置在400 bp左右。

|
| 图 2 间日疟患者血液样品的裂殖子表面蛋白1基因型 Figure 2 Genotypes of merozoite surface protein 1 in blood samples from patients with Plasmodium vivax |
| |
以GenBank中选取部分间日疟原虫分离株的代表序列作为参考,并与样品序列共同导入MEGA 6.0软件中构建进化树,用DNAStar软件进行同源性分析。由图 3可见,LN3、LN16、LN17、LN22、LN24与登录号M60807和AY465380属于同一个分支,属于Belem型;LN2、LN5、LN9、LN13、LN18、LN19、LN21、LN25、LN26、LN29、LN33、LN30、LN32与登录号M75674在一个分支,属于Sal-1型。虽然都在一个分支上,但是其中LN25、LN21、LN29与AY538671、AY538667、GQ890955亲缘性更近;LN2、LN26与AY465382、EU048259、AY465377、AY229866、AY465395、AY465381亲缘性更近;LN33、LN5、LN9、LN13、LN18、1N19、LN30、LN32与AY465389、AY465398、AY538669、HQ171940亲缘性更近。LN1、LN4、LN6、LN8、LN10、LN11、LN12、LN14、LN20、LN23、LN27、LN31、LN28则与AY465391、AY465386、AF502161、AF216677、AY465400、AY538673属于同一个分支,属于Ⅲ型(我国又分为朝鲜型和重组Ⅲ型)。

|
| 图 3 疟原虫裂殖子表面蛋白1基因型进化树分析结果 Figure 3 Results of phylogenetic tree analysis of Plasmodium vivax merozoite surface protein 1 genotypes |
| |
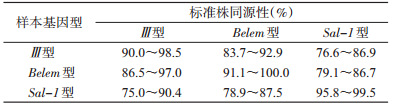
将各个基因型代表株的核苷酸进行比较,通过同源性的比例更能直观分析不同型别之间的差异。辽宁省Ⅲ型样本与BLAST数据库中的代表株Ⅲ型核苷酸同源性最高,达到了90.0%~98.5%;Belem型样本与代表株Belem型核苷酸同源性最高,可达91.1%~100%;Sal-1型样本与代表株Sal-1型核苷酸同源性最高可达95.8%~99.5%,见表 2。
世界卫生组织要求我国到2020年消除疟疾,自2010年开展疟疾消除行动工作以来,辽宁省2010-2014年已无本地病例报告[11]。但2015年在辽宁省丹东地区的獐子岛出现了2例本地感染间日疟病例,并对这2例病例进行详细的疫情分析[12],辽宁省仍然存在多种疟疾的传播媒介[13]。因此,明确PvMSP-1基因型别及同源性分析,了解辽宁省间日疟基因型的遗传特征和流行病的传播规律,对实时有效的防控疟疾工作具有十分重要的意义。
通过本研究的间日疟病例样本能够分析得出验证,PvMSP-1这种功能性的蛋白基因容易发生重组变异,并且具有较强的多变性,我国不同区域之间的地理株也显示出该基因具有广泛的基因多态性[14-16]。根据研究者的数据表明,间日疟原虫PvMSP-1基因存在着3对双态等位序列,重组后理论上能够形成8种不同的基因型[17]。PvMSP-1基因位于间日疟原虫第8号染色体位置,保守区和可变区均能发生碱基交换重组导致新的等位基因不断出现,是导致PvMSP-1基因结构多样性的主要原因[18]。目前已发现的8种基因型别中常见的有Sal-1型、Ⅲ型(我国又分成朝鲜型和重组Ⅲ型)、Ⅳ型和Belem型。PvMSP-1基因进化已经累积的多态信息足以作为标识之一用于间日疟原虫比较基因组学研究[4, 19]。我国地理环境差别十分巨大,各个地域之间的间日疟PvMSP-1基因由于遗传结构和流行特征的不同存在着明显差异,导致了基因分布也有所不同。我国北纬25°以南和以北部分地区间日疟种群中Sal-1型出现频率高达94%[10],是我国间日疟的优势基因。本研究应用了巢氏PCR方法,结合了DNA测序比对和构建进化树对辽宁省间日疟患者全血样本进行实验室研究分析。从构建的进化树结果分析,辽宁省的PvMSP-1基因主要存在着3种等位基因型,其中以Sal-1型和Ⅲ型(我国又具体分为朝鲜型和重组Ⅲ型)为主,是辽宁省的优势基因型,其次是Belem型,与耿英芝等[8]指出的辽宁省丹东市间日疟以Sal-1型和朝鲜型分析一致,可能与辽宁省所处的平原地理环境位置紧邻朝鲜半岛有关。目前PV-1型和PV-Ⅱ型分离株分布广泛,PV-Ⅲ型分离株流行范围则比较局限[20]。本研究表明,虽然PvMSP-1基因存在着不同等位基因型之间会出现基因重组现象,但是在辽宁省这种型别并未发生较大改变,这为辽宁省间日疟原虫的分子流行病学和遗传规律提供了重要数据参考。
从本研究结果可以看出,辽宁省输入性及本地感染间日疟主要是Sal-1型和Ⅲ型,其次是Belem型,说明Sal-1型和Ⅲ型依然是辽宁省的优势基因型,并未发生过较大的基因型改变,也未发现新的型别。通过这一结论能够了解辽宁省的优势基因,掌握近10年PvMSP-1基因的遗传规律和流行趋势,为今后能够更好地研究间日疟原虫的遗传结构、流行特征性变化以及全省的疟疾消除和防控工作提供了精准的数据支持。
| [1] |
Price RN, Tjitra E, Guerra CA, et al. Vivax malaria:neglected and not Benign[J]. Am J Trop Med Hyg, 2008, 77(6 Suppl): S79-87. |
| [2] |
World Health Organization. World malaria report 2014[R]. Geneva: WHO, 2014: 3.
|
| [3] |
Carlton JM, Adams JH, Silva JC, et al. Comparative genomics of the neglected human malaria parasite Plasmodium vivax[J]. Nature, 2008, 455(7214): 757-763. DOI:10.1038/nature07327 |
| [4] |
Maneerattanasak S, Gosi P, Krudsood S, et al. Genetic diversity among Plasmodium vivax isolates along the Thai-Myanmar border of Thailand[J]. Malar J, 2016, 15: 75. DOI:10.1186/s12936-016-1136-6 |
| [5] |
Leclerc MC, Gauthier C, Villegas L, et al. Genetic diversity of merozoite surface protein-1 gene of Plasmodium vivax isolates in mining villages of Venezuela (Bolivar State)[J]. Acta Trop, 2005, 95(1): 26-32. DOI:10.1016/j.actatropica.2005.03.007 |
| [6] |
Huang B, Huang SG, Su XZ, et al. Genetic diversity of Plasmodium vivax population in Anhui province of China[J]. Malar J, 2014, 13: 13. DOI:10.1186/1475-2875-13-13 |
| [7] |
Li YC, Wang GZ, Meng F, et al. Genetic diversity of Plasmodium vivax population before elimination of malaria in Hainan province, China[J]. Malar J, 2015, 14: 78. DOI:10.1186/s12936-015-0545-2 |
| [8] |
耿英芝, 毛玲玲, 腾冲, 等. 辽宁丹东间日疟原虫裂殖子表面蛋白1等位基因型分析[J]. 中国寄生虫学与寄生虫病杂志, 2012, 30(3): 242-244. Geng YZ, Mao LL, Teng C, et al. Allele genetype analysis of Plasmodium vivax merozoite surface protein1(PvMSP-1) from Dandong, Liaoning province[J]. Chin J Parasitol Parasit Dis, 2012, 30(3): 242-244. |
| [9] |
江钢锋, 李娟兰, 吴少廷, 等. 我国华南间日疟原虫裂殖子表面蛋白1等位基因分型和序列分析[J]. 中国人兽共患病杂志, 2002, 18(2): 57-60. Jiang GF, Li JL, Wu ST, et al. Genotyping and sequence analysis of PvMSP1 of Plasmodium vivax isolates from China[J]. Chin J Zoonoses, 2002, 18(2): 57-60. DOI:10.3969/j.issn.1002-2694.2002.02.015 |
| [10] |
张山鹰, 陆惠民, 许龙善, 等. 我国不同疟区间日疟原虫裂殖子表面蛋白1(PvMSP-1)基因多态性研究[J]. 中国人兽共患病杂志, 2004, 20(11): 26-30. Zhang SY, Lu HM, Xu LS, et al. Polymorphism analysis of Plasmodium vivax merozoite surface protein 1(PvMSP-1) gene from different malaria-endemic area of China[J]. Chin J Zoonoses, 2004, 20(1): 26-30. DOI:10.3969/j.issn.1002-2694.2004.01.007 |
| [11] |
滕聪, 雷露, 孙英伟, 等. 2008-2013年辽宁省疟疾流行病学分析[J]. 中国血吸虫病防治杂志, 2014, 26(2): 200-202. Teng C, Lei L, Sun YW, et al. Prevalence of malaria in Liaoning province, 2008 to 2013[J]. Chin J Schisto Control, 2014, 26(2): 200-202. DOI:10.16250/j.32.1374.2014.02.005 |
| [12] |
孙英伟, 于丹梅, 陈君, 等. 辽宁省丹东市两例间日疟病例报告疫情分析[J]. 中国公共卫生, 2017, 33(2): 314-316. Sun YW, Yu DM, Chen J, et al. Two individual incidences of vivax malaria in Dandong municipality of Liaoning province[J]. Chin J Public Health, 2017, 33(2): 314-316. |
| [13] |
丁俊, 禇发军, 耿英芝, 等. 辽宁省雷氏按蚊分布和构成[J]. 中国公共卫生, 2014, 30(4): 475-477. Ding J, Chu FJ, Geng YZ, et al. Distribution and composition of Anopheles sinensis in Liaoning province[J]. Chin J Public Health, 2014, 30(4): 475-477. |
| [14] |
Del Portillo HA, Longacre S, Khouri E, et al. Primary structure of the merozoite surface antigen 1 of Plasmodium vivax reveals sequences conserved between different Plasmodium species[J]. Proc Natl Acad Sci USA, 1991, 88(9): 4030-4034. DOI:10.1073/pnas.88.9.4030 |
| [15] |
Gibson HL, Tucker JE, Kaslow DC, et al. Structure and expression of the gene for Pv200, a major blood-stage surface antigen of Plasmodium vivax[J]. Mol Biochem Parasitol, 1992, 50(2): 325-333. DOI:10.1016/0166-6851(92)90230-H |
| [16] |
Premawansa S, Snewin VA, Khouri E, et al. Plasmodium vivax:recombination between potential allelic types of the merozoite surface protein MSP1 in parasites isolated from patients[J]. Exp Parasitol, 1993, 76(2): 192-199. DOI:10.1006/expr.1993.1022 |
| [17] |
Kolakovich KA, Ssengoba A, Wojcik K, et al. Plasmodium vivax:favored gene frequencies of the merozoite surface protein-1 and the multiplicity of infection in a malaria endemic region[J]. Exp Parasitol, 1996, 83(1): 11-18. DOI:10.1006/expr.1996.0044 |
| [18] |
Putaporntip C, Jongwutiwes S, Sakihama N, et al. Mosaic organization and heterogeneity in frequency of allelic recombination of the Plasmodium vivax merozoite surface protein-1 locus[J]. Proc Natl Acad Sci USA, 2002, 99(25): 16348-16353. DOI:10.1073/pnas.252348999 |
| [19] |
Zhong DB, Bonizzoni M, Zhou GF, et al. Genetic diversity of Plasmodium vivax malaria in China and Myanmar[J]. Infect Genet Evol, 2011, 11(6): 1419-1425. DOI:10.1016/j.meegid.2011.05.009 |
| [20] |
刘颖, 许汴利, 杨成运, 等. 间日疟原虫环子孢子蛋白(PvCSP)基因多态性研究进展[J]. 中国病原生物学杂志, 2016, 11(1): 90-93. Liu Y, Xu BL, Yang CY, et al. Study on polymorphism of the circumsporozoite protein (CSP) gene of Plasmodium vivax[J]. J Pathogen Biol, 2016, 11(1): 90-93. DOI:10.13350/j.cjpb.160121 |
 2020, Vol. 31
2020, Vol. 31