扩展功能
文章信息
- 朱彩英, 赵春春, 刘起勇, 李贵昌, 闫冬明, 宋秀平, 王君, 孟凤霞
- ZHU Cai-ying, ZHAO Chun-chun, LIU Qi-yong, LI Gui-chang, YAN Dong-ming, SONG Xiu-ping, WANG Jun, MENG Feng-xia
- 我国不同地理种群白纹伊蚊乙酰胆碱酯酶基因分布调查
- Distribution of the ace gene of Aedes albopictus in different geographical populations in China
- 中国媒介生物学及控制杂志, 2020, 31(2): 133-136, 142
- Chin J Vector Biol & Control, 2020, 31(2): 133-136, 142
- 10.11853/j.issn.1003.8280.2020.02.003
-
文章历史
- 收稿日期: 2020-03-03
- 网络出版时间: 2020-03-11 10:23
2 山东第一医科大学公共卫生学院, 山东 泰安 271016
2 School of Public Health, Shandong First Medical University
白纹伊蚊(Aedes albopictus)在我国分布广泛,北至辽宁省,南至海南省,西至西藏自治区,且其在西北地区的分布区有向西扩展的倾向[1-4]。白纹伊蚊可传播登革热、基孔肯雅热与寨卡病毒病等多种重要传染病[5-7]。其主要的防控措施包括清理积水容器、使用杀蚊幼剂和使用成蚊控制杀虫剂进行空间喷洒和滞留喷洒等。然而,随着化学杀虫剂的长期大量使用,白纹伊蚊抗药性随之发生和发展,同时,媒介蚊虫伴随人类频繁流动而被动扩散,种群的基因流动性加强,促使抗性基因扩散,抗药性问题已成为全球白纹伊蚊防制的重大障碍[8]。
乙酰胆碱酯酶(acetylcholinestrase,AChE)是有机磷和氨基甲酸酯类杀虫剂的作用靶标,由乙酰胆碱酯酶基因(ace)编码[9]。有机磷和氨基甲酸酯类杀虫剂通过共价磷酸化或氨基甲酰化AChE活性位点的丝氨酸残基而抑制酶活性,使乙酰胆碱在突触间的作用时间延长,引起突触后膜乙酰胆碱受体超兴奋,通过干扰胆碱能突触而引起神经系统的严重障碍,从而达到杀虫目的。ace基因发生突变导致AChE对杀虫剂的敏感度下降,从而产生抗药性[10]。淡色库蚊(Culex pipiens pallens)和冈比亚按蚊(Anopheles gambiae)的AChE均由双基因编码[11-12],埃及伊蚊(Ae. aegypti)、斯氏按蚊(An. stephensi)、脉毛蚊(Culiseta nipponica)的AChE则由单基因编码[13]。白纹伊蚊AChE由单基因ace-1编码[14]。ace基因靠近活性中心的G119位点甘氨酸(Glycine,Gly)被丝氨酸(Serine,Ser)替代,是昆虫体内较为经典的突变位点,已在多种蚊虫中得到鉴定。对野外淡色库蚊和中华按蚊(An. sinensis)种群研究发现ace基因的Gly-119-Ser型突变,表现出对有机磷和氨基甲酸酯类杀虫剂产生高抗药性[15-16]。
目前,关于白纹伊蚊ace基因及其突变的研究甚少。白纹伊蚊ace基因是否存在Gly-119-Ser突变,以及该突变与有机磷和氨基甲酸酯类杀虫剂抗性的关系如何,都尚未可知。2018年,本课题组通过分析全国病媒生物抗药性监测系统中的抗药性监测资料,并结合中国知网与万方数据库中的抗药性监测数据,筛选出生物测定结果显示,对有机磷和氨基甲酸酯类杀虫剂已经产生可疑或低度抗性、中度或高度抗性的白纹伊蚊地理种群。本研究以此为实验材料,对其ace基因进行突变检测,以进行白纹伊蚊对有机磷和氨基甲酸酯类杀虫剂抗药性机制的初步探索。
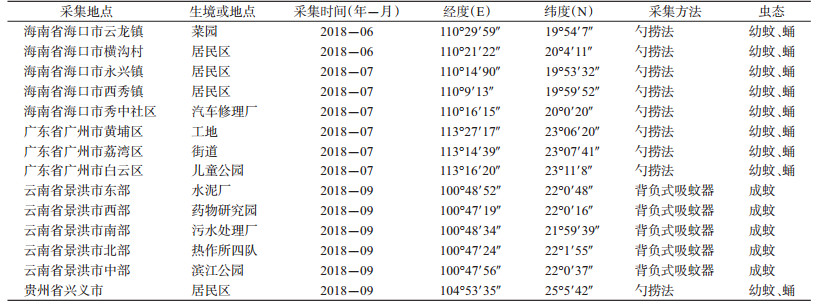
1 材料与方法 1.1 试虫来源2018年6-9月,在海南省海口市、广东省广州市、云南省景洪市和贵州省兴义市范围内的14个采样点,使用勺捞法采集白纹伊蚊幼蚊、蛹,使用背负式吸蚊器采集白纹伊蚊成蚊,共采集蚊虫422只。采集点详细信息如表 1所示。
|
DNA提取试剂盒购自北京百泰克生物技术有限公司,2×Taq PCR预混液购自北京全式金生物技术有限公司,引物由北京奥科鼎盛生物科技有限公司合成。
1.3 ace基因型检测 1.3.1 种类鉴定一方面,依据白纹伊蚊成蚊中胸盾片具有中央银白纵条这一形态学特征对成蚊进行鉴定;另一方面,采用张恒端[17]设计的细胞色素C氧化酶亚基Ⅰ(COⅠ)引物对白纹伊蚊全基因组核酸进行扩增后测序,依据测序结果对幼虫和蛹进行鉴定。COⅠ引物信息如下:正向引物COⅠ F:5′-GGC CAA CAA ATC ATA AAG ATA TTG G-3′,反向引物COI R:5′-TAA ACT TCA GGG TGA CCA AAA AAT CA-3′。PCR反应体系中包含2× Taq PCR预混液12.5 μl,10 μmol/L正、反向引物各1 μl,DNA模板2 μl,加双蒸水至25 μl。反应条件:94 ℃ 3 min;94 ℃ 60 s,51 ℃ 60 s,72 ℃ 60 s,共35个循环;72 ℃ 8 min,4 ℃保存。扩增产物经1%琼脂糖凝胶电泳检测后,条带清晰无拖尾的PCR产物送北京奥科鼎盛生物科技有限公司进行反向测序。
1.3.2 蚊虫全基因组DNA的提取经形态学或分子生物学方法鉴定为白纹伊蚊的单只蚊虫样本,利用磁珠法微量组织基因组DNA提取试剂盒Ⅱ(预封装)提取基因组DNA。
1.3.3 ace基因的扩增和测序以基因组DNA为模板扩增ace基因的部分片段。扩增引物信息为正向L119:5′-CTG TTC GAA TTG TAG ATG CCG A-3′,反向R119:5′-TCC CAA ACT AGC CAC ACG AT-3′。PCR反应体系中包含2× Taq PCR预混液12.5 μl,10 μmol/L正、反向引物各1 μl,DNA模板2 μl,加双蒸水至25 μl。反应条件:94 ℃ 3 min;94 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s,共35个循环;72 ℃ 8 min,4 ℃保存。扩增产物经1%琼脂糖凝胶电泳检测后,条带清晰无拖尾的PCR产物送北京奥科鼎盛生物科技有限公司进行反向测序。测序引物为反向R119:5′-TCC CAA ACT AGC CAC ACG AT-3′。
1.4 序列比对和统计学分析应用Seqman、MEGA 7.0软件对测得的序列进行比对和峰图分析,观察各位点突变情况,确定等位基因类型和基因型,用Excel 2016软件统计和计算各采集地试虫ace基因的等位基因和基因型频率。
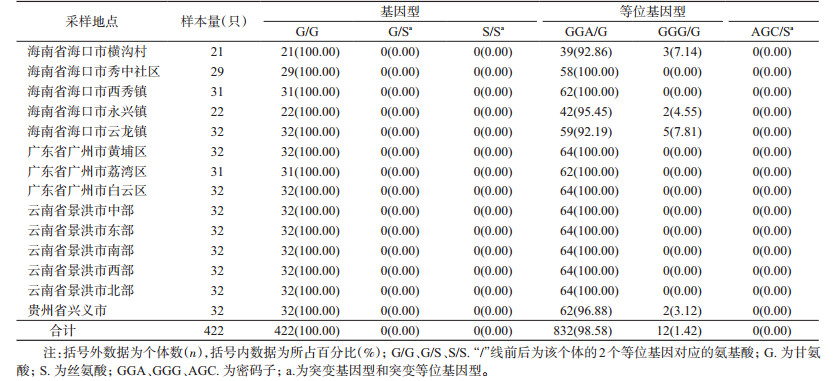
2 结果 2.1 白纹伊蚊ace基因G119位点的基因型及频率对海口、广州、景洪和兴义市范围内14个地理种群的白纹伊蚊ace基因进行检测,共获得422条DNA序列,在GenBank上进行BLAST对比,与白纹伊蚊ace基因序列一致性达99.00%(AB210122.1),证实所得为白纹伊蚊ace基因部分片段。对序列进行比对分析发现,G119位点存在单个碱基突变(图 1),并未观察到相应的氨基酸替换。G119位点只有1种基因型,即野生型纯合子G/G(422/100%)。

|
| 注:A.野生型纯合子(GGA/GGA);B.野生型杂合子(双峰:GGA/GGG);C.野生型纯合子(GGG/GGG);GGA、GGG.为编码甘氨酸的密码子;G/G.为基因型;“/”线前后为该个体的2个等位基因对应的氨基酸;G.为甘氨酸。 图 1 白纹伊蚊ace基因测序图谱 Figure 1 Sequence map of the ace gene of Aedes albopictus |
| |
422只白纹伊蚊样本中,其ace基因G119位点共观测到2种等位基因型。其一是编码甘氨酸的野生型GGA/G,等位基因型频率高达98.58%;另一种也是编码甘氨酸的野生型GGG/G,这种情况较少见,其等位基因型频率为1.42%。观测到野生型GGG/G等位基因的种群为海口市横沟村(3/7.14%)、永兴镇(2/4.55%)和云龙镇(5/7.81%),以及贵州省兴义市(2/3.12%)。在以上的14个野外白纹伊蚊种群中,并未观测到编码丝氨酸的野生型等位基因AGC/S,见表 2。
|
ace 基因G119位点的Gly-119-Ser突变已经在多种蚊虫中检测到。李春晓等[18]的研究证实ace基因的敏感性降低与淡色库蚊抗性种群的抗性形成有关;冈比亚按蚊、尖音库蚊(Cx. pipiens pipiens)和致倦库蚊(Cx. pipiens quinquefasciatus)中也发现了该突变现象[11, 19]。
但是,本研究对白纹伊蚊ace基因进行检测,仅发现个别样本出现单个碱基突变,并未观测到相应的氨基酸突变。张恒端[17]对南京市白纹伊蚊ace基因进行扩增后测序,在残杀威抗性种群中也未检测到Gly-119-Ser突变。究其原因,可能与白纹伊蚊ace基因G119位点编码甘氨酸的密码子是GGA,若要发生甘氨酸与丝氨酸的替代,需要1个以上的碱基发生改变才能突变为编码丝氨酸的密码子AGC,所以发生概率低[14]。现有研究结果表明,我国白纹伊蚊对拟除虫菊酯类杀虫剂已经产生了严重的抗药性。有机磷和氨基甲酸酯类杀虫剂作为白纹伊蚊防控的后备军,应用前景广阔。因此,探究白纹伊蚊对有机磷和氨基甲酸酯类杀虫剂的抗药性分子机制,极为紧迫和必要。本研究结果提示,或许今后,我们可以着眼于非特异性酯酶(ESTs)和谷胱甘肽-S-转移酶等代谢抗性酶系基因的研究,进而阐明白纹伊蚊对有机磷和氨基甲酸酯类杀虫剂的抗性机制。
志谢 海南省卫生有害生物防制协会、广东惠利民公共卫生健康研究院有限公司、云南省寄生虫病防治所和贵州省疾病预防控制中心协助采集白纹伊蚊样本,一并志谢| [1] |
吴凡.中国白纹伊蚊的分布和影响因素及登革热的风险评估研究[D].北京: 中国疾病预防控制中心, 2009. Wu F. A study on the potential distribution of Aedes albopictus and risk forecasting for future epidemics of dengue in China[D]. Beijing: Chinese Center for Disease Control and Prevention, 2009. http://cdmd.cnki.com.cn/Article/CDMD-84501-2009203578.htm |
| [2] |
李国太, 付鸿, 郭玉红, 等. 甘肃省长江流域地区白纹伊蚊地理分布调查[J]. 中国媒介生物学及控制杂志, 2010, 21(3): 248-249. Li GT, Fu H, Guo YH, et al. Geographical distribution of Aedes albopictus in the Yangtze River basin in Gansu province[J]. Chin J Vector Biol Control, 2010, 21(3): 248-249. |
| [3] |
孙养信, 佘建军, 孙亮, 等. 陕西省白纹伊蚊分布边界及影响因素调查[J]. 中国媒介生物学及控制杂志, 2009, 20(5): 430-432. Sun YX, She JJ, Sun L, et al. Study on dividing line and influence factor of Aedes albopictus in Shaanxi province[J]. Chin J Vector Biol Control, 2009, 20(5): 430-432. |
| [4] |
施耀勇, 张军民. 西北地区白纹伊蚊地理分布初步调查[J]. 中华卫生杀虫药械, 2012, 18(5): 420-421. Shi YY, Zhang JM. Preliminary investigation on geographic distribution of Aedes albopictus in Northwest China[J]. Chin J Hyg Insect Equip, 2012, 18(5): 420-421. DOI:10.19821/j.1671-2781.2012.05.018 |
| [5] |
刘转转.白纹伊蚊感染寨卡病毒和登革病毒的媒介能力研究[D].广州: 南方医科大学, 2017. Liu ZZ. Vector competence of Aedes albopictus infected with Zika and dengue virus[D]. Guangzhou: Southern Medical University, 2017. http://cdmd.cnki.com.cn/Article/CDMD-12121-1017229889.htm |
| [6] |
张海林, 米竹青, 张云智. 白纹伊蚊和埃及伊蚊对基孔肯雅病毒的易感性和传播性的研究[J]. 中国病毒学, 1994, 9(3): 195-200. Zhang HL, Mi ZQ, Zhang YZ. Susceptibility and transmissibility of Aedes albopictus and Aedes aegypti mosquitoes to Chikungunya virus[J]. Virol Sin, 1994, 9(3): 195-200. |
| [7] |
黄慕嫦, 盛钊君, 区博文, 等. 江门市白纹伊蚊幼虫的抗药性现状调查[J]. 中华卫生杀虫药械, 2018, 24(4): 345-347. Huang MC, Sheng ZJ, Ou BW, et al. Investigation on insecticide resistance of Aedes albopictus in Jiangmen city[J]. Chin J Hyg Insect Equip, 2018, 24(4): 345-347. |
| [8] |
Xia XF, Sun BT, Gurr GM, et al. Gut microbiota mediate insecticide resistance in the diamondback moth, Plutella xylostella (L.)[J]. Front Microbiol, 2018, 9: 25. DOI:10.3389/fmicb.2018.00025 |
| [9] |
Dang K, Doggett SL, Singham GV, et al. Insecticide resistance and resistance mechanisms in bed bugs, Cimex spp. (Hemiptera:Cimicidae)[J]. Parasit Vector, 2017, 10(1): 318. DOI:10.1186/s13071-017-2232-3 |
| [10] |
刘宏美, 代玉华, 公茂庆. 蚊虫抗药性分子机制研究进展[J]. 中国媒介生物学及控制杂志, 2012, 23(4): 366-369. Liu HM, Dai YH, Gong MQ. Progress in molecular mechanisms of mosquito resistance to insecticides[J]. Chin J Vector Biol Control, 2012, 23(4): 366-369. DOI:10.11853/j.issn.1003.8280.2016.05.028 |
| [11] |
Weill M, Lutfalla G, Mogensen K, et al. Insecticide resistance in mosquito vectors[J]. Nature, 2003, 423(6936): 136-137. DOI:10.1038/423136b |
| [12] |
Holt RA, Subramanian GM, Halpern A, et al. The genome sequence of the malaria mosquito Anopheles gambiae[J]. Science, 2002, 298(5591): 129-149. DOI:10.1126/science.1076181 |
| [13] |
张玲敏, 吴明玮. 白纹伊蚊乙酰胆碱酯酶基因片段克隆及序列分析[J]. 中国寄生虫病防治杂志, 2003, 16(1): 47-51. Zhang LM, Wu MW. Clone and sequence analysis of the acetylcholinesterase gene fragment from Aedes albopictus[J]. Chin J Para Dis Control, 2003, 16(1): 47-51. DOI:10.3969/j.issn.1673-5234.2003.01.016 |
| [14] |
邱星辉. 白纹伊蚊抗药性分子机制研究进展[J]. 寄生虫与医学昆虫学报, 2019, 26(3): 194-198. Qiu XH. Current knowledge about the molecular mechanisms underlying insecticide resistance in Aedes albopictus[J]. Acta Parasitol Med Entomol Sin, 2019, 26(3): 194-198. |
| [15] |
Alout H, Labbé P, Berthomieu A, et al. Multiple duplications of the rare ace-1 mutation F290V in Culex pipiens natural populations[J]. Insect Biochem Mol Biol, 2009, 39(12): 884-891. DOI:10.1016/j.ibmb.2009.10.005 |
| [16] |
Cheung J, Mahmood A, Kalathur R, et al. Structure of the G119S mutant acetylcholinesterase of the malaria vector Anopheles gambiae reveals basis of insecticide resistance[J]. Structure, 2018, 26(1/2): 130-136. DOI:10.1016/j.str.2017.11.021 |
| [17] |
张恒端.南京市白纹伊蚊种群遗传学研究[D].北京: 中国人民解放军军事医学科学院, 2015. Zhang HD. Study on population genetics characteristics of Aedes albopictus in Nanjing city[D]. Beijing: Academy of Military Medical Sciences, 2015. http://cdmd.cnki.com.cn/Article/CDMD-90106-1015382225.htm |
| [18] |
李春晓, 董言德, 赵彤言. 淡色库蚊对残杀威抗性与酯酶和乙酰胆碱酯酶的关系研究[J]. 中国媒介生物学及控制杂志, 2007, 18(1): 9-11. Li CX, Dong YD, Zhao TY. Relationship of esterase, acetylcholinesterase and propoxur-resistance to Culex pipiens pallens[J]. Chin J Vector Biol Control, 2007, 18(1): 9-11. DOI:10.3969/j.issn.1003-4692.2007.01.003 |
| [19] |
Feng XY, Yang C, Yang YC, et al. Distribution and frequency of G119S mutation in ace-1 gene within Anopheles sinensis populations from Guangxi, China[J]. Malaria J, 2015, 14(1): 470. DOI:10.1186/s12936-015-1000-0 |
 2020, Vol. 31
2020, Vol. 31


