扩展功能
文章信息
- 朱彩英, 赵春春, 伦辛畅, 朱进, 李洪斌, 姜进勇, 闫冬明, 宋秀平, 王君, 孟凤霞
- ZHU Cai-ying, ZHAO Chun-chun, LUN Xin-chang, ZHU Jin, LI Hong-bin, JIANG Jin-yong, YAN Dong-ming, SONG Xiu-ping, WANG Jun, MENG Feng-xia
- 云南省景洪市2018-2019年白纹伊蚊击倒抗性基因型分布研究
- Distribution of knockdown resistance genotypes in Aedes albopictus in Jinghong, Yunnan province, China, 2018-2019
- 中国媒介生物学及控制杂志, 2020, 31(1): 7-11
- Chin J Vector Biol & Control, 2020, 31(1): 7-11
- 10.11853/j.issn.1003.8280.2020.01.002
-
文章历史
- 收稿日期: 2019-08-30
- 网络出版时间: 2019-12-30 09:35
2 西双版纳傣族自治州疾病预防控制中心, 云南 西双版纳 666100;
3 云南省寄生虫病防治所, 云南 普洱 665099
2 Xishuangbanna Dai Autonomous Prefecture Center for Disease Control and Prevention;
3 Yunnan Institute of Parasitic Diseases
白纹伊蚊(Aedes albopictus)是我国常见蚊种之一,也是全球最具侵袭性的蚊种[1],可传播登革热、流行性乙型脑炎、寨卡病毒病和基孔肯雅热等多种重要传染病[2-5]。使用化学杀虫剂控制蚊虫密度是传染病防控的关键。然而,随着杀虫剂的长期、大量使用,蚊媒的抗药性也随之发生和发展[6]。同时,媒介蚊虫伴随人类频繁流动而被动扩散,种群的基因流动性加强,促使抗性基因的产生速度加快,导致媒介昆虫抗药性不断增加。蚊虫对杀虫剂的抗性机制包括靶标抗性、代谢抗性、表皮抗性和行为抗性[7]。靶标抗性是指昆虫对各类杀虫剂的靶标位点敏感度降低而引起的抗性。电压门控钠离子通道(voltage-gated sodium channel,VGSC)是拟除虫菊酯类杀虫剂的主要靶标位点,由VGSC基因编码,该基因突变可以降低其对杀虫剂的亲和力,从而产生击倒抗性(knockdown resistance,kdr)[8-9]。白纹伊蚊VGSC基因F1534C突变首次在新加坡被发现[10],我国近年来对I1532和F1534位点展开相关研究,发现F1534S与白纹伊蚊对菊酯类杀虫剂的抗性表型密切相关[11-13]。Kasai等[14]对采自意大利和越南的白纹伊蚊野外种群VGSC基因进行研究,发现1个新突变V1016G,且该突变与F1534C和F1534S比较,提示白纹伊蚊对拟除虫菊酯类杀虫剂产生更高程度的抗性。我国北京白纹伊蚊种群该位点也检测到一定程度的突变[15]。
景洪市位于云南省南端,西双版纳傣族自治州(西双版纳州)中部,是中国进入东南亚各国和对外交流的一座重要港口城市,近年来登革热形势十分严峻[16]。本课题组于2018年9月至2019年7月采集景洪市白纹伊蚊,检测其VGSC基因各位点及联合突变情况,以了解当前白纹伊蚊对拟除虫菊酯类杀虫剂的抗性情况,为抗性分子机制研究奠定基础,为疫情防控提供依据。
1 材料与方法 1.1 试虫来源2018年9月和2019年7月,在景洪市东、西、南、北、中5个方位选择有代表性的地区,使用背负式吸蚊器采集白纹伊蚊成蚊。采集点分别为景洪市东部水泥厂、西部药物研究园、南部污水处理厂、北部热作所四队和中部滨江公园(表 1)。共采集蚊虫160只。
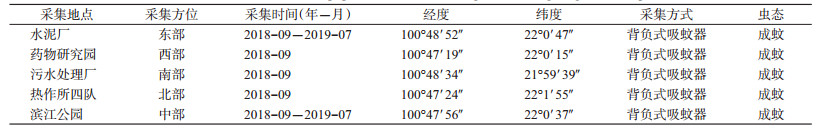 |
DNA提取试剂盒购自北京百泰克生物技术有限公司,2×Taq PCR预混液购自北京全式金生物技术有限公司,引物由北京奥科鼎盛生物科技有限公司合成。
1.3 VGSC基因型检测 1.3.1 蚊虫全基因组DNA的提取经形态学方法鉴定为白纹伊蚊的单只成虫样本,置于DNA提取试剂盒中,按照说明书提取基因组DNA。
1.3.2 VGSC基因的扩增和测序以基因组DNA为模板扩增VGSC基因的第Ⅱ、Ⅲ跨膜结构域的部分片段,参照文献[10, 14]合成引物。扩增第Ⅱ结构域的引物为aegSCF20:5′-GAC AAT GTG GAT CGC TTC CC-3′,aegSCR21:5′-GCA ATC TGG CTT GTT AAC TTG-3′。PCR反应体系中包含2× Taq PCR预混液12.5 μl,10 μmol/L正、反向引物各1 μl,加双蒸水至25 μl。反应条件:94 ℃ 3 min;94 ℃ 30 s,58 ℃ 30 s,72 ℃ 30 s,共35个循环;72 ℃ 8 min,4 ℃保存。扩增第Ⅲ结构域的引物为aegSCF7:5′-GAG AAC TCG CCG ATG AAC TT-3′,反向aegSCR7:5′-GAC GAC GAA ATC GAA CAG GT-3′。PCR反应体系中包含2×Taq PCR预混液12.5 μl,10 μmol/L正、反向引物各1 μl,加双蒸水至25 μl。反应条件:94 ℃ 2 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,共35个循环;72 ℃ 8 min,4 ℃保存。扩增产物经1%琼脂糖凝胶电泳检测后,条带清晰无拖尾的PCR产物送北京奥科鼎盛生物科技有限公司测序。第Ⅱ结构域测序引物为aegSCR22:5′-TTC ACG AAC TTG AGC GCG TTG-3′,第Ⅲ结构域测序引物为aegSCR8:5′-TAG CTT TCA GCG GCT TCT TC-3′。
1.4 序列比对和统计学分析应用Seqman、MEGA 7.0软件对测得的序列进行比对和峰图分析,观察各位点突变情况,确定等位基因类型和基因型,用Excel 2016软件统计和计算各采集地试虫VGSC基因的等位基因和基因型频率。
2 结果 2.1 VGSC基因的等位基因和基因型对云南省景洪市5个地理种群的白纹伊蚊进行检测,共获得320条DNA序列,在GenBank上进行BLAST对比,与白纹伊蚊VGSC基因第Ⅱ、Ⅲ编码区的部分序列一致性达99.00%(KC152045.1和KC152046.1),证实所得为白纹伊蚊VGSC基因部分片段。对序列进行比对分析发现,V1016、I1532和F1534位点存在突变(图 1)。V1016位点有2种等位基因,即编码缬氨酸的野生型GTA/V(239/74.69%),编码甘氨酸的突变型GGA/G(81/25.31%);3种基因型,即野生型纯合子V/V(91/56.88%)、野生/突变型杂合子V/G(58/36.25%)和突变型纯合子G/G(11/6.88%)。I1532位点有2种等位基因,即编码异亮氨酸的野生型ACC/I(309/96.56%)和编码苏氨酸的突变型ATC/T(11/3.44%);2种基因型,即野生型纯合子I/I(149/93.13%)、野生/突变型杂合子I/T(11/6.87%)。F1534位点有4种等位基因,即编码苯丙氨酸的野生型TTC/F(92/28.75%)、编码丝氨酸的突变型TCC/S(221/69.06%)、编码半胱氨酸的突变型TGC/C(6/1.88%)和编码亮氨酸的突变型TTG/L(1/0.31%);5种基因型,分别为野生型纯合子F/F(10/6.25%),野生/突变型杂合子F/S(69/43.13%)和F/L(1/0.63%),突变型纯合子S/S(77/48.13%)和C/C(3/1.88%),见表 2。
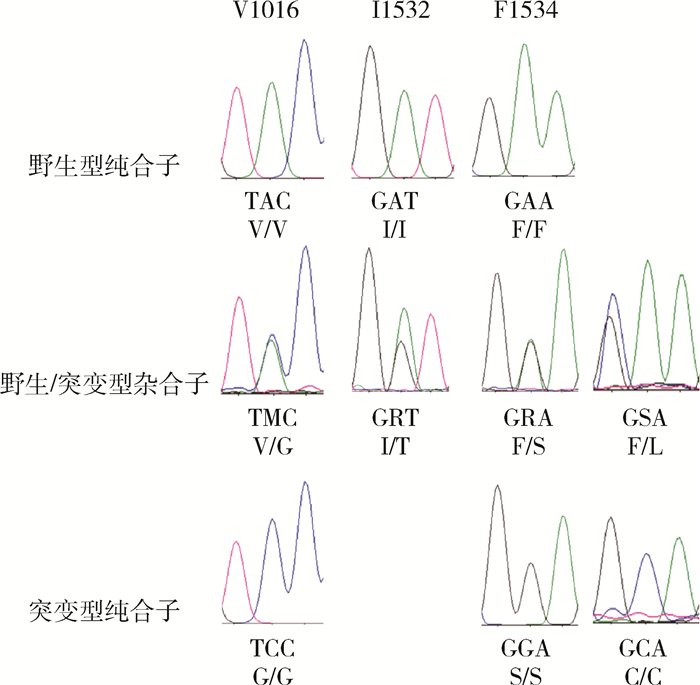
|
| 注:TAC、GAT、GAA、TMC、GRT、GRA、GSA、TCC、GGA、GCA.为密码子;V/V、V/G、G/G、I/I、I/T、F/F、F/S、F/L、S/S、C/C. “/”线前后为该个体的2个等位基因对应的氨基酸;V.为缬氨酸;G.为甘氨酸;I.为异亮氨酸;T.为苏氨酸;F.为苯丙氨酸;S.为丝氨酸;C.为半胱氨酸;L.为亮氨酸。 图 1 云南省景洪市白纹伊蚊击倒抗性突变测序峰图 Figure 1 A sequencing chromatogram of kdr mutations in Aedes albopictus populations in Jinghong, Yunnan province, China |
| |
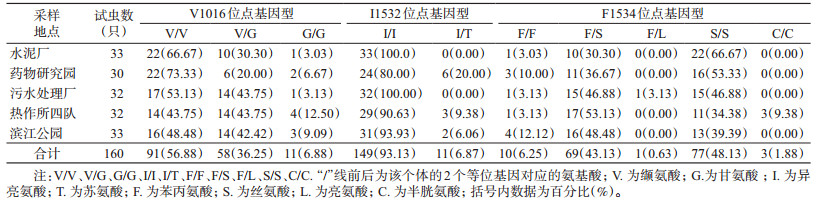 |
V1016位点的突变等位基因仅有GGA/G 1种类型,各地理种群均发现V1016位点突变,热作所四队的突变频率最高(37.50%),药物研究园最低(15.00%)。I1532位点突变总体处于低水平状态,药物研究园突变频率最高(10.00%),水泥厂和污水处理厂均未发现I1532位点突变。F1534位点突变较V1016和F1532位点更为频繁,且类型多样。突变等位基因共3种类型,以TCC/S为主,水泥厂该等位基因型频率高达81.82%;其他突变等位基因型频率均较低,TGC/C型频率高于TTG/L型,见图 2。
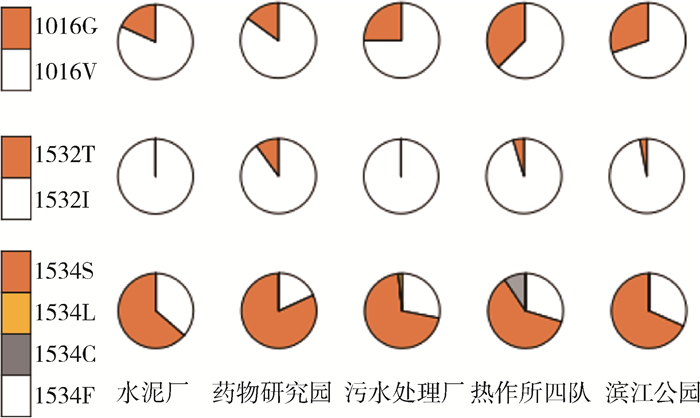
|
| 注:1016G、1016V、1532T、1532I、1534S、1534L、1534C、1534F.为等位基因类型;G.为甘氨酸;V.为缬氨酸;T.为苏氨酸;I.为异亮氨酸;S.为丝氨酸;L.为亮氨酸;C.为半胱氨酸;F.为苯丙氨酸。 图 2 云南省景洪市白纹伊蚊击倒抗性突变等位基因类型及频率 Figure 2 Allele types and frequencies of kdr mutations in Aedes albopictus in Jinghong, Yunnan province, China |
| |
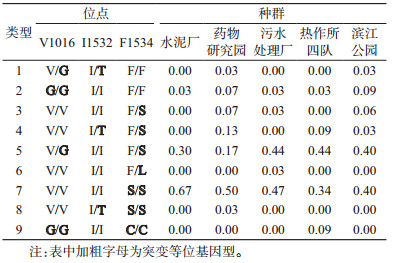
160只白纹伊蚊样本中,检测到9种突变基因型组合,见表 3。研究发现,景洪市东、南、西、北、中5个方位白纹伊蚊种群VGSC基因均存在至少1个有义位点突变,但均未见3个有义位点同时突变,也未检测到3个位点均为野生型纯合子的个体。各种群突变组合丰富多样,同中存异。G/G+I/I+F/F、V/G+I/I+F/S和V/V+I/I+S/S型组合在5个种群中均存在,以V/V+I/I+S/S型发生频率最高,V/G+I/I+F/S型次之,G/G+I/I+F/F型发生频率最低;而V/V+I/T+S/S型组合仅在药物研究园发现,G/G+I/I+C/C型组合仅在热作所四队发现。
 |
景洪市南与缅甸接壤,近年来登革热疫情形势十分严峻[16-17]。白纹伊蚊是登革热等多种蚊媒传染病的传播媒介,因此,白纹伊蚊防控至关重要。准确、客观地评价其抗药性水平,是防控基础。本研究采集景洪市东、西、南、北、中5个方位的白纹伊蚊,从分子层面客观地探究了抗药性水平,为当地登革热防控提供依据和指导。除了常见的I1532和F1534位点,本课题组还首次对新发现的V1016位点进行研究。研究表明,景洪市白纹伊蚊VGSC基因V1016、I1532和F1534位点均存在突变。V1016位点检测到野生/突变型杂合子和突变纯合子,与Zhou等[15]的研究一致,Kasai等[14]对意大利和越南白纹伊蚊进行研究也得出相同结果;突变等位基因频率范围为15.00%~37.50%,总体突变水平较北京市低。I1532位点只发现一定比例的野生/突变型杂合子,未检测到突变型纯合子,且总体突变等位基因频率较低(3.44%),与陈翰明等[13]研究结论一致。F1534位点突变丰富多样,野生/突变杂合子包括F/S和F/L型,突变纯合子包括S/S及C/C型,突变等位基因频率范围高达63.63%~81.82%,高于该地2016-2017年的突变水平[13]。
此外,本研究还对V1016、I1532和F1534位点联合突变进行研究,共检测到9种突变基因型组合,但未见3个有义位点同时突变,也未检测到3个位点均为野生型纯合子的个体。此外,G/G+I/I+C/C型组合在白纹伊蚊种群中首次被报道。陈翰明等[13]也发现该地区存在I1532和F1534位点同时突变的个体,推测当地高频使用各种类型的拟除虫菊酯类杀虫产品,使其暴露于较强选择压力之下所致。埃及伊蚊(Ae. aegypti)种群中多个位点同时突变已证明可以产生降低蚊虫对杀虫剂敏感性的叠加效应[18-19],白纹伊蚊种群是否存在这种叠加效应还有待进一步研究。
以上研究结果表明,景洪市白纹伊蚊对拟除虫菊酯类杀虫剂已产生高水平抗性,且近年来抗性发展呈现上升趋势。2017年,师灿南[20]对景洪市白纹伊蚊幼蚊抗药性监测发现,其对苏云金杆菌以色列亚种(Bacillus thuringiensis israelensis,Bti)、多杀菌素和除虫脲表现敏感。因此,建议当地调整用药策略,应用Bti、多杀菌素和除虫脲等环境安全、高效的生物杀虫剂进行蚊虫控制。
| [1] |
吴凡.中国白纹伊蚊的分布和影响因素及登革热的风险评估研究[D].北京: 中国疾病预防控制中心, 2009. Wu F. A study on the potential distribution of Aedes albopictus and risk forecasting for future epidemics of dengue in China[D]. Beijing: Chinese Center for Disease Control and Prevention, 2009. http://cdmd.cnki.com.cn/Article/CDMD-84501-2009203578.htm |
| [2] |
张海林, 米竹青, 张云智. 白纹伊蚊垂直传播乙型脑炎病毒的研究[J]. 病毒学报, 1996(1): 42-47. Zhang HL, Mi ZQ, Zhang YZ. Vertical transmission of Japanese encephalitis virus in Aedes albopictus mosquitoes[J]. Chin J Virol, 1996(1): 42-47. DOI:10.13242/j.cnki.bingduxuebao.000958 |
| [3] |
刘转转.白纹伊蚊感染寨卡病毒和登革病毒的媒介能力研究[D].广州: 南方医科大学, 2017. Liu ZZ. Vector competence of Aedes albopictus infected with Zika and dengue virus[D]. Guangzhou: Southern Medical University, 2017. http://cdmd.cnki.com.cn/Article/CDMD-12121-1017229889.htm |
| [4] |
张海林, 米竹青, 张云智. 白纹伊蚊和埃及伊蚊对基孔肯雅病毒的易感性和传播性的研究[J]. 中国病毒学, 1994, 9(3): 195-200. Zhang HL, Mi ZQ, Zhang YZ. Susceptibility and transmissibility of Aedes albopictus and Ae. aegypti mosquitoes to Chikungunya virus[J]. Virol Sin, 1994, 9(3): 195-200. |
| [5] |
黄慕嫦, 盛钊君, 区博文, 等. 江门市白纹伊蚊幼虫的抗药性现状调查[J]. 中华卫生杀虫药械, 2018, 24(4): 345-347. Huang MC, Sheng ZJ, Ou BW, et al. Investigation on insecticide resistance of Aedes albopictus in Jiangmen city[J]. Chin J Hyg Insect Equip, 2018, 24(4): 345-347. |
| [6] |
于辛酉.蚊抗药性检测靶标基因的筛选、鉴定及现场初步应用[D].南京: 南京医科大学, 2012. Yu XY. Screening, identification and field application of drug resistance target genes in mosquitoes[D]. Nanjing: Nanjing Medical University, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10312-1012485430.htm |
| [7] |
Dang K, Doggett SL, Singham GV, et al. Insecticide resistance and resistance mechanisms in bed bugs, Cimex spp. (Hemiptera:Cimicidae)[J]. Parasit Vectors, 2017, 10(1): 318. DOI:10.1186/s13071-017-2232-3 |
| [8] |
Ismail BA, Kafy HT, Sulieman JE, et al. Temporal and spatial trends in insecticide resistance in Anopheles arabiensis in Sudan:outcomes from an evaluation of implications of insecticide resistance for malaria vector control[J]. Parasit Vectors, 2018, 11: 122. DOI:10.1186/s13071-018-2732-9 |
| [9] |
Zoh DD, Alou LPA, Toure M, et al. The current insecticide resistance status of Anopheles gambiae (s.l.) (Culicidae) in rural and urban areas of Bouaké, Côte d'Ivoire[J]. Parasit Vectors, 2018, 11: 118. DOI:10.1186/s13071-018-2702-2 |
| [10] |
Kasai S, Ng LC, Lam-Phua SG, et al. First detection of a putative knockdown resistance gene in major mosquito vector, Aedes albopictus[J]. Jpn J Infect Dis, 2011, 64(3): 217-221. |
| [11] |
赵春春, 朱彩英, 开文龙, 等. 海口市2018年白纹伊蚊击倒抗性基因型分布研究[J]. 中国媒介生物学及控制杂志, 2019, 30(1): 7-11. Zhao CC, Zhu CY, Kai WL, et al. Genotypes of knockdown resistance gene and their distribution in Aedes albopictus in Haikou, China, in 2018[J]. Chin J Vector Biol Control, 2019, 30(1): 7-11. DOI:10.11853/j.issn.1003.8280.2019.01.002 |
| [12] |
王晓花, 陈辉莹, 杨新艳, 等. 海口市白纹伊蚊对菊酯类杀虫剂的抗药性及击倒抗性基因突变分析[J]. 第二军医大学学报, 2015, 36(8): 832-838. Wang XH, Chen HY, Yang XY, et al. Resistance to pyrethroid insecticides and analysis of knockdown resistance (kdr) gene mutations in Aedes albopictus from Haikou city[J]. Acad J Second Mil Med Univ, 2015, 36(8): 832-838. DOI:10.3724/SP.J.1008.2015.00832 |
| [13] |
陈翰明, 高景鹏, 姜进勇, 等. 我国白纹伊蚊现场群体击倒抗性基因I1532和F1534突变检测及I1532T突变等位基因报告[J]. 中国媒介生物学及控制杂志, 2018, 29(2): 120-125. Chen HM, Gao JP, Jiang JY, et al. Detection of the I1532 and F1534 kdr mutations and a novel mutant allele I1532T in VGSC gene in the field populations of Aedes albopictus from China[J]. Chin J Vector Biol Control, 2018, 29(2): 120-125. |
| [14] |
Kasai S, Caputo B, Tsunoda T, et al. First detection of a Vssc allele V1016G conferring a high level of insecticide resistance in Aedes albopictus collected from Europe (Italy) and Asia (Vietnam), 2016:a new emerging threat to controlling arboviral diseases[J]. Eurosurveillance, 2019, 24(5): 1700847. DOI:10.2807/1560-7917 |
| [15] |
Zhou XJ, Yang C, Liu N, et al. Knockdown resistance (kdr) mutations within seventeen field populations of Aedes albopictus from Beijing China:first report of a novel V1016G mutation and evolutionary origins of kdr haplotypes[J]. Parasit Vectors, 2019, 12(1): 180. DOI:10.1186/s13071-019-3423-x |
| [16] |
杨明东, 姜进勇, 郭晓芳, 等. 2009-2014年云南省登革热流行病学调查与分析[J]. 中国病原生物学杂志, 2015, 10(8): 738-742. Yang MD, Jiang JY, Guo XF, et al. Epidemiological analysis and investigation of dengue fever in Yunnan province from 2009 to 2014[J]. J Pathog Biol, 2015, 10(8): 738-742. DOI:10.13350/j.cjpb.150816 |
| [17] |
孟凤霞, 王义冠, 冯磊, 等. 我国登革热疫情防控与媒介伊蚊的综合治理[J]. 中国媒介生物学及控制杂志, 2015, 26(1): 4-10. Meng FX, Wang YG, Feng L, et al. Review on dengue prevention and control and integrated mosquito management in China[J]. Chin J Vector Biol Control, 2015, 26(1): 4-10. DOI:10.11853/j.issn.1003.4692.2015.01.002 |
| [18] |
Plernsub S, Saingamsook J, Yanola J, et al. Additive effect of knockdown resistance mutations, S989P, V1016G and F1534C, in a heterozygous genotype conferring pyrethroid resistance in Aedes aegypti in Thailand[J]. Parasit Vectors, 2016, 9(1): 417. DOI:10.1186/s13071-016-1713-0 |
| [19] |
Smith LB, Kasai S, Scott JG. Voltage-sensitive sodium channel mutations S989P+V1016G in Aedes aegypti confer variable resistance to pyrethroids, DDT and oxadiazines[J]. Pest Manag Sci, 2018, 74(3): 737-745. DOI:10.1002/ps.4771.Epub2017Dec8 |
| [20] |
师灿南.景洪市登革热媒介伊蚊对常用杀虫剂的抗药性及机制初步研究[D].北京: 中国疾病预防控制中心, 2017. Shi CN. Insecticides resistance and its underlying mechanisms for dengue vectors Aedes albopictus and Ae. aegypti in Jinghong city, Yunnan province[D]. Beijing: Chinese Center for Disease Control and Prevention, 2017. http://cdmd.cnki.com.cn/Article/CDMD-84501-1017219823.htm |
 2020, Vol. 31
2020, Vol. 31


