扩展功能
文章信息
- 万晴, 黄振东, 薛志静, 乐倩倩, 张瑞玲, 张忠
- WAN Qing, HUANG Zhen-dong, XUE Zhi-jing, LE Qian-qian, ZHANG Rui-ling, ZHANG Zhong
- 家蝇幼虫肠道细菌拮抗球孢白僵菌菌株的筛选
- Screening for intestinal bacterial strains against Beauveria bassiana from Musca domestica larvae
- 中国媒介生物学及控制杂志, 2020, 31(1): 36-40
- Chin J Vector Biol & Control, 2020, 31(1): 36-40
- 10.11853/j.issn.1003.8280.2020.01.008
-
文章历史
- 收稿日期: 2019-08-30
- 网络出版时间: 2019-12-30 09:33
2 山东省新发传染病溯源与防控协同创新中心, 山东 泰安 271016
2 Shandong Collaborative Innovation Center for the Origin and Control of Emerging Infectious Diseases
球孢白僵菌(Beauveria bassiana)是重要的昆虫病原真菌,其寄主非常广泛,可侵染15个目149个科的700多种昆虫,因其具有易于培养,杀虫谱广,致病性强,对温血动物安全等特点,作为微生物农药广泛应用于害虫防治[1-3],并可在家蝇(Musca domestica)成虫之间水平传播引起家蝇感染死亡[4]。球孢白僵菌对不同昆虫的侵染力不同,对同一昆虫不同虫态的侵染性也有区别,如球孢白僵菌仅能感染家蝇等常见蝇类的成虫,对其幼虫及蛹则无感染性[5-6]。已有研究表明,球孢白僵菌对昆虫不同虫态的选择性与昆虫不同虫态抗感染能力强弱或体表结构有关[5-8]。另外,昆虫的抗感染能力还与其体内的肠道细菌有关[9-11]。家蝇幼虫肠道细菌中是否有抑制球孢白僵菌的菌株存在未见相关报道。本实验通过分离家蝇幼虫的肠道细菌,建立快速筛选拮抗球孢白僵菌的肠道细菌方法,从微生态学角度揭示家蝇幼虫抗球孢白僵菌感染的机制。
1 材料与方法 1.1 材料家蝇为山东第一医科大学病媒生物与虫媒病实验室饲养品系,自2005年饲养至今。球孢白僵菌系本实验室菌株,分离自感染的家蝇[4, 12]。
1.2 家蝇幼虫肠道细菌的分离与鉴定 1.2.1 家蝇幼虫肠道细菌的分离取3日龄家蝇幼虫,饥饿4 h后,将收集虫体置于含有75%乙醇溶液的1.5 ml离心管内,浸泡消毒10 min,无菌水漂洗3遍,去除表面黏附的细菌。然后在无菌操作台内进行幼虫解剖,取出肠道,经无菌水漂洗3遍后,在无菌操作台内,以无菌试管和研磨棒进行研磨,取研磨液100 μl划线接种于牛肉膏蛋白胨固体培养基上。将划线后的平板倒置于37 ℃恒温培养箱内培养48 h。挑取单一菌落接种到新的培养基上,不断分离纯化培养直至分离到单一菌种。每次取样均设3次重复。
1.2.2 菌株DNA的提取挑取分离纯化的单菌落于5 ml LB液体培养基中,37 ℃ 110 r/min过夜培养。取液体培养菌液1.5 ml于离心管中,离心半径4 cm,4 500 r/min离心5 min。收集菌体,弃上清。500 μl TE缓冲液重悬菌体,然后加入60 μl 10%十二烷基硫酸钠(SDS)和10 μl 20 mg/ml蛋白酶K,轻轻混匀后37 ℃水浴1 h。再加入100 μl 10 mol/L十六烷基三甲基溴化铵(CTAB)和80 μl 5 mol/L NaCl,轻轻混匀后65 ℃水浴30 min。在此粗提取液中加入750 μl酚、氯仿、异戊醇(体积比为25:24:1),颠倒混匀约10 min,离心半径4 cm,12 000 r/min离心10 min。取上清并加入750 μl氯仿、异戊醇(体积比为24:1),颠倒混匀约10 min,离心半径4 cm,12 000 r/min离心10 min,取上清,重复此步骤2次。在取得的上清液中加入500 μl冷异丙醇,离心半径4 cm,30 min后12 000 r/min离心10 min,弃上清。用1 ml 70%乙醇溶液洗涤沉淀DNA,离心半径4 cm,5 000 r/min离心30 s。最后用40 μl灭菌去离子水溶解DNA,保存于-20 ℃。
1.2.3 细菌的分子鉴定将提取到的菌株DNA,使用27F/1527R细菌通用引物进行PCR扩增。PCR反应体系:引物27F/1527R,各1 μl;dNTP 4 μl;EasyTaq Buffer 5 μl;EasyTaq 0.5 μl;模板DNA 7 μl;补ddH2O至50 μl。PCR反应条件:首先是94 ℃预变性4 min;94 ℃变性1 min,55 ℃退火1 min,72 ℃延伸2 min,共计32个循环;最后72 ℃延伸10 min。扩增产物用1.0%的琼脂糖凝胶电泳检测,有目的条带的PCR产物送北京六合华大基因科技有限公司测序。
将从北京六合华大基因科技有限公司获得的序列在美国国立生物技术信息中心(NCBI)网站的GenBank上进行BLAST分析,确定所培养细菌的种或属。
1.3 仪器及试剂显微镜LEICA DMC 4500、SW- CJ-2D型净化工作台;FA/JA电子天平、HNY- 2102C摇床、高精度数显恒温水浴锅、立式压力蒸汽灭菌器、智能人工气候箱、48孔无菌细胞培养板;琼脂(北京索莱宝公司)、琼脂糖(BIOWEST公司)、葡萄糖(天津市凯通化学试剂有限公司)、牛肉浸膏(天津市英博生化试剂有限公司)等。
1.4 培养基的配制 1.4.1 牛肉膏蛋白胨培养基牛肉膏3 g,蛋白胨10 g,氯化钠5 g,琼脂20 g,加去离子水定容1 000 ml,pH 7.0~7.2装瓶高压灭菌,备用。
1.4.2 LB液体培养基胰蛋白酶1 g,酵母提取物0.5 g,氯化钠1 g,加去离子水定容至100 ml。分装试管每管5 ml,盖紧筛子放入高压灭菌锅灭菌,备用。
1.4.3 马铃薯葡萄糖琼脂培养基(PDA)马铃薯20%,葡萄糖2%,琼脂2%,pH 7.0。先将新鲜无病害的马铃薯洗净,去皮后切成小薄片,称200 g加水1 000 ml,煮沸20 min后过滤,其滤汁为马铃薯煮汁。然后加20 g琼脂和20 g葡萄糖煮溶,以去离子水定容至1 000 ml,装管(瓶)高压灭菌,备用。
1.4.4 孢子萌发培养基1%琼脂糖,1%葡萄糖加去离子水,装管(瓶)高压灭菌,备用。
1.5 供试菌株处理家蝇幼虫肠道细菌接种于LB培养液中,放入智能摇床,37 ℃条件下110 r/min揺菌24 h。取菌液1 ml于离心管内,离心半径4 cm,4 500 r/min离心5 min,分别取200 μl上清液,备用。球孢白僵菌培养接种在PDA平板上。
1.6 孢子悬液配制取PDA平板上的球孢白僵菌,以无菌LB液配成孢子浓度为1.0×108~1.0×109个/ml的悬液,高倍镜下观察孢子萌发率,萌发率<5%可用。取20 μl分别加入上述1.4.1中已制备的200 μl肠道细菌菌液配制孢子菌悬液,对照为200 μl LB液。
1.7 孢子萌发取无菌48孔细胞培养板,将已灭菌孢子萌发培养基加热融化,待温度降至约50 ℃时,加入到细胞培养板各孔中,每孔200 μl。待琼脂凝固后,每孔加入20 μl配置好的孢子菌悬液。每株肠道细菌设3个孔作为重复。后放入28 ℃培养箱中保湿培养。12 h后取出培养板,在显微镜高倍镜下,各孔内随机选择100个左右孢子分别计数萌发和未萌发的孢子数,并计算孢子萌发率。孢子萌发率(%)=萌发的孢子数/(萌发孢子数+未萌发孢子数)×100。孢子萌发的标准是孢子长出芽管,芽管长度大于孢子短半径视为萌发。
1.8 平板对峙将已配好的白僵菌孢子悬液,用无菌棉签均匀地涂布在ϕ 9 cm的PDA平板上。在超净工作台内,于平板上打4个ϕ6 mm的孔。每个孔间距不小于24 mm,孔与平板边缘不小于15 mm。在孔中滴加5 μl已制备好的供试菌液。每株肠道细菌设3个平板作为重复,对照滴加5 μl LB液。放入28 ℃培养箱中保湿培养,3 d后观看结果。
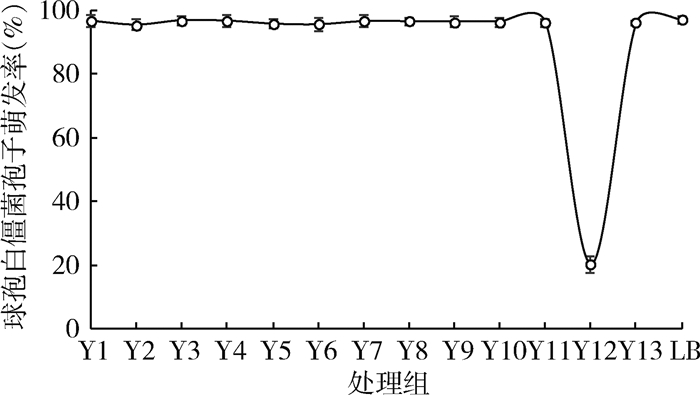
2 结果 2.1 孢子萌发实验显微镜下观察结果如图 1所示,处理后12 h,加入对照液LB的孔内可见孢子正常萌发,出现芽管和菌丝。加入铜绿假单胞菌Y13菌液的孔内,大部分孢子均未萌发,而加入其他家蝇幼虫肠道细菌菌液的孔内均可见孢子萌发,并出现芽管和菌丝,与对照组相同。经计数表明,加入铜绿假单胞菌的孔中球孢白僵菌孢子的平均萌发率为17%,而加入其他肠道细菌及对照孔中孢子的萌发率均在90%以上(图 2)。放置1周后,细胞培养板中加入铜绿假单胞菌的孔中未见菌丝出现,而加入其他肠道细菌及对照组的孔中均出现白色的球孢白僵菌菌丝(图 3B)。

|
| 注:Y1~Y13.分别为加入家蝇肠道中分离到细菌的孔;LB.为对照孔;0 h LB.为刚加入LB时细胞培养板内球孢白僵菌孢子的形态。 图 1 培养12 h后各孔内球孢白僵菌孢子的萌发情况(×400) Figure 1 Spore germination of Beauveria bassiana in each well after being cultured for 12 h (×400) |
| |
|
| 注:Y1~Y13.为家蝇肠道细菌;LB.为对照。 图 2 不同肠道细菌对球孢白僵菌孢子萌发的影响 Figure 2 Effects of different intestinal bacteria on the spore germination of Beauveria bassiana |
| |

|
| 注:Y1~Y13.分别为加入家蝇肠道中分离到细菌的孔;LB.为对照孔。 图 3 细胞培养板内各加样孔加入细菌的示意图(A)和培养1周后细胞培养板各孔内球孢白僵菌生长情况(B) Figure 3 Schematic diagram of adding bacteria to each well of the cell culture plate (A) and growth of Beauveria bassiana in each well of the cell culture plate after being cultured for 1 week (B) |
| |
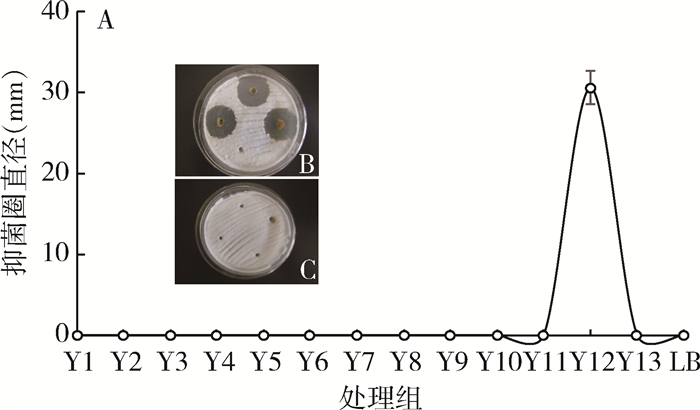
家蝇肠道细菌与球孢白僵菌进行对峙培养时,仅铜绿假单胞菌周围可形成显著的抑菌圈,平均直径约为30 mm,说明其对球孢白僵菌菌丝生长有显著抑制作用(图 4A、B),而家蝇肠道中分离到的其他细菌均未表现出对球孢白僵菌的抑制作用,平板被球孢白僵菌菌丝铺满(图 4C)。
|
| 注:A.不同肠道细菌对球孢白僵菌菌丝的抑制情况;B.铜绿假单胞菌与球孢白僵菌的对峙培养;C.其他肠道细菌与球孢白僵菌的对峙培养。Y1~Y13.为家蝇肠道细菌;LB.为对照。 图 4 家蝇肠道细菌对球孢白僵菌生长的抑制效果 Figure 4 Inhibitory effect of the intestinal bacteria of Musca domestica on the growth of Beauveria bassiana |
| |
昆虫病原真菌孢子能附着寄主体表,萌发、穿透寄主表皮,并耐受昆虫体内的高渗透压,在昆虫体内长出菌丝,产生毒素杀死昆虫。通常测定真菌的生物活性主要采用相对简单快速的孢子萌发法,在操作过程中,萌发介质主要包括水、PDA培养基、琼脂培养基等[13-15]。本文通过孢子萌发法,筛选出家蝇肠道中可抑制球孢白僵菌孢子萌发的细菌,再通过平板对峙法进行验证,结果相一致。因此,孢子萌发法用于筛选真菌抑制剂可大大缩短筛选周期。而已有文献中的孢子萌发法,以水为萌发介质时,主要用凹玻片作为载体;以PDA或琼脂为萌发介质时,主要以培养皿为载体;当进行批量操作时,操作繁琐,且因介质或载体的差异,结果不易标准化。而本研究以琼脂糖和葡萄糖作为孢子萌发介质,以48孔细胞培养板为载体,可实现高通量、标准化操作,实验结果可靠性更高。琼脂糖和葡萄糖作为孢子萌发的培养基不仅为孢子提供足够的营养,也使得孢子在萌发过程中不易出现因水分蒸发过快而影响孢子萌发。然而,采用48孔细胞培养板琼脂糖法筛选抑制真菌生长的细菌,也存在一定的局限性,细胞培养板的底面积小且细菌繁殖快消耗分解琼脂糖,显微镜下观察视野浑浊,出现大量的细菌,以及颗粒状物质易干扰对孢子萌发的判断,需要仔细分辨。
已有研究表明,德国小蠊肠道细菌对白色念珠菌(Candida albicans)、深红酵母(Rhodotorula rubra)、茄丝核菌(Rhixoctonia solani)、黄萎轮枝孢菌(Verticillium alboatrum)、腐皮镰刀菌(Fusarium solani)、黄曲霉(Aspergillus flavus)和黑曲霉(A. niger)的生长均有明显的抑制作用,但并未明确肠道细菌的种类[9];另有研究表明,德国小蠊(Blattella germanica)肠道中的芽孢杆菌和假单胞菌(P. reactans)对球孢白僵菌、黄绿绿僵菌和黄曲霉等真菌均有显著抑制作用[11-12]。说明昆虫肠道细菌中存在抑制自然界中真菌的菌株,以保持其在复杂环境中健康生长。
本研究通过孢子萌发实验和平板对峙实验,在家蝇幼虫肠道细菌中筛选出可抑制球孢白僵菌孢子萌发和菌丝生长的铜绿假单胞菌。铜绿假单胞菌是动物和人类的条件性致病菌,可引起肺部及尿道感染,或造成烧伤、伤口等感染,是临床上三大条件性致病细菌之一[16]。但植物根际来源的铜绿假单胞菌可分泌多种拮抗植物病原菌的代谢产物,用于防治植物真菌或细菌类病害,称之为铜绿假单胞菌生防菌株。其抑制植物病原真菌的机制主要通过分泌嗜铁素类、吩嗪类、藤黄绿脓菌素(Pyoluteorin,Plt)、L-2-氨基-4-甲氧基-反式-3-丁烯酸(L-2-amino- 4-methoxy-trans-3-butenoic acid,AMB)、3,4-二羟基-N-甲基-4-苯并二氢吡喃酮-丁酰胺、鼠李糖脂(Rhamnolipid)和胞外多糖类等来抑制植物病原真菌[17]。但家蝇幼虫体内铜绿假单胞菌拮抗球孢白僵菌感染的分子和化学机制有待进一步研究。
家蝇幼虫本身可产生抗真菌肽[18],从而抵抗外界病原真菌如球孢白僵菌的感染,其对真菌感染的防御主要发生在真菌入侵后,属被动防御;而家蝇肠道中的铜绿假单胞菌,可通过排泄、反吐等途径释放到家蝇幼虫孳生环境中,从而抑制球孢白僵菌等昆虫病原真菌的萌发,对病原真菌产生主动防御。因此,家蝇幼虫肠道中的铜绿假单胞菌释放到孳生环境后,对球孢白僵菌产生的主动防御,可能是家蝇幼虫抗球孢白僵菌感染的重要原因之一。
| [1] |
Bextine BR, Thorvilson HG. Field applications of bait-formulated Beauveria bassiana alginate pellets for biological control of the red imported fire ant (Hymenoptera:Formicidae)[J]. Environ Entomol, 2002, 31(4): 746-752. DOI:10.1603/0046-225X-31.4.746 |
| [2] |
张璐璐, 吴圣勇, 王帅宇, 等. 防治蓟马的球孢白僵菌SDDZ-9菌株液体发酵工艺优化[J]. 中国农业科学, 2015, 48(15): 2985-2994. Zhang LL, Wu SY, Wang SY, et al. Optimization of fermentation process of Beauveria bassiana of SDDZ-9 against Frankliniella occidenta[J]. Sci Agric Sin, 2015, 48(15): 2985-2994. DOI:10.3864/j.issn.0578-1752.2015.15.008 |
| [3] |
Ishii M, Kanuka H, Badolo A, et al. Proboscis infection route of Beauveria bassiana triggers early death of Anopheles mosquito[J]. Sci Rep, 2017, 7(1): 3476. DOI:10.1038/s41598-017-03720-x |
| [4] |
庄桂芬, 黄振东, 薛志静, 等. 球孢白僵菌CF08株在家蝇成虫间的水平传播实验[J]. 中国媒介生物学及控制杂志, 2017, 28(2): 131-134. Zhuang GF, Huang ZD, Xue ZJ, et al. Horizontal transmission of Beauveria bassiana CF08 strain (Hypocreales:Cordycipitaceae) in Musca domestica (Diptera:Muscidae) adults[J]. Chin J Vector Biol Control, 2017, 28(2): 131-134. DOI:10.11853/j.issn.1003.8280.2017.02.008 |
| [5] |
谭清, 庞仁乙, 高熹, 等. 蜡蚧轮枝菌分生孢子在不同虫态棕尾别麻蝇体表的附着能力及与寄主体表结构的关系[J]. 昆虫学报, 2014, 57(10): 1245-1252. Tan Q, Pang RY, Gao X, et al. Adhesion capacity of Lecanicillium lecanii conidia on body surface of Boettcherisca peregrina (Diptera:Sarcophagidae) at different developmental stages and its relationship with surface structures of host body[J]. Acta Entomol Sin, 2014, 57(10): 1245-1252. |
| [6] |
谭清, 高熹, 庞仁乙, 等. 家蝇不同虫态附着蜡蚧轮枝菌分生孢子能力及与其体表结构的关系[J]. 南方农业学报, 2015, 46(2): 241-249. Tan Q, Gao X, Pang RY, et al. Adhesion capacities of Lecanicillium lecanii conidia on different insect states of Musca domestica and the relationship with their surface structures[J]. J Southern Agric, 2015, 46(2): 241-249. DOI:10.3969/jissn.2095-1191.2015.2.241 |
| [7] |
Lu DD, Geng T, Hou CX, et al. Bombyx mori cecropin A has a high antifungal activity to entomopathogenic fungus Beauveria bassiana[J]. Gene, 2016, 583(1): 29-35. DOI:10.1016/j.gene.2016.02.045 |
| [8] |
张慧, 吴圣勇, 王帅宇, 等. 葱蝇成虫防御类酶和血细胞对球孢白僵菌的防御作用[J]. 中国生物防治学报, 2017, 33(2): 198-205. Zhang H, Wu SY, Wang SY, et al. Effect of Beauveria bassiana on the activity of defense enzymes and cellular defense response of adult of Delia antiqua (Meigen)[J]. Chin J Biol Control, 2017, 33(2): 198-205. DOI:10.16409/j.cnki.2095-039x.2017.02.009 |
| [9] |
汤历, 廉婕, 陆小军, 等. 德国小蠊肠道细菌抗真菌的初步研究[J]. 昆虫天敌, 2005, 27(3): 140-144. Tang L, Lian J, Lu XJ, et al. Antifungal activity of intestinal bacteria of Blattella germanica[J]. Nat Enemies Insects, 2005, 27(3): 140-144. DOI:10.3969/j.issn.1674-0858.2005.03.007 |
| [10] |
黄艳红, 张凡, 付荣恕, 等. 德国小蠊肠道菌群分离及抗真菌活性分析[J]. 中国公共卫生, 2011, 27(1): 78-79. Huang YH, Zhang F, Fu RS, et al. Isolation of gut Microbiotas of Blattella germanica and analysis of antifungal activity[J]. Chin J Public Health, 2011, 27(1): 78-79. DOI:10.11847/zgggws2011-27-01-37 |
| [11] |
Zhang F, Huang YH, Liu SZ, et al. Pseudomonas reactans, a bacterial strain isolated from the intestinal flora of Blattella germanica with anti-Beauveria bassiana activity[J]. Environ Entomol, 2013, 42(3): 453-459. DOI:10.1603/EN12347 |
| [12] |
黄振东, 万晴, 庄桂芬, 等. 球孢白僵菌CF08株对丽蝇蛹集金小蜂的安全性评价[J]. 中国媒介生物学及控制杂志, 2018, 29(3): 250-253. Huang ZD, Wan Q, Zhuang GF, et al. Safety evaluation of Beauveria bassiana CF08 strain on Nasonia vitripennis[J]. Chin J Vector Biol Control, 2018, 29(3): 250-253. DOI:10.11853/j.issn.1003.8280.2018.03.008 |
| [13] |
Wang CS, Duan ZB, St.Leger RJ. MOS1 osmosensor of Metarhizium anisopliae is required for adaptation to insect host hemolymph[J]. Eukaryot Cell, 2008, 7(2): 302-309. DOI:10.1128/EC.00310-07 |
| [14] |
魏蕾. 采用孢子萌发法检测蔬菜灰霉病菌的抗药性[J]. 北京农业科学, 2000, 18(5): 19-21. Wei L. The resistance of Botrytis cinerea of vegetables was used for detections by spore germination[J]. Beijing Agric Sci, 2000, 18(5): 19-21. |
| [15] |
杨小军, 倪汉文, 杨立军, 等. 采用孢子萌发法测定化合物对黄瓜白粉病菌的生物活性[J]. 植物保护, 2007, 33(1): 75-77. Yang XJ, Ni HW, Yang LJ, et al. A novel bioassay method-determining the bioactivity of chemical compounds to cucumber powdery mildew by spore germination[J]. Plant Prot, 2007, 33(1): 75-77. DOI:10.3969/j.issn.0529-1542.2007.01.022 |
| [16] |
Kostylev M, Kim DY, Smalley NE, et al. Evolution of the Pseudomonas aeruginosa quorum-sensing hierarchy[J]. Proc Natl Acad Sci USA, 2019, 116(14): 7027-7032. DOI:10.1073/pnas.1819796116 |
| [17] |
李苓苓.铜绿假单胞菌中影响吩嗪合成基因操纵子phzA1的调节基因的研究[D].西安: 西北大学, 2005. Li LL. The expression and regulation of phzAl operon in P. aeruginosa[D]. Xi'an: Northwestern University, 2005. http://cdmd.cnki.com.cn/Article/CDMD-10697-2008076164.htm |
| [18] |
陈明明.家蝇抗真菌肽MAF-1A的分子改良及抗白色念珠菌活性的研究[D].贵阳: 贵州医科大学, 2016. Chen MM. Study on the molecular modification and anti-Canidia albicans activity of Musca domestica antifungal peptide-1A (MAF-1A)[D]. Guiyang: Guizhou Medical University, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10660-1016242462.htm |
 2020, Vol. 31
2020, Vol. 31


