扩展功能
文章信息
- 刘起勇
- LIU Qi-yong
- 我国登革热流行新趋势、防控挑战及策略分析
- Dengue fever in China: new epidemical trend, challenges and strategies for prevention and control
- 中国媒介生物学及控制杂志, 2020, 31(1): 1-6
- Chin J Vector Biol & Control, 2020, 31(1): 1-6
- 10.11853/j.issn.1003.8280.2020.01.001
-
文章历史
- 收稿日期: 2019-12-30
- 网络出版时间: 2020-01-15 17:19
登革热是一种由4型登革病毒引起,经媒介伊蚊叮咬传播的重要蚊媒传染病[1]。2019年,中国大陆登革热报告病例数和报告地区数明显升高,对人群健康造成严重威胁。气候变化、生态环境变化、全球化、城市化等因素,均会对该病的发生及流行产生重要影响[2]。本文基于我国登革热疫情数据,结合最新国内外相关研究成果,对当前登革热流行情况、未来登革热发生风险以及防控挑战及策略进行论述,为我国登革热的科学及精准防控提供理论依据。
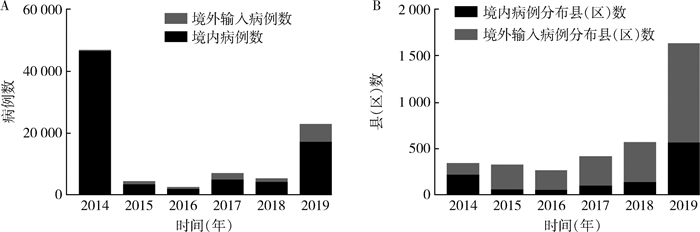
1 登革热疫情概况2019年中国大陆登革热疫情形势较往年(2015-2018年)更加严峻,中国大陆28个省(自治区、直辖市)报告登革热病例共22 599例,发病率为1.63/10万,报告病例数仅次于2014年的登革热大暴发,显著高于2018年(5 136例)。其中13个省(自治区、直辖市)发生了登革热本地病例,境内感染病例16 794例(占病例总数的74.31%),境外输入病例5 805例(占25.69%)(图 1A);临床诊断病例10 170例(45.00%),确诊病例12 429例(55.00%);死亡病例3例,病死率为0.01%。
|
| 注:A.登革热报告病例数;B.登革热报告县(区)数。 图 1 2014-2019年中国大陆登革热报告病例数及报告县(区)数 Figure 1 The numbers of reported cases and counties (districts) of dengue fever in mainland China from 2014 to 2019 |
| |
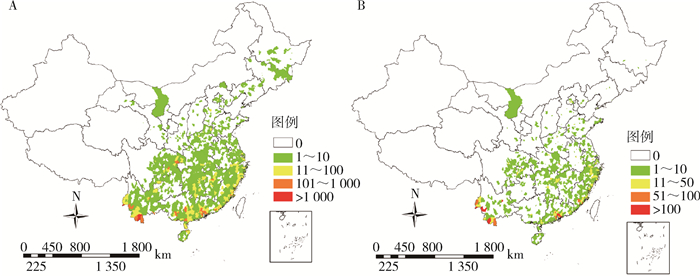
2019年全国登革热病例分布范围显著增加,共有550个县(区)报告境内感染病例,其中290个县(区)发生本地病例,而1 066个县(区)报告境外输入病例,两者均为历年最高(图 1B)。登革热报告病例分布地区主要集中在云南省(6 849例)、广东省(6 101例)、广西壮族自治区(1 747例)、福建省(1 632例)、重庆市(1 411例)和江西省(1 279例),共报告19 019例,占病例总数的84.16%(图 2A)。境外输入的5 805例病例中,其中亚洲5 721例,非洲50例,南美洲和大洋洲各9例,北美洲7例和输入地不详9例,输入国家主要包括柬埔寨3 244例(55.88%),缅甸1 092例(18.81%);境外输入病例主要分布于我国云南、广西及广东省(自治区),共占46.16%(图 2B)。
|
| 注:A.登革热报告病例分布;B.境外输入登革热病例分布。 图 2 2019年中国大陆登革热报告病例地区分布 Figure 2 The spatial distribution of reported cases of dengue fever in mainland China, 2019 |
| |
登革热的发生和流行受众多因素影响,如媒介伊蚊密度、气象因素、全球化、城市化、人口密度、人均国内生产总值(GDP)、交通可及性和植被覆盖指数等[3-7]。世界卫生组织(WHO)认为,气候变化是全球登革热扩散的主要原因[6]。政府间气候变化专门委员会第5次评估报告(IPCC AR5)指出,登革热和气候变量在全球和区域尺度上均存在密切相关(高置信度)[8]。
2.1 气候变化对我国登革热发病风险的影响 2.1.1 气候变化对我国媒介伊蚊分布区的影响近年来,登革热在我国广东、云南、福建、浙江、广西、河南和山东等省(自治区)出现多点暴发,构成了严重的公共卫生问题[9-11]。我国登革热媒介伊蚊监测网络发现,白纹伊蚊(Aedes albopictus)广泛分布于我国北至沈阳、大连市,经天水、陇南市,至西藏自治区墨脱县一线及其东南侧大部分地区;埃及伊蚊(Ae. aegypti)主要分布于我国大陆海南省沿海市、县及火山岩地区,广东省雷州半岛的乌石和企水镇,云南省西双版纳傣族自治州、德宏傣族景颇族自治州(德宏州)和临沧市,以及台湾省嘉义市以南及澎湖列岛部分地区。气候变化等因素可对我国媒介伊蚊分布区产生一定程度的影响,以埃及伊蚊为例,近年来我国云南省的埃及伊蚊分布区呈快速扩大趋势:2002年仅发现于瑞丽市,2008年分布区为瑞丽市、芒市和勐腊县,2014年分布区为瑞丽、芒市、盈江、陇川、耿马、勐海、景洪和勐腊县(市),2019年最新分布区达到10个县(市),包括确定存在分布的瑞丽、芒市、盈江、陇川、耿马、勐海、勐腊、景洪、沧源和镇康县(市),及曾发现埃及伊蚊分布的澜沧和临翔县。但广东和海南省的埃及伊蚊分布区有所缩减。
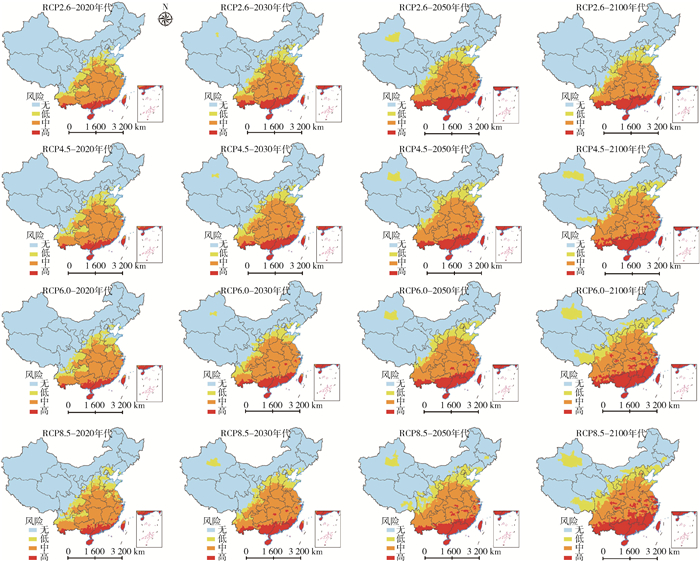
未来不同气候变化情景下,我国登革热媒介伊蚊分布区将进一步扩大。基于1981年1月至2010年12月的气象数据,利用CLIMEX模型预估不同典型浓度路径(RCP)情景(RCP2.6、RCP4.5、RCP6和RCP8.5)下我国白纹伊蚊适生区,发现当前白纹伊蚊高度适生区集中于海南、台湾、广东、广西、云南和福建等省(自治区)的269个县(区)(6 085.8 km2)。未来气候变化将导致我国媒介伊蚊适生区分布范围明显向高纬度地区扩展。RCP2.6情景(最低增温)下,白纹伊蚊高度适生区随年代推移逐渐向高纬度扩大。RCP2.6情景(最低增温)下,白纹伊蚊高度适生区随年代推移逐渐向高纬度扩大,到2050年达400个县(区)(9 319.2 km2),到2100年高度适生区达到227县(区)(5 081.9 km2),小于当前气候变化情景下白纹伊蚊高度适生区面积。RCP8.5情景下(最高增温),白纹伊蚊分布范围将更大,高度适生区分布范围在2020年增加58个县(区)(1 932.4 km?),2030年增加69个县(区)(2 146.1 km2),2050年增加333个县(区)(13 074.5 km2),2100年增加580个县(区)(20 448.8 km2)[12-15]。
2.1.2 气候变化对我国登革热发病风险影响气候因素可驱动登革热发生,其对登革热的影响存在滞后效应[16-18]。未来气候变化将会使得更多的地区适合登革热传播和流行。以气温为例,基于登革热流行的生物驱动模型绘制的当前(1981-2010年)及未来不同年代我国登革热风险地图显示,所有RCP情景下我国登革热的流行风险区均显著北扩,风险人口显著增加。当前我国142个县(区)的1.68亿人口处于登革热的高风险区,RCP2.6情景下,2020年代登革热发病县(区)数将从146个增至344个,风险人群将从1.72亿增至2.78亿人;而2030年代风险区域仍将继续扩大。RCP8.5情景下,登革热高风险范围将进一步扩大(图 3)[19-20]。此外,适宜降水量将通过增加媒介伊蚊孳生繁殖。有研究预估[21],到2050年全球约24亿人生活在适宜媒介白纹伊蚊孳生繁殖地区,登革热的传播风险将进一步增加。
全球化是当今时代的基本特征。随着全球化进程的不断推进,全球范围内人流、物流更加频繁,交通工具更为便捷,在一定程度上有利于媒介伊蚊和登革病毒的不断扩散和传播。埃及伊蚊起源于非洲,白纹伊蚊起源于亚洲,随着交通工具及轮胎贸易,随后数十年迅速向世界各地扩散。旅游和商贸的发展,增加了全球范围内登革热传染源的跨境乃至跨洲流动。欧洲疾病预防控制中心发现[22],欧洲登革热报告数增多与登革热高流行区人员入境数量增多有关。随着“一带一路”战略的实施,作为“一带一路”沿线国家和地区的重要传染病,登革热输入引起本地传播及二代病例发生不断增多,对我国生物安全、公共安全和人群生命安全构成严重威胁。
2.3 城市化对登革热的影响随着城市化进程不断推进,大量人口涌入城市,造成城市局部地区的人口密度增高、住房拥挤,更易受到媒介伊蚊叮咬,显著增加登革热传播风险。城市化进程中部分居民区配套设施跟不上,导致卫生条件差,水源管理不当,垃圾处理和蚊虫控制不及时等,均易造成媒介伊蚊的孳生。城市化进程中个人及家庭生活习惯和环境也发生一定程度的改变,特别是居民户内外种植水培植物的增多,为登革热的传播提供了有利条件。此外,城市化还引起了土地利用方式的改变,耕地、山地、住宅和林地等均可发生用途改变,进而影响媒介伊蚊的孳生繁殖,最终影响登革热的传播风险,如马来西亚Akter等[23]研究发现,随着城市化进程推进,居民区登革热显著高于商业区和工业区。
3 我国登革热预防控制策略和措施 3.1 登革热预防控制策略登革热是我国重要的公共卫生问题之一,当前我国登革热的预防控制策略为政府主导、多部门合作、联防联控、属地管理和全社会参与。开展健康教育,以强化监测预警为重点,开展实施媒介伊蚊可持续控制,严防输入病例引起的本地传播暴发,提高诊治水平,加强病例管理,减少发病和死亡。
3.2 登革热预防控制措施 3.2.1 建立多部门合作机制各级政府负责登革热防控的领导,街道办事处和乡镇政府主要负责组织和执行,居委会和村委会广泛发动群众参与防蚊、灭蚊。该项工作涉及到的主要部门有卫生健康、爱国卫生、检验检疫、宣传、住建、教育、旅游、交通、商务、工商、公安、财政、监察等,均应纳入登革热疫情防控多部门合作机制,协助各级政府开展工作。此外,各地应根据当地实际情况,推进相关部门积极合作,以保障该项工作的顺利推进。如云南省边界登革热的防控还涉及边防部队和旅游管理部门等。
3.2.2 严防登革热病例输入引起的本地传播我国登革热疫情是由输入病例引起本地病例的暴发及流行。因此,当前应密切关注国际登革热疫情变化,开展动态风险评估,及时发布旅行健康提示。检验检疫部门应做好入境人员检疫监测、排查,一旦发现发热等可疑症状,应将具体信息告知卫生健康部门,做好疑似病例及密切接触者的后续跟踪处置,严防登革热病例输入。
3.2.3 开展媒介伊蚊可持续控制我国登革热媒介伊蚊防控需做好日常及应急情景下的媒介伊蚊监测和控制。各级政府领导并组织开展日常媒介伊蚊监测,发现布雷图指数(BI)或诱蚊诱卵指数(MOI)>20或10时,当地政府组织开展爱国卫生运动,清除室内外各种孳生地,开展预防性灭蚊,降低或消除登革热暴发风险。登革热媒介伊蚊活动季节发现输入或本地病例,立即启动应急监测。当登革热病例出现,以疫点为圆心200 m半径范围内BI或MOI>5、警戒区(核心区外展200 m半径范围)>10时,或BI或MOI>20时,启动媒介伊蚊应急控制。选取敏感卫生杀虫剂开展精确的疫点成蚊杀灭;广泛动员群众,开展爱国卫生运动,清理蚊虫孳生地;教育居民做好个人防护。通过综合性的媒介伊蚊控制措施,尽快将BI或MOI控制在5以下[24-25]。
3.2.4 加强登革热疫情处置能力建设并及时作出应急响应各级疾病控制机构应加强登革热流行病学调查、疫点处置、媒介监测和控制及实验室检测等能力建设,确保登革热疫情处置能力提升,一旦发生登革热聚集性病例,各地政府应按照突发公共卫生事件应急响应机制,成立登革热处置工作指挥部,迅速启动相应级别的应急响应。
3.2.5 开展登革热防控知识宣传教育宣传部门应在卫生健康部门的支持下,采用电视、广播、报纸、宣传画等,及新媒体如微信公众号等形式,开展登革热防控健康教育。各地政府应及时发布登革热疫情进展,宣传部门应做好登革热舆情跟踪与引导、疫情报道、风险沟通和群众动员等,避免引起居民恐慌情绪。赴登革热流行国家或地区旅行、生活时,应严格做好个人防护措施,防止蚊虫叮咬;若怀疑感染登革热时,应及时就医,主动报告旅行史,并接受医学随访。
4 登革热防控面临的新挑战及应对 4.1 登革热防控面临的新挑战 4.1.1 本地疫情分布范围点多面广,防控难度增大受全球特别是东南亚各国登革热疫情影响,自2013年云南省景洪市暴发登革热以来,近年来发生登革热本地病例省份不断增多,2019年已在13个省(自治区、直辖市)发生了登革热本地病例,点多面广,达到了新中国成立以来登革热本地病例发生省份数最高水平,今后一段时期内的登革热防控形势愈加严峻。
4.1.2 境外输入登革热病例不断增加,发现难度增大随着全球化及“一带一路”倡议的不断推进,我国赴境外旅游和务工的人数逐年增加,回国输入性病例增加;“一带一路”沿线国家和地区登革热不断输入我国,输入地点从之前的跨境省份为主转变为向内地扩展,输入越来越频繁,造成的损失和影响越来越大;加之登革热隐性感染和轻型病例多,发现难度大,以及传播季节媒介伊蚊的密度高,极易引起本地传播和暴发。
4.1.3 气候和生态环境变化对登革热的影响气候变化是全球登革热增加的一个主要促成因素。气候变暖将导致我国登革热媒介白纹伊蚊和埃及伊蚊的分布范围不断向西、向北扩展,未来登革热风险范围和风险人口将不断增加。随着城镇化进程增加,局部生态环境会发生一定程度的变化,城镇中适宜登革热媒介伊蚊的孳生地可能会增多,给未来登革热防控增加了难度。
4.2 我国登革热防控应对 4.2.1 加强我国登革热防控策略措施的落实我国已经发布了针对登革热防控的策略和措施。然而,各地在落实相关防控策略和措施方面程度不一,有些地区由于种种原因落实不到位,防控效果大打折扣。未来,各地务必要保质保量地落实我国制定的各种登革热防控策略和技术方案。在此基础上,各地可发挥主观能动性,开展一些适合当地的登革热防控措施,确保疫情有效防控。
4.2.2 开展登革热防控的探索性研究,增加登革热研究的国家和部门立项登革热的防控中尚存在一些技术瓶颈或是难点需要进一步的探索性研究。如我国各地登革热传播、暴发及流行的媒介伊蚊幼蚊及成蚊阈值各是多少,不同的地理、生态及气候区域可能存在差异。适合我国国情的媒介伊蚊成蚊监测工具,有无精准的登革热预测模型对当前我国的登革热防控予以提前预警并进行防控,登革热给我国造成的疾病负担究竟多大,上述问题均难以回答。建议增加登革热基础研究和应用研究的国家及部门立项,优先解决登革热科学防控中亟待解决的“卡脖子”技术问题。
4.2.3 推进登革热预防控制全球策略的更新及实施为实现全球登革热疾病负担降低的总目标,WHO曾发布了“Global strategy for dengue prevention and control 2012-2020”,以2010年为基线,提出了至2020年至少减少25.0%登革热发病和50.0%登革热死亡率的具体目标。然而2020年已经来临,登革热防控形势依然异常严峻,亟待推进新的针对登革热预防控制策略的及早发布,以指导未来10年的登革热控制工作。
| [1] |
Bai L, Morton LC, Liu QY. Climate change and mosquito-borne diseases in China:a review[J]. Global Health, 2013, 9(1): 10. DOI:10.1186/1744-8603-9-10 |
| [2] |
刘起勇. 新时代媒介生物传染病形势及防控对策[J]. 中国媒介生物学及控制杂志, 2019, 30(1): 1-6, 11. Liu QY. Epidemic profile of vector-borne diseases and vector control strategies in the new era[J]. Chin J Vector Biol Control, 2019, 30(1): 1-6, 11. DOI:10.11853/j.issn.1003.8280.2019.01.001 |
| [3] |
Qi XP, Wang Y, Li Y, et al. The Effects of socioeconomic and environmental factors on the incidence of dengue fever in the Pearl River Delta, China, 2013[J]. PLoS Negl Trop Dis, 2015, 9(10). DOI:10.1371/journal.pntd.0004159 |
| [4] |
Morin CW, Comrie AC, Ernst K. Climate and dengue transmission:evidence and implications[J]. Environ Health Perspect, 2013, 121(11/12): 1264-1272. DOI:10.1289/ehp.1306556 |
| [5] |
Li QX, Ren HY, Zheng L, et al. Ecological niche modeling identifies fine-scale areas at high risk of dengue fever in the Pearl River Delta, China[J]. Int J Environ Res Public Health, 2017, 14(6): 619. DOI:10.3390/ijerph14060619 |
| [6] |
Benitez MA. Climate change could affect mosquito-borne diseases in Asia[J]. Lancet, 2009, 373(9669): 1070. DOI:10.1016/S0140-6736(09)60634-6 |
| [7] |
Liu KK, Hou X, Wang YG, et al. The driver of dengue fever incidence in two high-risk areas of china:a comparative study[J]. Sci Rep, 2019, 9(1): 19510. DOI:10.1038/s41598-019-56112-8 |
| [8] |
Huang F, Takala-Harrison S, Liu H, et al. Prevalence of clinical and subclinical Plasmodium falciparum and Plasmodium vivax malaria in two remote rural communities on the Myanmar-China Border[J]. Am J Trop Med Hyg, 2017, 97(5): 1524-1531. DOI:10.4269/ajtmh.17-0167 |
| [9] |
Chen B, Liu QY. Dengue fever in China[J]. Lancet, 2015, 385(9978): 1621-1622. DOI:10.1016/S0140-6736(15)60793-0 |
| [10] |
Lai SJ, Huang ZJ, Zhou H, et al. The changing epidemiology of dengue in China, 1990-2014:a descriptive analysis of 25 years of nationwide surveillance data[J]. BMC Med, 2015, 13: 100. DOI:10.1186/s12916-015-0336-1 |
| [11] |
Li CL, Lu YM, Liu YN, et al. Climate change and dengue fever transmission in China:evidences and challenges[J]. Sci Total Environ, 2018, 622-623: 493-501. DOI:10.1016/j.scitotenv.2017.11.326 |
| [12] |
中国国家气候变化专家委员会, 英国气候变化委员会. 中-英合作气候变化风险评估[M]. 北京: 中国环境出版社, 2019: 93-95. China National Expert Committee on Climate Change, UK Committee on Climate Change. UK-China cooperation on climate change risk assessment:developing indicators of climate risk[M]. Beijing: China Environment Press, 2019: 93-95. |
| [13] |
Liu P, Lu L, Jiang J, et al. The expanding pattern of Aedes aegypti in southern Yunnan, China:insights from microsatellite and mitochondrial DNA markers[J]. Parasit Vectors, 2019, 12(1): 56. DOI:10.1186/s13071-019-3818-8 |
| [14] |
Kraemer MUG, Reiner RC Jr, Brady OJ, et al. Past and future spread of the arbovirus vectors Aedes aegypti and Aedes albopictus[J]. Nat Microbiol, 2019, 4(5): 854-863. DOI:10.1038/s41564-019-0376-y |
| [15] |
Kraemer MUG, Reiner RC Jr, Brady OJ, et al. Publisher Correction:past and future spread of the arbovirus vectors Aedes aegypti and Aedes albopictus[J]. Nat Microbiol, 2019, 4(5): 900. DOI:10.1038/s41564-019-0429-2 |
| [16] |
Xu L, Stige LC, Chan KS, et al. Climate variation drives dengue dynamics[J]. Proc Natl Acad Sci USA, 2017, 114(1): 113-118. DOI:10.1073/pnas.1618558114 |
| [17] |
Yi LP, Xu X, Ge WX, et al. The impact of climate variability on infectious disease transmission in China:current knowledge and further directions[J]. Environ Res, 2019, 173: 255-261. DOI:10.1016/j.envres.2019.03.043 |
| [18] |
Li RY, Xu L, Bjørnstad ON, et al. Climate-driven variation in mosquito density predicts the spatiotemporal dynamics of dengue[J]. Proc Natl Acad Sci USA, 2019, 116(9): 3624-3629. DOI:10.1073/pnas.1806094116 |
| [19] |
刘小波, 吴海霞, 鲁亮. 对话刘起勇:媒介伊蚊可持续控制是预防寨卡病毒病的杀手锏[J]. 科学通报, 2016, 61(21): 2323-2325. Liu XB, Wu HX, Lu L. Dialogue Liu Qiyong:sustainable control of the vector Aedes aegypti is the key to prevente Zika virus disease[J]. Sci China Press, 2016, 61(21): 2323-2325. DOI:10.1360/N972016-00734 |
| [20] |
Fan JC, Liu QY. Potential impacts of climate change on dengue fever distribution using RCP scenarios in China[J]. Adv Climate Change Res, 2019, 10(1): 1-8. DOI:10.1016/j.accre.2019.03.006 |
| [21] |
Proestos Y, Christophides GK, Ergüler K, et al. Present and future projections of habitat suitability of the Asian tiger mosquito, a vector of viral pathogens, from global climate simulation[J]. Philos Trans Roy Soc B:Biol Sci, 2015, 370(1665): 20130554. DOI:10.1098/rstb.2013.0554 |
| [22] |
Semenza JC, Sudre B, Miniota J, et al. International dispersal of dengue through air travel:importation risk for Europe[J]. PLoS Negl Trop Dis, 2014, 8(12): e3278. DOI:10.1371/journal.pntd.0003278 |
| [23] |
Akter R, Hu WB, Naish S, et al. Joint effects of climate variability and socioecological factors on dengue transmission:epidemiological evidence[J]. Trop Med Int Health, 2017, 22(6): 656-669. DOI:10.1111/tmi.12868 |
| [24] |
刘起勇. 媒介伊蚊可持续控制策略及关键技术[J]. 新发传染病电子杂志, 2018, 3(2): 75-79. Liu QY. Sustainable control strategies and key technologies of Aedes albopictus[J]. Electron J Emerg Infect Dis, 2018, 3(2): 75-79. DOI:10.3877/j.issn.2096-2738.2018.02.005 |
| [25] |
刘起勇. 媒介生物可持续控制策略和实践:新中国70年媒介生物传染病控制成就[J]. 中国媒介生物学及控制杂志, 2019, 30(4): 361-366. Liu QY. Sustainable vector management strategy and practice:achievements in vector-borne diseases control in new China in the past seventy years[J]. Chin J Vector Biol Control, 2019, 30(4): 361-366. DOI:10.11853/j.issn.1003.8280.2019.04.001 |
 2020, Vol. 31
2020, Vol. 31