扩展功能
文章信息
- 姚丹丹, 姜洪雪, 刘福佳, 冯志勇
- YAO Dan-dan, JIANG Hong-xue, LIU Fu-jia, FENG Zhi-yong
- 广东省江门市黄毛鼠对第一代抗凝血杀鼠剂的抗药性及其与VKORC1基因的相关性研究
- A study of the resistance of Rattus losea to the first-generation anticoagulant rodenticide and its correlation with the VKORC1 gene
- 中国媒介生物学及控制杂志, 2019, 30(6): 613-617
- Chin J Vector Biol & Control, 2019, 30(6): 613-617
- 10.11853/j.issn.1003.8280.2019.06.004
-
文章历史
- 收稿日期: 2019-06-25
- 网络出版时间: 2019-10-15 09:49
抗凝血杀鼠剂是国内外鼠害防治中广泛使用的化学杀鼠剂,它通过与维生素K环氧化物还原酶(vitamin K epoxide reductase,VKOR)结合,阻止还原型维生素K的生成,导致凝血功能障碍,同时损害毛细血管,使管壁通透性增加,最终造成害鼠出血而死亡[1]。随着抗凝血杀鼠剂的大规模推广使用,世界上许多国家和地区相继发现鼠类对第一代甚至第二代抗凝血杀鼠剂产生了抗药性[2-4],而在我国很多地区,也出现了鼠类对抗凝血杀鼠剂的抗性个体和抗性种群[5-7]。黄毛鼠(Rattus losea)是华南地区农田的优势鼠种及主要害鼠,在广东省农田中该鼠的数量占比高达50%~80%,严重危害粮食作物、油料作物和瓜果类蔬菜的安全生产,造成农作物减产10%~30%。为确保农业的可持续发展,生产部门通常采用化学灭鼠的方法来控制该鼠的种群密度,抗凝血杀鼠剂的应用时间长、使用频率及用量大,导致黄毛鼠对第一代抗凝血杀鼠剂产生了耐药性或抗药性现象,抗性率最高可达36.67%[8],严重影响了防治效果。
研究表明,鼠类可以通过多种分子途径产生抗药性,维生素K环氧化物还原酶复合物亚单位1(vitamin K epoxide reductase complex,subunit 1,VKORC1)基因上的氨基酸突变是鼠类产生抗性的主要方式[9]。目前对于害鼠VKORC1基因的研究主要集中在褐家鼠(R. norvegicus)、小家鼠(Mus musculus)和屋顶鼠(R. rattus)中[10-12],黄毛鼠、黄胸鼠(R. tanezumi)和高原鼢鼠(Eospalax baileyi)中亦有少量报道[13-15]。Wang等[13]从VKORC1 mRNA的角度研究了抗性和敏感黄毛鼠VKORC1基因表达量的差异和氨基酸突变位点,而本研究从DNA角度对黄毛鼠VKORC1基因全序列进行克隆测序,筛选VKORC1基因突变位点,并结合抗性生物测定结果,分析VKORC1基因突变位点与抗性的相关性,以期进一步阐明黄毛鼠抗性的遗传机制,为科学防控鼠害提供依据。
1 材料与方法 1.1 试鼠来源黄毛鼠于2017年12月捕自广东省江门市新会区野外农田,带回室内单笼饲养适应1周以上,选择健康、未孕、亚成年以上的试鼠供试。
1.2 试剂杀鼠灵标准品购自美国Sigma公司,DNA提取试剂盒、Premix Taq、DNA凝胶回收试剂盒、DNA Marker、上样缓冲液和Gold View核酸染料购自TaKaRa公司,其他试剂均为国产分析纯。
1.3 方法 1.3.1 黄毛鼠对第一代抗凝血杀鼠剂的抗性检测每只试鼠称重、鉴定性别、编号,采用致死期食毒法(LFP法)[8]进行抗性生物测定,生物测定所用毒饵采用杀鼠灵标准品与大米诱饵配制而成,将抗性检测后死亡鼠和存活鼠分别取2~3个脚趾保存于95%乙醇溶液中备用。
1.3.2 黄毛鼠基因组DNA提取参照动物组织DNA提取试剂盒说明书提取黄毛鼠基因组DNA。
1.3.3 VKORC1基因的克隆参照黄胸鼠VKORC1(FJ868831.1)基因序列设计引物,由生工生物工程(上海)股份有限公司合成。PCR反应体系:DNA模板1 μl,引物各1 μl,Premix Taq 25 μl,加ddH2O至50 μl,PCR反应条件:94 ℃预变性5 min;94 ℃变性30 s,61~63 ℃退火30 s,72 ℃延伸40 s,35个循环;最后再72 ℃延伸5 min[14]。PCR产物经1%琼脂糖凝胶电泳检测、纯化回收后送生工生物工程(上海)股份有限公司进行测序。
1.3.4 VKORC1基因单核苷酸多态性(SNP)位点筛选及与抗性的相关性分析采用DNAStar 5.0和DNAMan 4.0软件对测序得到的序列进行拼接、比对,获得VKORC1基因的全长,其中外显子区和内含子区边界参考黄胸鼠(FJ868831.1)的序列说明确定。用Clustal W软件筛选突变和多态性位点,对于序列中存在的杂合位点,用简并碱基(R、Y、M、K、S、W)表示,对于插入缺失杂合子,用小写字母(a=A/-、c=C/-、g=G/-、t=T/-)表示。
1.4 统计学分析采用SPSS 19.0软件进行列联表独立性χ2检验,分析VKORC1基因突变位点与抗性的关联关系,P<0.05为差异有统计学意义。
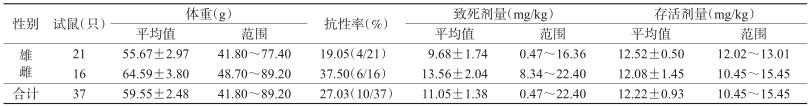
2 结果 2.1 黄毛鼠对第一代抗凝血杀鼠剂的抗药性发生状况在江门市新会区农田捕获黄毛鼠37只,检测出抗性鼠10只,抗性率为27.03%,其中16只雌鼠中有抗性鼠6只,21只雄鼠中有抗性鼠4只,抗性率分别为37.50%和19.05%,性别间差异无统计学意义(χ2=1.568,P=0.274)。抗性个体的平均摄药剂量为(12.22±0.93)mg/kg,敏感个体的平均摄药剂量为(11.05±1.38)mg/kg,差异无统计学意义(t=1.298,P=0.210)(表 1)。
|
对37只黄毛鼠个体进行测序,经序列校对和拼接,得到37条VKORC1基因的全序列,比对后的全长为2 166 bp(包括插入缺失位点),其中1~195、196~1 006、1 007~1 116、1 117~1 963、1 964~2 166分别为外显子1、内含子1、外显子2、内含子2和外显子3。黄毛鼠VKORC1基因编码区DNA序列与常见种褐家鼠、黄胸鼠、小家鼠和屋顶鼠的相似度分别为99%、99%、93%和99%,氨基酸序列与褐家鼠、黄胸鼠、小家鼠和屋顶鼠的相似度分别为99%、100%、93%和100%。
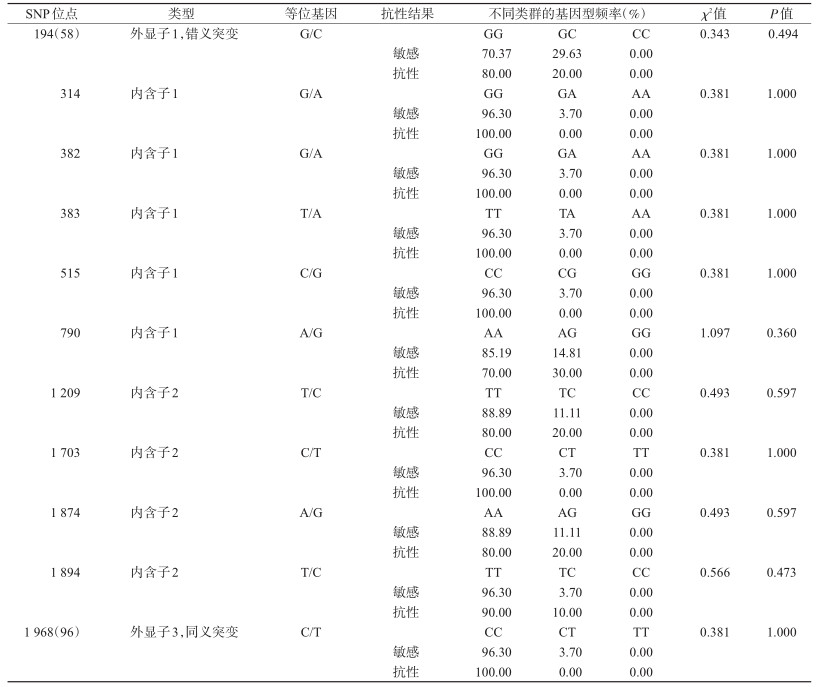
2.3 VKORC1基因SNP位点筛选及与抗性的相关性分析基因型分析检测到8个二倍体基因型,其中2个为纯合子,基因型D01频率达到70.27%,为该地区存在的主要类型,其余频率均<10%(表 2)。共筛选到12个SNP位点,其中1个为插入缺失位点,外显子1和外显子3各存在1个变异位点,内含子1和内含子2分别存在6和4个变异位点,外显子1的突变导致VKORC1第58位的氨基酸变异(Arg58Gly),且均为杂合突变,其中第58位氨基酸Arg的频率为27.03%,Gly的频率为72.97%,10个抗性个体中有8个杂合突变体,27个敏感个体中有19个杂合突变体,第58位氨基酸突变与黄毛鼠抗药性无相关性(χ2=0.343,P=0.694),而外显子3的突变为同义突变(Cys96Cys)。经χ2检验,黄毛鼠的抗药性与VKORC1基因中SNP位点的相关性无统计学意义(P>0.05)(表 3)。

|
|
2005年抗性监测结果显示,广东省江门市新会区黄毛鼠对第一代抗凝血杀鼠剂产生了抗性种群,抗性率为36.67%[11],经过10多年的灭鼠活动,黄毛鼠对第一代抗凝血杀鼠剂的耐药力强,抗性率依然高达27.03%,其原因主要是由于该地区地处珠江三角洲,作物种植结构复杂,害鼠的发生量大,每年灭鼠次数多,导致害鼠的耐药力逐年提高,抗药性居高不下,推荐该地区全面使用第二代抗凝血杀鼠剂进行灭鼠,全年统一灭鼠2次,同时综合利用生态调控技术、栖息地灭鼠技术、生物控鼠技术、杀鼠剂减量增效技术等措施降低害鼠的发生量,减少抗凝血杀鼠剂的使用量,从而减轻抗凝血杀鼠剂的选择强度,降低鼠类的抗药性。
VKORC1基因多态性尤其是引起氨基酸改变的SNP是鼠类对抗凝血杀鼠剂产生抗性的主要原因[16],VKORC1基因的变异在种群中以较低或极低的频率存在,在抗凝血杀鼠剂的选择作用下,携带抗性变异的个体存活下来并大量繁殖,从而产生抗性种群。目前在褐家鼠、小家鼠和屋顶鼠等鼠种的VKORC1基因中已经发现多种不同的氨基酸变异,其中在小家鼠、屋顶鼠和黄毛鼠中均发现了Arg58位点的变异[13, 17-18]。研究表明,VKORC1第139位的Tyr、第138位的Thr和第140位的Ala是杀鼠灵等抗凝血杀鼠剂的结合位点,Tyr139位点的变异可以导致鼠类对抗凝血杀鼠剂的抗药性,此外携带第33、35、59和120位氨基酸变异的VKOR在经杀鼠灵处理后也保持较高的活性[19]。Wang等[13]认为Arg58Gly突变是黄毛鼠产生抗性的主要原因,而本研究结果中VKORC1第58位的氨基酸变异与抗性的相关性无统计学意义,研究结果的差异可能与抗性生物测定方法的精准度、样本量以及样本的捕获地点有一定关系,LFP法以试鼠的死亡作为敏感或抗性的判别标准,在不同季节,同样的药物剂量下试鼠的敏感程度不一样,在炎热的夏季,动物血液循环快,试鼠摄入抗凝血杀鼠剂后更容易出血,因此应针对不同季节制定黄毛鼠的抗性判别标准,完善黄毛鼠抗性生物测定方法。在研究的37个样本中,VKORC1第58位氨基酸Gly的频率为72.97%,Arg的频率为27.03%,而第58位Arg为野生型氨基酸,野生型频率明显低于突变型频率,表明该地区突变型在长期的自然选择过程中比野生型更具有竞争优势,并逐渐替代野生型。
鼠类抗药性的形成除了与VKORC1基因的多态性相关外,基因的表达量上也会存在差异,此外,细胞色素氧化酶P450基因的多态性或表达量变化以及遗传渗入也会导致抗性的发生[20-21],抗药性的形成可能是多个基因协同作用的结果,探索鼠类对抗凝血杀鼠剂抗药性的分子机制对于开展抗性的分子检测及害鼠的抗性治理具有重要的理论和现实意义。
| [1] |
Wallin R, Hutson SM. Warfarin and the vitamin K-dependent γ-carboxylation system[J]. Trends Mol Med, 2004, 10(7): 299-302. DOI:10.1016/j.molmed.2004.05.003 |
| [2] |
Pelz HJ, Rost S, Hünerberg M, et al. The genetic basis of resistance to anticoagulants in rodents[J]. Genetics, 2005, 170(4): 1839-1847. DOI:10.1534/genetics.104.040360 |
| [3] |
Blažić T, Jokić G, Götz M, et al. Brodifacoum as a first choice rodenticide for controlling bromadiolone-resistant Mus musculus[J]. J Stored Prod Res, 2018, 79: 29-33. DOI:10.1016/j.jspr.2018.08.006 |
| [4] |
Garg N, Singla N, Jindal V, et al. Studies on bromadiolone resistance in Rattus rattus populations from Punjab, India[J]. Pestic Biochem Phys, 2017, 139: 24-31. DOI:10.1016/j.pestbp.2017.04.005 |
| [5] |
易建荣, 林立丰, 伍任初, 等. 广州市家栖鼠对第一代抗凝血灭鼠剂抗药性研究[J]. 中国媒介生物学及控制杂志, 2004, 15(5): 357-359. DOI:10.3969/j.issn.1003-4692.2004.05.006 |
| [6] |
邓良利, 孙毅, 田汶佳. 成都地区抗药性褐家鼠维生素K环氧化物还原酶编码基因的变异[J]. 医学动物防制, 2016, 32(12): 1353-1355, 1432. |
| [7] |
刘泳廷, 郑越平, 林孟华, 等. 贵阳市黄胸鼠对溴敌隆的抗性及大隆对抗性鼠杀灭效果观察[J]. 医学动物防制, 2012, 28(12): 1341-1343. |
| [8] |
冯志勇, 姚丹丹, 黄立胜, 等. 黄毛鼠对第一代抗凝血灭鼠剂的抗药性监测[J]. 植物保护学报, 2007, 34(4): 420-424. DOI:10.3321/j.issn:0577-7518.2007.04.017 |
| [9] |
宋英, 李宁, 王大伟, 等. 鼠类对抗凝血类灭鼠剂抗药性的遗传机制[J]. 中国科学:生命科学, 2016, 46(5): 619-626. DOI:10.1360/N052016-00161 |
| [10] |
Mooney J, Lynch MR, Prescott CV, et al. VKORC1 sequence variants associated with resistance to anticoagulant rodenticides in Irish populations of Rattus norvegicus and Mus musculus domesticus[J]. Sci Rep, 2018, 8(1): 4535. DOI:10.1038/s41598-018-22815-7 |
| [11] |
Cowan PE, Gleeson DM, Howitt RL, et al. Vkorc1 sequencing suggests anticoagulant resistance in rats in New Zealand[J]. Pest Manag Sci, 2017, 73(1): 262-266. DOI:10.1002/ps.4304 |
| [12] |
Goulois J, Chapuzet A, Lambert V, et al. Evidence of a target resistance to antivitamin K rodenticides in the roof rat Rattus rattus:identification and characterisation of a novel Y25F mutation in the Vkorc1 gene[J]. Pest Manag Sci, 2016, 72(3): 544-550. DOI:10.1002/ps.4020 |
| [13] |
Wang JS, Feng ZY, Yao DD, et al. Warfarin resistance in Rattus losea in Guangdong province, China[J]. Pestic Biochem Phys, 2008, 91(2): 90-95. DOI:10.1016/j.pestbp.2008.01.007 |
| [14] |
Huang BH, Feng ZY, Yue LF, et al. Warfarin resistance test and polymorphism screening in the VKORC1 gene in Rattus flavipectus[J]. J Pest Sci, 2011, 84(1): 87-92. DOI:10.1007/s10340-010-0330-5 |
| [15] |
赵芳, 张同作, 苏建平, 等. 青藏高原5种害鼠vkorc1基因的测序分析[J]. 草业科学, 2016, 33(6): 1206-1212. |
| [16] |
Goulois J, Lambert V, Legros L, et al. Adaptative evolution of the Vkorc1 gene in Mus musculus domesticus is influenced by the selective pressure of anticoagulant rodenticides[J]. Ecol Evol, 2017, 7(8): 2767-2776. DOI:10.1002/ece3.2829 |
| [17] |
Pelz HJ, Rost S, Müller E, et al. Distribution and frequency of VKORC1 sequence variants conferring resistance to anticoagulants in Mus musculus[J]. Pest Manag Sci, 2012, 68(2): 254-259. DOI:10.1002/ps.2254 |
| [18] |
Tanaka KD, Kawai YK, Ikenaka Y, et al. The genetic mechanisms of warfarin resistance in Rattus rattus found in the wild in Japan[J]. Pestic Biochem Phys, 2012, 103(2): 144-151. DOI:10.1016/j.pestbp.2012.04.011 |
| [19] |
Rost S, Pelz HJ, Menzel S, et al. Novel mutations in the VKORC1 gene of wild rats and mice-a response to 50 years of selection pressure by warfarin?[J]. BMC Genet, 2009, 10: 4. DOI:10.1186/1471-2156-10-4 |
| [20] |
Song Y, Endepols S, Klemann N, et al. Adaptive introgression of anticoagulant rodent poison resistance by hybridization between old world mice[J]. Curr Biol, 2011, 21(15): 1296-1301. DOI:10.1016/j.cub.2011.06.043 |
| [21] |
Markussen MD, Heiberg AC, Fredholm M, et al. Differential expression of cytochrome P450 genes between bromadiolone-resistant and anticoagulant-susceptible Norway rats:a possible role for pharmacokinetics in bromadiolone resistance[J]. Pest Manag Sci, 2008, 64(3): 239-248. DOI:10.1002/ps.1506 |
 2019, Vol. 30
2019, Vol. 30


