扩展功能
文章信息
- 段兴德, 何志海, 高子厚, 蒋宝贵, 龚正达, 张云, 邵宗体, 江佳富, 孙毅, 刘洪波, 姚明国, 王帆, 杜春红
- DUAN Xing-de, HE Zhi-hai, GAO Zi-hou, JIANG Bao-gui, GONG Zheng-da, ZHANG Yun, SHAO Zong-ti, JIANG Jia-fu, SUN Yi, LIU Hong-bo, YAO Ming-guo, WANG Fan, DU Chun-hong
- 云南省边境地区卵形硬蜱中中华基因型伯氏疏螺旋体的检出和鉴定
- Detection and identification of Borrelia sinica in Ixodes ovatus from the border region of Yunnan province, China
- 中国媒介生物学及控制杂志, 2019, 30(5): 519-523
- Chin J Vector Biol & Control, 2019, 30(5): 519-523
- 10.11853/j.issn.1003.8280.2019.05.009
-
文章历史
- 收稿日期: 2019-04-18
- 网络出版时间: 2019-08-07 07:00
2 军事科学院军事医学研究院微生物流行病研究所, 病原微生物生物安全国家重点实验室, 北京 100071
2 State Key Laboratory of Pathogen and Biosecurity, Institute of Microbiology and Epidemiology, Academy of Military Medical Sciences
伯氏疏螺旋体(Borrelia burgdorferi)为莱姆病的病原体,人感染后,可引起关节、皮肤、心脏、神经系统等多器官的损害,严重者可致终生残疾,甚至死亡。该菌贮存宿主为一些哺乳动物和鸟类,经携带病原体的蜱叮咬吸血时传播给人类。莱姆病分布较为广泛,全球70多个国家均有报道,已经构成严重的世界性公共卫生问题。根据5S~23S rRNA基因间隔区等分析,至少可以分为21个不同的基因型[1-2]。目前认为狭义伯氏疏螺旋体(B. burgdorferi sensu srricto)、伽氏疏螺旋体(B. garinii)、阿弗西尼疏螺旋体(B. afzeli)、巴伐利亚疏螺旋体(B. bavariensis)和比塞蒂疏螺旋体(B. bissettii)具有致病性[3-4],而随着法雷斯疏螺旋体(B. valaisiana)、卢西塔尼亚疏螺旋体(B. lusitaniae)、库尔滕巴赫疏螺旋体(B. kurtenbachii)和斯柏曼疏螺旋体(B. spielmanii)等基因型相继从患者体内检测到,对人有致病性的伯氏疏螺旋体被发现的越来越多[5-8]。其中中华基因型伯氏疏螺旋体(B. sinica)是1998年在我国四川、安徽省的北社鼠(Niviventer confucianus)和卵形硬蜱(Ixodes ovatus)中首次发现的新型伯氏疏螺旋体,被命名为中华基因型伯氏疏螺旋体,其致病性等特征有待研究[9]。本项目组在对云南省蜱媒病进行调查的过程中,在云南省边境耿马县的卵形硬蜱中也检出该基因型螺旋体,现将结果报告如下。
1 材料与方法 1.1 蜱样本采集于2016年4月在云南省耿马县南滚河保护区,采用90 cm×60 cm拖布在林区捕获游离蜱,以每人每100 m所捕获蜱数进行密度指数统计,单位为只/(布旗100 m·h)。计算公式:密度指数=检获的蜱总数(只)×100 ×60 /布旗数×每布旗拖旗距离(m) ×拖蜱时间(min)。捕获蜱通过形态学鉴定蜱种及性别。
1.2 试剂和设备血液组织DNA提取试剂盒(Qiagen DNeasy Blood & Tissue Kit,天根生化科技有限公司),琼脂糖(西班牙Biowest公司)、5×TBE (北京索莱宝科技有限公司)、DreamTaq Green PCR Master Mix(2×) (美国,Thermo Fisher Scientific公司),DL2000 DNA Marker(日本,TaKaRa公司);凝胶成像仪(美国Bio-rad,GelDoc XR Biorad)、PCR仪(德国Biometra公司,SENSO,LabCycler Gradient Fuses型)、水平电泳槽(北京君意东方电泳设备有限公司,JY-SPFT型)。
1.3 方法 1.3.1 提取基因组DNA取单只蜱进行研磨后,按照血液基因组DNA提取试剂盒说明书提取DNA。
1.3.2 PCR扩增采用巢式PCR扩增伯氏疏螺旋体5S~23S rRNA间隔区252 bp目的片段作为初筛实验,阳性者采用半巢式PCR扩增16S rRNA和FLA鞭毛蛋白基因进一步确定。5S~23S rRNA间隔区检测为国际上公认的较特异的方法,16S rRNA和FLA鞭毛蛋白基因引物设计及扩增条件为军事科学院军事医学研究院微生物流行病研究所提供(表 1)。PCR产物用1.5%的琼脂糖凝胶电泳后凝胶成像仪观察结果。每次实验均设立阴性对照,为避免标本污染所造成的假阳性,DNA模板提取、反应体系的配制、PCR扩增均在不同的房间进行。

|
PCR产物送北京天一辉远公司进行双向测序。利用CLC Genomics Workbench 3.6.1软件将所得序列进行拼接。登录美国国立生物技术信息中心(NCBI)网站,利用“Blast Sequence Similarity Searching”工具将测序结果与GenBank中注册基因序列进行同源性比对。采用Lasergene软件包的MegAlign程序进行序列比对。应用MEGA 6.06软件,邻接法Neighbor-Joining(NJ),Kimura 2-parameter model,bootstrap 1 000构建系统发育树。
1.4 统计学分析使用SPSS17.0软件对数据进行统计分析,计数资料分析采用率或构成比之间的χ2检验,P<0.05为差异有统计学意义。
2 结果 2.1 蜱样本采集情况在2个点共捕获游离蜱113只,其中1个点的密度指数为0.33只/(布旗100 m·h),另1个点为0.05只/(布旗100 m·h)。经形态学鉴定,分别为卵形硬蜱93只,锐跗硬蜱(I. acutitarsus)11只,金泽革蜱(Dermacentor auratus)8只,北岗血蜱(Haemaphysalis kitaokai) 1只,均未吸血。除留取19只作为长期保存标本外,共对94只进行检测,分别检测卵形硬蜱80只(28♂、52♀),锐跗硬蜱7只(3♂、4♀),金泽革蜱7只(2♂、5♀)。
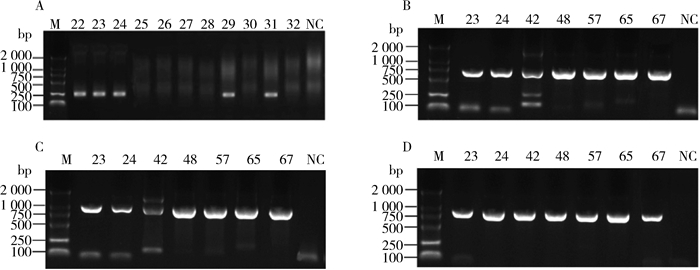
2.2 伯氏疏螺旋体不同目的基因检测结果94只蜱共检出阳性14只,阳性率为14.89%(14/94),阳性蜱均为卵形硬蜱(3♂、11♀),阳性率为17.50%(14/80)。卵形硬蜱中雄性阳性率为10.71%(3/28),雌性为21.15%(11/52),差异无统计学意义(χ2=0.746,P=0.388)。锐跗硬蜱和金泽革蜱各检测7只均为阴性。14份阳性样本进一步检测16S rRNA和FLA鞭毛蛋白基因,均扩增到相应的目的片段(图 1)。
|
| 注:M. DNA Marker;NC.阴性对照;22~67.检测蜱DNA样本;A. 5S~23S rRNA间隔区扩增产物(252 bp);B. 16S rRNA基因前段扩增产物(680 bp);C. 16S rRNA基因后段扩增产物(910 bp);D. FLA鞭毛蛋白基因扩增产物(800 bp) 图 1 部分蜱样本PCR扩增产物电泳结果 Figure 1 Electrophoresis of PCR amplification products of some tick samples |
| |
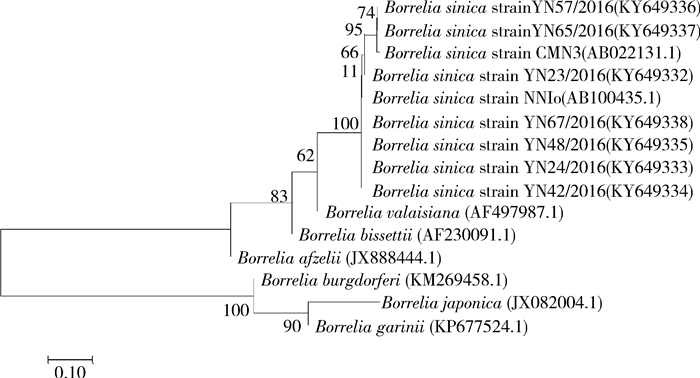
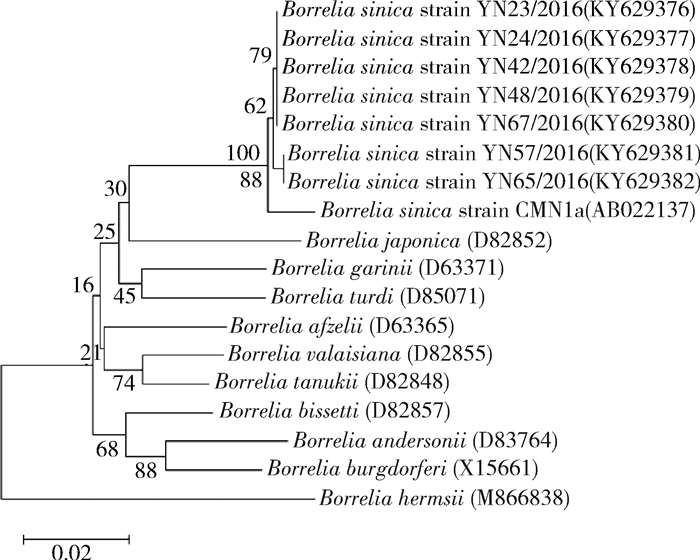
阳性样本成功测序,在NCBI网站分别注册序列号。5S~23S rRNA间隔区GenBank注册的序列号为KY649332~KY649338,16SrRNA GenBank注册的序列号为KY622007~KY622012,FLA鞭毛蛋白GenBank注册的序列号为KY629376~KY629382。所得序列分别与GenBank中注册的核苷酸序列进行比较,检出的伯氏疏螺旋体3个目的基因片段均与中华基因型伯氏疏螺旋体同源性最高(98%~99%),构建的系统发育树显示与在我国四川、安徽省检出的中华基因型伯氏疏螺旋体在一个分支上。与日本疏螺旋体(B. japonica)接近,而阿弗西尼疏螺旋体、狭义伯氏疏螺旋体、法雷斯疏螺旋体等基因型聚在外围(图 2~4)。
|
| 图 2 基于中华基因型伯氏疏螺旋体5S~23S rRNA间隔区测序结果构建的进化树 Figure 2 Phylogenetic tree based on the sequencing results of Borrelia sinica 5S~23S rRNA intergenic spacer region |
| |

|
| 图 3 基于中华基因型伯氏疏螺旋体16S rRNA测序结果构建的进化树 Figure 3 Phylogenetic tree based on the sequencing results of Borrelia sinica 16S rRNA |
| |
|
| 图 4 基于中华基因型伯氏疏螺旋体FLA测序结果构建的进化树 Figure 4 Phylogenetic tree based on the sequencing results of Borrelia sinica FLA |
| |
莱姆病是20世纪70年代发现的由伯氏疏螺旋体感染所致的一种人兽共患病。自1982年分离到病原体以来,全球五大洲均有病例报道,全世界每年发病及感染人数在30万例左右,主要集中在北半球[10]。来自许多欧洲国家和美国的流行病学数据显示,由于近年来新的诊断方法的快速发展,该病的诊断病例急剧增加,并随着该疾病定义的变化,以前不被认为是莱姆病的现在也可能被确认[8, 11]。我国自1985年黑龙江省海林县林区发现首例莱姆病患者以来,自然疫源地不断被发现,发病区域在不断扩大。张哲夫等以血清流行病学调查确定29个省(直辖市、自治区)有该病分布,病原学方法已确定19个省(直辖市、自治区)存在莱姆病自然疫源地[12-13]。而伯氏疏螺旋体是一种较为复杂的病原体,可侵犯神经系统、运动系统、循环系统等,临床表现极其复杂,并与人类组织有相似抗原成分,可导致自身免疫性损害。因此,对不同基因型进行研究,对疾病的诊断、诊断抗原的抗原性、疫苗的保护作用等均有重要意义。既往研究表明,我国流行的主要基因型为伽氏疏螺旋体、阿弗西尼疏螺旋体。云南省既往在人、犬和鼠类检出阿弗西尼疏螺旋体、法雷斯疏螺旋体、伽氏疏螺旋体莱姆病感染[14-16]。本次调查在耿马县采集的卵形硬蜱中检出中华基因型伯氏疏螺旋体,阳性率为14.89%,雌性和雄性均有检出。并通过16S rRNA和FLA鞭毛蛋白基因的检测进一步得到确证。该基因型是日本学者在我国长江一带分离到的新的螺旋体,云南省尚未见报道。锐跗硬蜱和金泽革蜱未检出阳性,可能与样本量太少或者蜱种不同有关。北岗血蜱因仅有1只,留作保存样本未进行检测。
云南省地处中国西南边陲,是我国动植物资源最丰富的地区,既往调查证实云南省小型兽类已知达6目19科82属201种[17],蜱类达9属46种[18],并且不断有新的蜱种被发现[19],具有自然疫源性疾病生物多样性很高的区域特征。耿马县位于云南省西南部,与缅甸山水相连,属南亚热带季风气候类型。境内的南滚河国家级自然保护区内森林植被保存完好,野生珍稀动、植物种类繁多,是全国不可多得的热带雨林保护区。本次调查仅在2个调查点即捕获卵形硬蜱、锐跗硬蜱、金泽革蜱和北岗血蜱4种,其中1个点的游离蜱密度为0.33只/(布旗100 m·h),本次检出的中华基因型伯氏疏螺旋体均分布于该采样点的卵形硬蜱中,是否因蜱来源于携带该病原体的同一类宿主动物不详。据记载,卵形硬蜱在我国分布广泛,多生活于山地灌木丛或林带,宿主多样,家畜和野生动物均有寄生,如牛、马、驴、绵羊、猪、鹿、斑羚、林麝、黄鼬、大熊猫等,也侵袭人类[20]。因此,当地其他蜱种携带伯氏疏螺旋体的情况,其宿主和媒介的种类、分布及对人群的致病性等问题,值得进一步调查研究。
| [1] |
Kingry LC, Batra D, Replogle A, et al. Whole genome sequence and comparative genomics of the novel Lyme borreliosis causing pathogen, Borrelia mayonii[J]. PLoS One, 2016, 11(12): e0168994. DOI:10.1371/journal.pone.0168994 |
| [2] |
Loh SM, Gillett A, Ryan U, et al. Molecular characterization of 'Candidatus Borrelia tachyglossi' (family Spirochaetaceae) in echidna ticks, Bothriocroton concolor[J]. Int J Syst Evol Microbiol, 2017, 67(4): 1075-1080. DOI:10.1099/ijsem.0.001929 |
| [3] |
Stanek G, Reiter M. The expanding Lyme borrelia complex-clinical significance of genomic species?[J]. Clin Microbiol Infect, 2011, 17(4): 487-493. DOI:10.1111/j.1469-0691.2011.03492.x |
| [4] |
Scholz HC, Margos G, Derschum H, et al. High prevalence of genetically diverse Borrelia bavariensis-like strains in Ixodes persulcatus from Selenge Aimag, Mongolia[J]. Ticks Tick Borne Dis, 2013, 4(1/2): 89-92. DOI:10.1016/j.ttbdis.2012.08.004 |
| [5] |
Rudenko N, Golovchenko M, Růžek D, et al. Molecular detection of Borrelia bissettii DNA in serum samples from patients in the Czech Republic with suspected borreliosis[J]. FEMS Microbiol Lett, 2009, 292(2): 274-281. DOI:10.1111/j.1574-6968.2009.01498.x |
| [6] |
Clark KL, Leydet B, Hartman S. Lyme borreliosis in human patients in Florida and Georgia, USA[J]. Int J Med Sci, 2013, 10(7): 915-931. DOI:10.7150/ijms.6273 |
| [7] |
Collares-Pereira M, Couceiro S, Franca I, et al. First isolation of Borrelia lusitaniae from a human patient[J]. J Clin Microbiol, 2004, 42(3): 1316-1318. DOI:10.1128/JCM.42.3.1316-1318.2004 |
| [8] |
Rudenko N, Golovchenko M, Grubhoffer L, et al. Updates on Borrelia burgdorferi sensu lato complex with respect to public health[J]. Ticks Tick Borne Dis, 2011, 2(3): 123-128. DOI:10.1016/j.ttbdis.2011.04.002 |
| [9] |
Masuzawa T, Takada N, Kudeken M, et al. Borrelia sinica sp. nov., a Lyme disease-related Borrelia species isolated in China[J]. Int J Syst Evol Microbiol, 2001, 51(5): 1817-1824. DOI:10.1099/00207713-51-5-1817 |
| [10] |
蒋宝贵, 褚宸一, 曹务春. 伯氏疏螺旋体分子遗传学研究进展[J]. 中国病原生物学杂志, 2008, 3(12): 942-946. DOI:10.3969/j.issn.1673-5234.2008.12.020 |
| [11] |
Hubálek Z. Epidemiology of Lyme borreliosis[M]//Lipsker D, Jaulhac B. Lyme borreliosis. Basel: Karger, 2009: 31-50. DOI: 10.1159/000213069.
|
| [12] |
万康林, 张哲夫, 张金声, 等. 中国20个省、区、市动物莱姆病初步调查研究[J]. 中国媒介生物学及控制杂志, 1998, 9(5): 366-370. DOI:10.3969/j.issn.1003-4692.1998.05.015 |
| [13] |
耿震.莱姆病螺旋体脉冲场凝胶电泳标准化技术建立及初步应用研究[D].长春: 吉林大学, 2013: 1-3. http://cdmd.cnki.com.cn/Article/CDMD-10183-1014130305.htm
|
| [14] |
马海滨, 杨文映, 杜春红, 等. 60例精神病患者血清莱姆病抗体检测报告[J]. 中国人兽共患病学报, 1993, 9(3): 60. |
| [15] |
边长玲, 龚正达, 张丽云, 等. 我国滇西北山区家犬莱姆病螺旋体基因的检测及序列分析[J]. 中国预防医学杂志, 2010, 11(8): 757-759. DOI:10.16506/j.1009-6639.2010.08.002 |
| [16] |
杨丽天, 高子厚, 赵文红, 等. 云南省德钦县宿主动物感染伯氏疏螺旋体情况初步调查[J]. 中国热带医学, 2015, 15(4): 419-421, 433. DOI:10.13604/j.cnki.46-1064/r.2015.04.011 |
| [17] |
李栋, 龚正达. 云南省小型兽类区系与多样性的研究概况[J]. 中国媒介生物学及控制杂志, 2011, 22(1): 89-93, 97. |
| [18] |
范泉水. 西南地区自然疫源性疾病与医学动物[M]. 北京: 军事医学科学出版社, 2013: 561-565.
|
| [19] |
Du CH, Sun Y, Xu RM, et al. Description of Haemaphysalis (Alloceraea) Kolonini sp. nov., a new species in subgenus Alloceraea Schulze (Ixodidae:Haemaphysalis) in China[J]. Acta Parasitol, 2018, 63(4): 678-691. DOI:10.1515/ap-2018-0080 |
| [20] |
邓国藩, 姜在阶. 中国经济昆虫志.第39册[M]. 北京: 科学出版社, 1991: 87-91.
|
 2019, Vol. 30
2019, Vol. 30


