扩展功能
文章信息
- 康央, 宋秀平, 张燕君, 刘起勇, 栗冬梅
- KANG Yang, SONG Xiu-ping, ZHANG Yan-jun, LIU Qi-yong, LI Dong-mei
- 7种鼠传病原体多重PCR检测方法的建立与应用
- Establishment and application of a multiplex PCR detection method for seven rodent-borne pathogens
- 中国媒介生物学及控制杂志, 2019, 30(5): 487-493
- Chin J Vector Biol & Control, 2019, 30(5): 487-493
- 10.11853/j.issn.1003.8280.2019.05.002
-
文章历史
- 收稿日期: 2019-06-20
- 网络出版时间: 2019-08-07 10:51
2 山东大学生命科学学院, 山东 青岛 266237
2 School of Life Sciences Shandong University
鼠传疾病是由啮齿动物和其携带的寄生虫传播而引起的危害人畜健康的重要传染病。鼠形动物能引起多种传染病,病死率高,在世界范围内多次暴发流行,死亡人数高达千万计。近年来,随着全球化进程加快,人类活动增强,鼠传疾病流行区域不断扩大,出现多种新发鼠传疾病及复燃的老传染病[1-3],由嗜吞噬细胞无形体(Anaplasma phagocytophilum,Ap)和巴尔通体(Bartonella,Bar)引起的传染病是我国新发传染病,由恙虫病东方体(Orientia tsutsugamushi,Ot)、莫氏立克次体(Rickettsia typhi,Rt)、土拉弗朗西斯菌(Francisella tularensis,Ft)、贝氏柯克斯体(Coxiella burnetii,Cb)和问号钩端螺旋体(Leptospira interrogans,Lep)引起的传染病是我国再发传染病,新发、再发传染病均有着传播速度快,散播面积广,危害性大的特点,其中Lep引起的钩端螺旋体(钩体)病和Rt引起的地方性斑疹伤寒是我国法定传染病,多年来一直困扰我国居民的身体健康,由Cb引发的Q热疫区遍布全球各大洲,是分布最广的人兽共患病之一[4]。
及时准确地检测和监测宿主及传播媒介携带的病原体是预防控制鼠传疾病的前哨工作之一。传统的分离培养法、血清学检测法等存在检测周期长、操作通量小和灵敏度较低等问题,目前,以核酸分子扩增技术为基础的一系列PCR技术和核酸分子杂交技术等可以实现高通量检测,但多重PCR技术(multiplex PCR,mPCR)和多重探针实时荧光定量PCR(real-time fluorescent quantitative PCR,qPCR)技术存在不同程度的分辨率低、检测种类数少等缺点。基因芯片法和高通量测序能够高通量、高灵敏度地检测病原体,但费用昂贵,数据处理专业性强,目前尚难以推广使用。本研究应用微生物数据分析云平台(https://analysis.mypathogen.org/)筛选特异核酸分子检测标识设计引物,建立多重PCR反应体系,利用QIAxcel毛细管电泳系统敏感、分辨率高的优势,观察扩增产物,建立一种高效、快速、简便的多重鼠传病原体检测方法。
1 材料与方法 1.1 核酸模板和质粒标准品各阳性菌株核酸包括Ot、Ap、Ft、Rt、Cb和Lep,巴尔通体属选取B. clarridgeiae(Bc)、B. doshiae(Bd)、B. elizabethae(Be)、B. grahamii(Bg)、B. henselae(Bh)、B. koehlerae(Bk)、B. quintana(Bq)和B. tribocorum(Bt)。非特异性核酸包括牛种布鲁氏菌(Brucella abortus)、金黄色葡萄球菌(Staphylococcus aureus)、根癌土壤杆菌(Agrobacterium tumefaciens)、长角血蜱(Haemaphysalis longicornis)、猫蚤(Meerkat)和人核酸,上述材料均由中国疾病预防控制中心传染病预防控制所保存。以特异性引物扩增序列为目的序列,将其与克隆载体连接制备成质粒标准品。
1.2 主要仪器与试剂QIAxcel毛细管电泳仪(德国QIAgen),梯度PCR仪(德国Sensoquest),实时荧光定量PCR仪CFX96(美国Bio Rad)。
Platinum multiplex PCR master mix(美国Applied Biosystems),Size Marker 25~500 bp、Alignment Marker 15~600 bp和毛细管电泳卡夹QIAxcel DNA high resolution kit(德国QIAgen)。本实验所用引物、探针由北京擎科生物有限公司合成。
1.3 特异基因筛选和引物设计在微生物数据分析云平台上传目标菌基因组序列、对比菌(与目标菌分类学相近的菌)基因组序列和目标菌的基因编码序列(coding sequences,CDS),选择“special marker gene”工作流运行,即可得到目标菌特异基因。根据特异基因序列在Primer premiers 5软件上设计目标菌特异性引物。
从拟南芥基因组中选取一段非同源性序列设计通用引物,正向引物GF为5′-TTCTTCCGCCTGA TT-3′,反向引物GR为5′-TGTTGGCATTCTCGT-3′,分别加在目标菌特异性引物正反向5′端构成特异性嵌合引物(specific chimeric primers,SCPs)(图 1)。
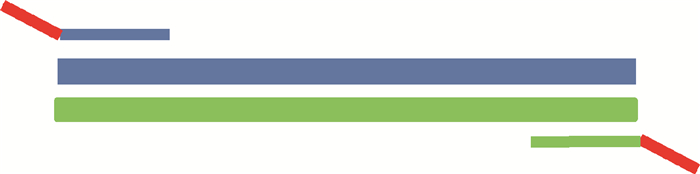
|
| 注:红色表示通用引物,蓝、绿色细线为目标菌特异性引物,红和蓝(红和绿)整体为特异性嵌合引物 图 1 特异性嵌合引物 Figure 1 Specific chimeric primers |
| |
本研究建立的mPCR方法根据温度转换PCR(temperature switch PCR,TSP)原理[4],在特异性引物5′端加一段通用引物,构成特异性嵌合引物SCPs。在mPCR反应体系中,含有1对通用引物及7对SCPs,根据退火温度不同反应分为3个反应阶段,第1阶段退火温度为55.0~59.0 ℃,使靶基因特异性引物与模板结合引发扩增,第2阶段退火温度为66.5~71.5 ℃,使SCPs与模板结合引发扩增,第3阶段退火温度为43.5~48.5 ℃,使通用引物与模板结合引发扩增。通过设置反应体系中通用引物浓度为特异性嵌合引物的10倍,使整个PCR反应以通用引物为主导完成,避免了各病原体特异性引物间的扩增偏好性。
1.4 mPCR体系的建立与优化单重PCR反应体系:特异性嵌合引物SCF、SCR各1 μl(1 μmol/L),通用引物GF、GR各1 μl(10 μmol/L),2×master mix 12.5 μl,DNA模板3 μl,ddH2O 5.5 μl。反应条件:95 ℃预变性5 min;95 ℃变性30 s,60 ℃退火1 min,72 ℃延伸1 min,10个循环;95 ℃变性30 s,69 ℃退火1 min,72 ℃延伸1 min,10个循环;95 ℃变性30 s,45 ℃退火1 min,72 ℃延伸1 min,20个循环;72 ℃延伸10 min。设置温度梯度PCR优化各阶段引物退火温度,琼脂糖凝胶电泳检测扩增产物。在单重PCR反应基础上,依次增加引物,提高PCR反应重数,并优化引物浓度、延伸时间和循环数,得到最优的mPCR体系。
1.5 mPCR体系特异性检测根据1.4部分优化结果配制反应体系,以阳性菌株核酸和非特异性核酸为模板进行检测,其中Bar选取8种常见的巴尔通体进行检测,QIAxcel毛细管电泳检测扩增产物。
1.6 mPCR体系灵敏度和重复性检测根据拷贝数浓度换算公式:拷贝数浓度(copies/μl)=〔DNA浓度(ng/μl)/碱基数×660〕×6.02×1023,将质粒标准品按10倍比稀释至100~105拷贝/μl。多引物单模板灵敏度检测:根据1.4部分优化结果配制反应体系,以不同稀释度标准品为模板,每个稀释度做3个重复,琼脂糖凝胶电泳和QIAxcel毛细管电泳检测扩增产物,并且非同日进行3次重复实验,分析该体系的重复性。多引物多模板灵敏度检测:根据最小公倍数计算法,将各病原体的质粒标准品取一定量配制成混合模板,使各标准品在混合模板中拷贝数一致,将混合模板按10倍系列稀释为2×100~2×105拷贝/μl。检测方法与多引物单模板一致。
1.7 野外样品检测与分析用mPCR法、已发表的单重常规PCR法(简称常规PCR法)[5-9]和单重qPCR法[10-16]对86份野外鼠脾样品检测7种鼠传病原体,常规PCR法和单重qPCR法的检测方法与文献[5-16]中记载一致。
1.8 统计学分析对mPCR法和单重qPCR法进行方法一致性分析,采用Kappa值检验。Kappa值=1为两结果完全一致,Kappa值≥0.75为一致性极好,在0.40~0.75间为高度一致(不包含0.40和0.75),Kappa值≤0.40为一致性差。
2 结果 2.1 引物设计根据微生物数据分析云平台筛选得到特异基因序列,设计多重PCR反应体系引物组,见表 1。
通过对反应条件与体系优化,确定最优多重PCR反应体系:混合引物MF、MR各1 μl(1 μmol/L),GF和GR各1 μl(10 μmol/L),2× Master Mix 12.5 μl,模板3 μl,ddH2O 5.5 μl。反应条件:95 ℃预变性5 min;95 ℃变性30 s,58 ℃退火90 s,72 ℃延伸60 s,10个循环;95 ℃变性30 s,69.5 ℃退火90 s,72 ℃延伸60 s,10个循环;95 ℃变性30 s,45.5 ℃退火90 s,72 ℃延伸60 s,20个循环;72 ℃延伸10 min(图 2)。其中混合引物MF、MR为7种目标菌的SCPs按比例混合配制,使各引物在体系中的最适终浓度Ap和Ft为30 nmol/L,Rt为40 nmol/L,Ot、Lep和Cb均为50 nmol/L,Bar为60 nmol/L。
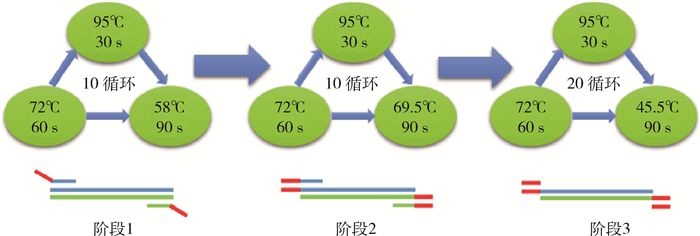
|
| 图 2 温度转换PCR扩增流程 Figure 2 Amplification process of temperature-switch PCR |
| |
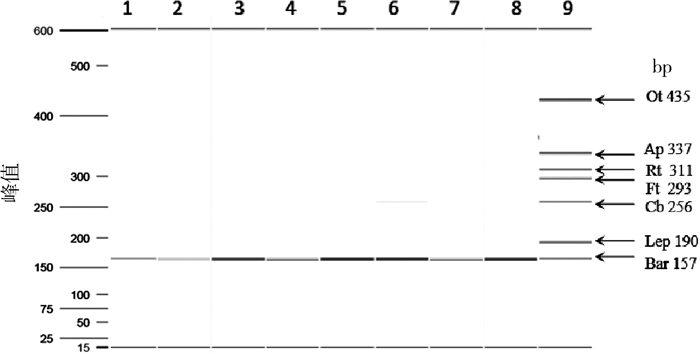
以阳性菌株核酸为模板进行mPCR,QIAxcel毛细管电泳检测产物显示每个反应均只出现单一特异性条带,无交叉反应(图 3)。其中巴尔通体属可检出8种常见巴尔通体(图 4)。经毛细管电泳多次检测,目的条带大小:Bar为155~161 bp,Lep为185~191 bp,Cb为251~257 bp,Ft为287~293 bp,Rt为305~311 bp,Ap为331~337 bp,Ot为429~435 bp。非特异性核酸均未扩增出目的条带。

|
| 注: 1~7.分别为Ot、Ap、Lep、Cb、Ft、Bar和Rt病原体核酸;8.混合质粒标准品阳性对照;Ot.恙虫病东方体;Ap.嗜吞噬细胞无形体;Rt.莫氏立克次体;Ft.土拉弗朗西斯菌;Cb.贝氏柯克斯体;Lep.问号钩端螺旋体;Bar.巴尔通体 图 3 引物特异性检测的毛细管电泳结果 Figure 3 Capillary electropherogram of primer specificity test |
| |
|
| 注:1~8.分别为Bc、Bd、Be、Bg、Bh、Bk、Bq和Bt;9.混合质粒标准品阳性对照;Ot.恙虫病东方体;Ap.嗜吞噬细胞无形体;Rt.莫氏立克次体;Ft.土拉弗朗西斯菌;Cb.贝氏柯克斯体;Lep.问号钩端螺旋体;Bar.巴尔通体 图 4 巴尔通体引物特异性检测的毛细管电泳结果 Figure 4 Capillary electropherogram for the specificity test of the Bar primers |
| |
多引物单模板灵敏度检测限显示,琼脂糖凝胶电泳显示检测限分别为1.1×102拷贝/μl(Cb)、1.5×102拷贝/μl(Rt)、7.6×101拷贝/μl(Ap)、1.7×102拷贝/μl(Ot)、1.8×102拷贝/μl(Ft)、1.7×102拷贝/μl(Lep)和1.6×102拷贝/μl(Bar),检测限均在76~180拷贝/μl范围内;QIAxcel毛细管电泳检测限分别为Ap检测限不变,其余病原体检测限的质粒拷贝数浓度均降低10倍,均在11~76拷贝/μl范围内(图 5)。
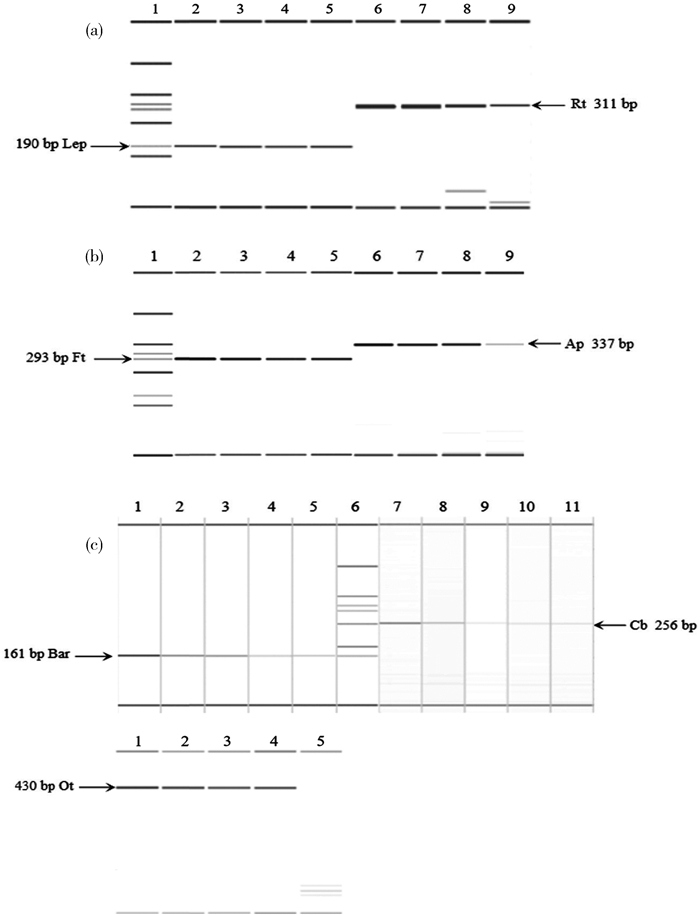
|
| 注:(a)1.混合质粒标准品阳性对照;2~5. Lep模板浓度按10倍比稀释(下同)依次为1.7×104~1.7×101拷贝/μl;6~9. Rt模板浓度依次为1.5×104~1.5×101拷贝/μl。(b)1.混合质粒标准品阳性对照;2~5. Ft模板浓度依次为1.8×104~1.8×101拷贝/μl;6~9. Ap模板浓度依次为7.6×104~7.6×101拷贝/μl。(c)1~5. Bar模板浓度依次为1.6×105~1.6×101拷贝/μl;6.混合质粒标准品阳性对照;7~11. Cb模板浓度依次为1.1×105~1.1×101拷贝/μl。(d)1~5. Ot模板浓度依次为1.7×104~1.7×100拷贝/μl;Ot.恙虫病东方体;Rt.莫氏立克次体;Ap.嗜吞噬细胞无形体;Ft.土拉弗朗西斯菌;Cb.贝氏柯克斯体;Lep.问号钩端螺旋体;Bar.巴尔通体 图 5 基于QIAxcel系统多引物单模板灵敏度检测结果 Figure 5 Sensitivity of multi-primer single template based on the QIAxcel system |
| |
多引物多模板灵敏度检测限显示,琼脂糖凝胶电泳检测限为2×102拷贝/μl,可检测6种病原体(由于Rt和Ft目的条带大小相近,无法区分);QIAxcel毛细管电泳检测限在2×101拷贝/μl可检测到5种病原体(Rt、Ft、Cb、Lep和Bar),在2×102拷贝/μl可检测到7种病原体(图 6)。经多次重复检测,实验结果保持一致。

|
| 注:1~5.混合质粒模板浓度依次为2×105~2×101拷贝/μl;6.空白对照;Ot.恙虫病东方体;Ap.嗜吞噬细胞无形体;Rt.莫氏立克次体;Ft.土拉弗朗西斯菌;Cb.贝氏柯克斯体;Lep.问号钩端螺旋体;Bar.巴尔通体 图 6 基于QIAxcel系统多引物多模板灵敏度检测结果 Figure 6 Sensitivity of multi-primer multiple templates based on the QIAxcel system |
| |
采集北京市86只野外小型兽类,包括大林姬鼠(Apodemus peninsulae)3只(3.49%),褐家鼠(Rattus norvegicus)18只(20.93%),鼩鼱(Soricidae)1只(1.16%),北社鼠(Niviventer confucianus)35只(40.70%),小家鼠(Mus musculus)29只(33.72%)。用mPCR法、qPCR法和常规PCR法对野外鼠脾样品检测,由表 2可见,共22份阳性样品,均为单病原体感染。mPCR法检出阳性21份(24.42%),其中18份为Bar感染,2份为Lep感染,1份为Ap感染;qPCR法检出阳性21份(24.42%),其中18份为Bar感染,3份为Lep感染;常规PCR法检出阳性6份(6.98%),其中5份为Bar感染,1份为Lep感染。
对mPCR法和qPCR法进行Kappa值一致性检验(表 3)。对于Bar检测,Kappa值为1.00,2种方法检测结果完全一致;对于Lep检测,Kappa值为0.79,2种方法检测结果一致性极好;对于Ap检测,mPCR法检测到1份阳性样品,qPCR法和常规PCR法未检测到阳性样品。
鼠形动物是许多病原体的自然宿主和传播媒介,可引起多种人兽共患病暴发流行,成为公共卫生安全巨大挑战和隐患。早在20世纪50年代,我国就建立了鼠传疾病的单病原体监测系统,对相关鼠传疾病进行系统的监测和早期预警。随着病原体变种日趋增加,监测任务日益加重,单病原体检测不仅费时费力,更不利于监测数据进行综合有效的分析。因此,急需多重病原体检测方法为鼠传疾病综合监测和预防提供技术支持。
本研究反应特异性良好,多引物单模板灵敏度检测限在11~76拷贝/μl范围内,多引物多模板在20~200拷贝/μl范围内,均比同等条件下琼脂糖凝胶电泳检测灵敏度提高10倍。相比单模板灵敏度检测,Ot和Ap多模板灵敏度检测限下降,原因可能是多模板检测时多组引物间存在相互抑制与竞争。与同类研究结果相比,Tokarz等[17]利用多重qPCR法同时检测5种鼠传病原体,检测灵敏度可达10拷贝/反应。Melničáková等[18]将DNA微阵列与PCR技术结合同时检测贝氏柯克斯体、立克次体和土拉弗朗西斯菌3种鼠传病原体,检测极限可达1拷贝/μl。王旺等[19]运用xMAP悬浮芯片在单管中同时检测9种鼠传病原体,检测灵敏度高达0.03 pg/反应,所以mPCR法和多重qPCR法检测灵敏度相当,略低于芯片类高通量检测灵敏度。但由于多重qPCR法受检病原体数有限,基因芯片法费用昂贵,且操作专业性强,难以推广使用。
通过对野外鼠脾样品检测显示,mPCR法和qPCR法检测能力相当,优于常规PCR法,与之前研究结果一致[20]。且mPCR法和qPCR法检测Bar的能力完全一致;检测Lep时2种方法检测能力一致性高,但多重PCR法漏检1份Lep阳性样品,差异无统计学意义;在检测Ap时只有mPCR法检测到1份阳性,其他2种方法均未检测到,由于mPCR法检测灵敏度高,暂定认为该样品为真阳性。86份待检样品共检出阳性22份,均为单病原体感染。其中,Bar感染率较高,提示该地区存在潜在的Bar感染风险,要引起适当关注,同时也提示本次所采集的主要鼠种北社鼠和小家鼠可能为巴尔通体的重要宿主[21]。
通过样品检测体现了mPCR法的检测优势:①灵敏度高,与单重qPCR法相当,优于常规PCR法;②检测速度快,以单次检测96份样品为例,平均每份样品只需约3 min;③操作简便,使用预制胶卡,自动上样;④通量高,可同时检测7种病原体。该方法可实现在单管中灵敏、特异、快速自动化地检测7种鼠传病原体,为我国鼠传疾病的实验室检测和多病原体综合监测提供了技术支持。除此外,本研究尚存在一些不足,如3~5 bp的高分辨率需要限制扩增片段长度在500 bp以内,这是该方法本身的技术限制;目前对该方法检测能力的评估只研究了3种病原体,还需要通过对大量样品的检测进一步评估和完善。
| [1] |
余向华, 张孝和, 倪庆翔, 等. 鼠传疾病流行病学研究进展[J]. 中国媒介生物学及控制杂志, 2015, 26(6): 634-636. DOI:10.11853/j.issn.1003.4692.2015.06.026 |
| [2] |
Bordes F, Blasdell K, Morand S. Transmission ecology of rodent-borne diseases:new frontiers[J]. Integr Zool, 2015, 10(5): 424-435. DOI:10.1111/1749-4877.12149 |
| [3] |
Liu QY, Xu WB, Lu S, et al. Landscape of emerging and re-emerging infectious diseases in China:impact of ecology, climate, and behavior[J]. Front Med, 2018, 12(1): 3-22. DOI:10.1007/s11684-017-0605-9 |
| [4] |
Tabone T, Mather DE, Hayden MJ. Temperature switch PCR (TSP):robust assay design for reliable amplification and genotyping of SNPs[J]. BMC Genomics, 2009, 10: 580. DOI:10.1186/1471-2164-10-580 |
| [5] |
Fulop M, Leslie D, Titball R. A rapid, highly sensitive method for the detection of Francisella tularensis in clinical samples using the polymerase chain reaction[J]. Am J Trop Med Hyg, 1996, 54(4): 364-366. DOI:10.4269/ajtmh.1996.54.364 |
| [6] |
史永林, 王誓闻, 胡万富, 等. 安徽地区家畜嗜吞噬细胞无形体16S rRNA基因检测和序列分析[J]. 安徽预防医学杂志, 2013, 19(5): 329-330, 338. |
| [7] |
Brenner DJ, O'Connor SP, Winkler HH, et al. Proposals to unify the genera Bartonella and Rochalimaea, with descriptions of Bartonella quintana comb. nov., Bartonella vinsonii comb. nov., Bartonella henselae comb. nov., and Bartonella elizabethae comb. nov., and to remove the family Bartonellaceae from the order Rickettsiales[J]. Int J Syst Bacteriol, 1993, 43(4): 777-786. DOI:10.1099/00207713-43-4-777 |
| [8] |
中国疾病预防控制中心.恙虫病预防控制技术指南[Z].北京: 中疾控疾发[2009] 1号, 2009.
|
| [9] |
徐建国, 阚飙, 张建中, 等. 现场细菌学[M]. 北京: 科学出版社, 2011: 556-627.
|
| [10] |
Diaz MH, Bai Y, Malania L, et al. Development of a novel genus-specific real-time PCR assay for detection and differentiation of Bartonella species and genotypes[J]. J Clin Microbiol, 2012, 50(5): 1645-1649. DOI:10.1128/JCM.06621-11 |
| [11] |
付秀萍, 贺金荣, 张景山, 等. TaqMan-MGB探针实时荧光定量PCR检测恙虫病东方体方法的建立[J]. 中国媒介生物学及控制杂志, 2012, 23(2): 108-110. |
| [12] |
杨晓, 陈梅玲, 温博海, 等. 实时荧光定量PCR检测莫氏立克次体[J]. 解放军医学杂志, 2007, 32(10): 1054-1056. DOI:10.3321/j.issn:0577-7402.2007.10.016 |
| [13] |
张晶波, 温博海, 陈梅玲, 等. 荧光定量PCR检测嗜吞噬细胞无形体[J]. 中国人兽共患病学报, 2006, 22(4): 289-293. DOI:10.3969/j.issn.1002-2694.2006.04.001 |
| [14] |
史清海, 曲识, 周冬生, 等. 应用TaqMan荧光定量PCR检测土拉弗朗西斯菌[J]. 生物技术通讯, 2009, 20(6): 806-809. |
| [15] |
张翠彩, 李秀文, 聂一新, 等. 致病性钩端螺旋体TaqMan Real-time PCR检测技术的建立及其应用[J]. 中华流行病学杂志, 2011, 32(10): 1018-1021. DOI:10.3760/cma.j.issn.0254-6450.2011.10.015 |
| [16] |
亚红祥, 赫兢, 张丽娟, 等. 贝氏柯克斯体实时荧光定量PCR方法的建立及对云南鼠标本检测[J]. 传染病信息, 2009, 22(6): 345-347, 350. DOI:10.3969/j.issn.1007-8134.2009.06.007 |
| [17] |
Tokarz R, Tagliafierro T, Cucura DM, et al. Detection of Anaplasma phagocytophilum, Babesia microti, Borrelia burgdorferi, Borrelia miyamotoi, and Powassan virus in ticks by a multiplex real-time reverse transcription-PCR assay[J]. mSphere, 2017, 2(2): e00151-17. DOI:10.1128/mSphere.00151-17 |
| [18] |
Melničáková J, Derdáková M, Barák I. A system to simultaneously detect tick-borne pathogens based on the variability of the 16S ribosomal genes[J]. Parasit Vectors, 2013, 6: 269. DOI:10.1186/1756-3305-6-269 |
| [19] |
王旺, 杨宇, 王静, 等. 9种蜱媒病原体xMAP悬浮芯片高通量检测方法的建立[J]. 中国媒介生物学及控制杂志, 2013, 24(5): 397-401. DOI:10.11853/j.issn.1003.4692.2013.05.005 |
| [20] |
李瑾.基于两种毛细管电泳系统检测呼吸道病毒的多重PCR技术的建立及应用[D].北京: 中国疾病预防控制中心, 2012. http://cdmd.cnki.com.cn/Article/CDMD-84501-1016011193.htm
|
| [21] |
李龙建, 曹殿起, 刘英, 等. 北京市门头沟区小型兽类群落构成及鼠疫监测[J]. 中国媒介生物学及控制杂志, 2013, 24(3): 267-269. |
 2019, Vol. 30
2019, Vol. 30





