扩展功能
文章信息
- 邱杰, 胡春明, 杜文婷, 余朝举, 童剑飞, 刘阳, 张韶华
- QIU Jie, HU Chun-ming, DU Wen-ting, YU Chao-ju, TONG Jian-fei, LIU Yang, ZHANG Shao-hua
- 白纹伊蚊蛹期X射线辐照不育技术的初步实验研究
- A preliminary experimental study of X-ray-induced sterility in Aedes albopictus pupae
- 中国媒介生物学及控制杂志, 2019, 30(4): 422-426
- Chin J Vector Biol & Control, 2019, 30(4): 422-426
- 10.11853/j.issn.1003.8280.2019.04.015
-
文章历史
- 收稿日期: 2019-02-25
- 网络出版时间: 2019-6-4 8:33
2 中国科学院高能物理研究所, 北京 100049;
3 中国科学院大学, 北京 100049;
4 深圳市疾病预防控制中心, 广东 深圳 518055
2 Institute of High Energy Physics, Chinese Academy of Science;
3 University of Chinese Academy of Science;
4 Shenzhen Center for Disease Control and Prevention
白纹伊蚊(Aedes albopictus)广泛分布于全球70多个国家[1],可传播登革热、基孔肯雅热和寨卡病毒病等多种疾病,潜在健康危害极大[2]。最近一项研究预测全球每年约有3.9亿例登革热感染[3]。2014年,我国南方地区就曾暴发由白纹伊蚊传播的登革热,特别是广东省,病例数达到4万多例[4]。2016年美洲地区也曾暴发寨卡病毒感染[5]。控制传播媒介是抑制蚊媒疾病的主要途径,传统方法主要是利用化学杀虫剂对蚊虫进行消杀,存在着蚊虫抗药性不断增强、对非靶标昆虫伤害大、药物残留对环境及人类有严重的潜在危害等问题[6]。
昆虫不育技术(sterile insect technique,SIT)是应用物理的、化学的或生物的遗传技术,处理害虫的雄虫,使其失去繁衍后代能力,以防治害虫的技术方法[7]。SIT具有物种特异、环境友好和大面积控制等优点[8]。该技术已经在多个国家和地区成功用于控制目标昆虫的野生种群数量,如危地马拉的地中海实蝇(Ceratitis capitata)[9],布基纳法索的采采蝇(Glossina)[10]和意大利的白纹伊蚊种群控制等[11]。但该技术也存在射线辐射会降低昆虫寿命及竞争交配能力等问题[12-13],在实际应用中,还需要通过系列实验确定最佳不育效果与辐射剂量之间的关系[14-16]。γ射线是SIT中最常用的辐射源[17-18],但随着大多数国家对放射性物质的管理越来越严格,γ源的获取也变得越来越困难。相比之下,X射线设备更容易获得,操作简单,且安全性更高,也能够满足昆虫辐照不育技术的要求。因此,近年来在昆虫辐射不育领域,X射线源已有逐渐取代γ射线源的趋势[18]。近10年来,已有许多关于γ射线与白纹伊蚊的研究报道[12, 16, 19-21],包括实验室研究及野外应用,但涉及到X射线与白纹伊蚊的研究则相对较少[13]。
本研究利用X射线生物辐照装置,对处于不同发育阶段的白纹伊蚊蛹,开展了不同辐射剂量值的系列辐照实验。根据实验数据的统计分析结果,评价了X射线辐射剂量与蛹期蚊虫羽化率、存活率、不育强度以及雄性交配竞争力等因素之间的关系,最终得到蚊蛹的最佳辐射时机及辐射剂量,为应用SIT在我国南方地区控制白纹伊蚊种群数量及降低登革热等蚊媒疾病的传播流行提供基础科学依据。
1 材料与方法 1.1 实验材料与仪器实验中使用的白纹伊蚊广州野生株,由中山大学-密歇根州立大学热带病虫媒控制联合研究中心提供。牛肝粉(NEW®,美国)、葡萄糖(东盛生物公司,国产)、塑料幼虫饲养盘(40 cm×30 cm×10 cm)、不锈钢成蚊饲养笼(30 cm× 30 cm× 30 cm)、产卵滤纸、离心管(50 ml)、人工自制吸蚊器、解剖镜、X射线仪(RS2000,美国)、X射线剂量率测定仪(10×6-0.18,Radcal®,美国)等。
1.2 饲养方法将刚孵化的幼蚊约1 500条,转到盛有1 L清水的幼虫饲养盘中,每天饲以6%的牛肝粉。幼虫成蛹后转到成蚊饲养笼中羽化,羽化后的成蚊饲以10%葡萄糖水溶液,并在羽化后的5~7 d喂食鼠血。48 h后,往笼中放入湿润的产卵滤纸收集蚊卵48~72 h。取出带有蚊卵的滤纸,室温下干燥24 h。记录产卵日期,然后将产卵纸避光、室温储存。蚊虫饲养条件为温度(27±1)℃,相对湿度(80±10)%,光照周期(L : D)=12 h : 12 h。实验中伊蚊及其蛹的培育繁殖等过程,均在深圳市疾病预防控制中心技术指导下完成。
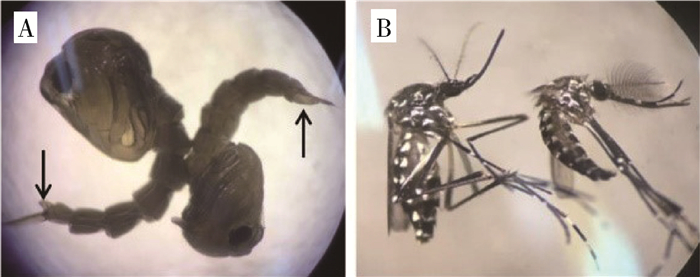
1.3 X射线辐照方法先用X射线剂量率仪测得X射线仪腔室底部中心的剂量率约为1.24 Gy/min。射线经过0.3 mm铜滤波片,照射腔室底部中心培养皿中的蚊蛹。腔室内置的反射罩可以提高辐射剂量率和辐射均匀度。所有实验均先通过人工识别和分离雌雄蛹(雌蛹的尾器比雄蛹短,见图 1A),再对雌雄蛹进行辐照。蚊蛹孵化的雄蚊和雌蚊,见图 1B。
|
| 注:A. 解剖镜下的雌蛹(左)和雄蛹(右),箭头指示处为尾器;B. 解剖镜下的雌蚊(左)和雄蚊(右) 图 1 白纹伊蚊雌蛹和雄蛹的分离 Figure 1 Separation of male and female Aedes albopictus pupae |
| |
收集不同发育阶段的雄蛹(或雌蛹)(< 12、12~36和36~48 h)各30只,分别进行不同剂量(0、20、40和60 Gy)的辐射。蚊蛹在笼中羽化48 h,记录无法正常羽化的蚊蛹数,计算羽化率。再放入相同数量的无辐射、未经交配的雌蚊(或雄蚊)交配5 d,然后喂血。雌蚊吸饱血后单独在产卵管中产卵72 h,蚊卵室温干燥24 h后室温孵化7 d,记录雌蚊的产卵量和卵孵化率,每组实验重复3次。
1.5 蛹期辐射对成蚊寿命的影响基于上述实验结果,收集发育时间为12~36 h的雄蛹(或雌蛹)30~50只,按照不同剂量(0、40和60 Gy)进行辐射。羽化后,成蚊饲以10%的葡萄糖水溶液。羽化后48 h作为第1天,记录成蚊每天的死亡数直到全部死亡,每组实验重复3次。
1.6 蛹期辐射对雄蚊交配竞争力的影响基于上述实验结果,收集发育时间为12~36 h的雄蛹,40 Gy的剂量辐射并经72 h羽化。分别取0、30、90、150、210和30只辐射后雄蚊(也称不育雄蚊)放入饲养笼中,再分别加入无辐射雄蚊(可育雄蚊)30、30、30、30、30和0只。雄蚊混匀24 h后再分别加入30只无辐射、未经交配的雌蚊(1~2 d)竞争交配72 h。雌蚊喂血48 h后再产卵72 h,收集蚊卵并孵化。测定不同交配组合的蚊卵孵化率,计算不同竞争比例的平均诱导不育率[13],并按Fried[22]的方法计算不育雄蚊的竞争交配指数。计算公式:
诱导不育率=〔(1-不育对照组孵化率)-
(竞争组孵化率)/(可育对照组孵化率)〕×100%[13]
雄性竞争交配指数=〔(可育对照组孵化率-
竞争组孵化率)/(竞争组孵化率-
不育对照组孵化率)〕×(可育雄蚊数量/不育雄蚊数量)[22]
1.7 统计学处理蚊蛹羽化率、成蚊存活率、蚊卵孵化率和诱导不育率在数据分析之前要先经反正弦(arcsin)转化[23]。采用单因素方差分析和多重比较(Tukey hoc-post test)分析辐射对蚊蛹羽化率、成蚊存活率、蚊卵孵化率、诱导不育率和雄性竞争交配指数的影响[23]。采用Kaplan-Meier存活曲线表征辐射对成蚊寿命的影响[23]。P < 0.05为差异有统计学意义。
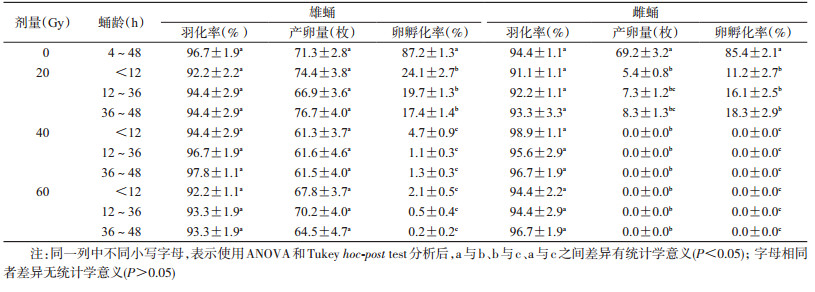
2 结果 2.1 蛹期辐射后白纹伊蚊的羽化率、产卵量和卵孵化率不同剂量和蛹龄的辐射对雄蛹和雌蛹的羽化率影响均较小(雄蛹:F(9,20)=0.644,P=0.747;雌蛹:F(9,20)=1.010,P=0.464),见表 1。不育雄蚊与正常雌蚊交配,对雌蚊的产卵量影响很小(F(9,356)= 1.911,P=0.049),但是卵的孵化率会随着辐射剂量的升高而明显降低(F(9,356)=454.200,P < 0.05),这意味着不育雄蚊诱导的不育强度不断上升。在40和60 Gy剂量下,不育雄蚊与正常雌蚊所产卵的孵化率相差不大,表明2个剂量诱导的不育强度差异无统计学意义。经蛹期辐射后的雌蚊产卵量和卵孵化率均会明显降低(产卵量:F(9,306)=279.500,P < 0.05;卵孵化率:F(9,306)=266.700,P < 0.05),并且降低的程度与辐射的剂量呈正相关性。例如,以产卵量进行计算,正常的雌蚊(无辐射)平均产卵量为69.2枚,经过20 Gy辐射,产卵量下降了90.0%;而经过40 Gy或者60 Gy辐射,下降幅度已超过99.9%,雌蚊几乎不产卵。
|
不同发育阶段的蚊蛹对辐射敏感性不同,但在本实验的数据统计中差异无统计学意义。发育较成熟的雄蛹辐射所诱导的不育强度略高于年轻的雄蛹,而雌蛹则相反。在40和60 Gy辐射下,当雄蛹蛹龄 > 12 h时,不育雄蚊与正常雌蚊交配所产卵的平均孵化率 < 1.3%,而雌蛹在这2个剂量照射下,不论蛹龄大小,雌蚊均完全不育(产卵量或者卵孵化率为0)。
2.2 蛹期辐射后的成蚊寿命实验结果表明,蛹期辐照会降低由辐射蛹培育出的成蚊寿命,差异有统计学意义〔雄蚊(χ2=53.620,df=2,P < 0.05),雌蚊(χ2=189.400,df=2,P < 0.05)〕(图 2A、B)。蚊蛹接受的辐射剂量越大,寿命降低的幅度也越大。辐射蛹培育出的雄性成蚊平均寿命0 Gy为21 d,40 Gy为23 d,60 Gy为15 d。辐射蛹培育出的雌性成蚊平均寿命则0 Gy为38 d,40 Gy为29 d,60 Gy为21 d。另外从图 2A中还可以看到,雄蛹在接受40 Gy辐照后,其培育出的雄性伊蚊成虫前24 d的成活率反而略有提高。

|
| 图 2 白纹伊蚊蛹期辐射后成蚊的Kaplan-Meier存活曲线 Figure 2 The Kaplan-Meier survival curve of adult Aedes albopictus mosquitoes after pupae irradiation |
| |
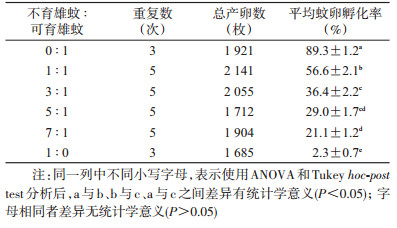
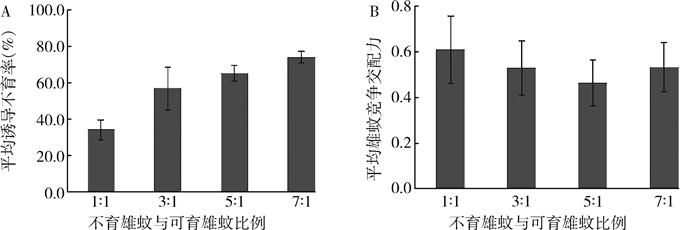
60和40 Gy雄蛹辐射所诱导的不育强度相近,但60 Gy下雄性成蚊寿命大幅降低。因此,我们选择40 Gy作为进一步研究的辐射剂量,以评价该剂量对辐射蛹培育出雄蚊的交配竞争力的影响。由表 2可以看出,不育雄蚊与正常雌蚊交配后,雌蚊卵的平均孵化率随着释放比例的增加而下降,差异有统计学意义(F(5,20)=242.600,P < 0.05)。即平均诱导不育率随释放比例增加而明显增加,差异有统计学意义(F(3,16)=64.900,P < 0.05),见图 3A。表明释放比例越高,蚊虫压制效果越好。在释放比例为7 : 1时,不育雄蚊诱导的不育率为74.1%。
|
|
| 注:A. 不同释放比例所诱导的平均不育率;B. 不同释放比例下平均雄蚊竞争交配指数 图 3 辐射对白纹伊蚊雄蚊竞争交配力的影响 Figure 3 Influence of irradiation on male mating competitiveness of Aedes albopictus |
| |
辐射雄蚊的释放比例并不影响雄性竞争交配指数(F(3,16)=1.274,P=0.317),见图 3B。但蛹期辐射会降低雄蚊的竞争交配能力,不育雄蚊的平均交配竞争指数为(0.5±0.0),即1.8~1.9只不育雄蚊才能与1只野生雄蚊具有相当的竞争交配力。
3 讨论 3.1 蛹期辐射蚊蛹的羽化率在蛹期辐射对蚊蛹羽化率的影响,不超过60 Gy的X射线辐射剂量和蛹龄均不是关键性影响因素。实验统计数据显示,辐射蚊蛹不论雌雄,均能够正常羽化,这一点恰好有利于辐射不育蚊的培育。
3.2 意外释放雌蚊的影响昆虫不育技术的雌雄分离系统在大量释放不育雄蚊的过程中难免会混入少量的雌蚊。而实验结果表明,辐射蛹羽化的雌蚊产卵量和孵化率均会显著降低,X射线剂量在≥40 Gy时,辐射蛹培育出的雌蚊几乎不产卵,这能够消除意外释放雌蚊带来的不利影响。
3.3 蛹期辐射诱导的不育强度辐射蛹羽化的雄蚊与正常雌蚊交配后,不会影响正常雌蚊的产卵量,但正常雌蚊的卵孵化率会随着辐射剂量的升高而显著降低。当X射线剂量在≥40 Gy时,正常雌蚊的卵平均孵化率 < 1.3%,由此得到的X射线辐射诱导不育强度在97.0%左右,略低于之前报道的白纹伊蚊雄蛹在接受40 Gy的辐射后,可以诱导超过99.0%的不育强度[13]。造成结果不同的原因是由于本实验是基于不同蛹龄辐射计算出来的平均结果,发育程度较低的蚊蛹会降低平均不育强度,而报道则是控制蚊蛹发育阶段在24~36 h。
3.4 蛹期辐射导致成蚊寿命降低雌雄蚊蛹接受的辐射剂量越大,辐射蛹培育的成蚊平均寿命降低幅度越大。这是因为射线除了造成白纹伊蚊生殖细胞的破坏而诱导不育,同样也损伤了体组织细胞,主要表现为降低昆虫的寿命和雄性交配竞争力[11, 14-15]。当辐照剂量达到40 Gy后,继续增加辐照剂量不但不会显著增加不育强度,反而会降低成蚊的寿命,不利于辐射不育雄蚊的竞争交配。有趣的是,雄蛹在接受40 Gy的辐照后,培育出的雄蚊前期成活率还略有提高。
3.5 蛹期辐射降低雄蚊的交配竞争力交配竞争力是昆虫不育技术中的一个重要参数指标,不育雄蚊必须有足够的交配竞争力,才能与野生雄蚊竞争交配雌蚊,从而诱导不育。本研究结果表明,蛹期辐射会降低雄蚊的交配竞争力。经40 Gy蛹期辐射后的雄蚊平均交配竞争指数为0.5±0.0,释放比例对雄性竞争交配指数无影响。但辐射蛹培育的雄蚊平均诱导不育率却随着释放比例增加而增加,在释放比例为7 : 1时,诱导不育率为74.1%。雄蚊平均交配竞争指数较低,所以在实际应用时要根据当地实际野生雄蚊密度,提高释放不育雄蚊数量,使得不育雄蚊释放密度要接近野生雄蚊密度的2倍,才能达到理想的蚊虫压制效果。
综上所述,利用培育的白纹伊蚊开展蛹期X射线诱导不育实验研究,得到了40 Gy的X射线剂量是白纹伊蚊蛹期辐射诱导不育的最佳剂量,可以获得雄蚊接近97.0%的不育强度,雌蚊则几乎完全不育。虽然X射线辐射会降低不育雄蚊的寿命及其竞争交配力,但通过提高释放比例及释放频率等技术措施也能获得较高的诱导不育率。因此,将X射线诱导不育技术用于白纹伊蚊蚊媒疾病的防控,在技术上是可行的。具体的技术细节和野外环境投放效果还有待进一步研究,以便更准确地评价该技术的实际应用效果。
| [1] |
杨舒然, 刘起勇. 白纹伊蚊的全球分布及扩散趋势[J]. 中国媒介生物学及控制杂志, 2013, 24(1): 1-4. |
| [2] |
Weaver SC, Charlier C, Vasilakis N, et al. Zika, Chikungunya, and other emerging vector-borne viral diseases[J]. Annu Rev Med, 2018, 69: 395-408. DOI:10.1146/annurev-med-050715-105122 |
| [3] |
Bhatt S, Gething PW, Brady OJ, et al. The global distribution and burden of dengue[J]. Nature, 2013, 496(7446): 504-507. DOI:10.1038/nature12060 |
| [4] |
龙健灵, 林斌, 张萍, 等. 广东省登革热的流行病学特征分析[J]. 中国医药科学, 2015, 5(11): 183-185. |
| [5] |
Styczynski AR, Malta JMAS, Krow-Lucal ER, et al. Increased rates of Guillain-Barré syndrome associated with Zika virus outbreak in the Salvador metropolitan area, Brazil[J]. PLoS Negl Trop Dis, 2017, 11(8): e0005869. DOI:10.1371/journal.pntd.0005869 |
| [6] |
Bourtzis K, Dobson SL, Χi ZY, et al. Harnessing mosquito-Wolbachia symbiosis for vector and disease control[J]. Acta Trop, 2014, 132(Suppl): S150-163. DOI:10.1016/j.actatropica.2013.11.004 |
| [7] |
Zhang DJ, Lees RS, Xi ZY, et al. Combining the sterile insect technique with Wolbachia-based approaches:Ⅱ-a safer approach to Aedes albopictus population suppression programmes, designed to minimize the consequences of inadvertent female release[J]. PLoS One, 2015, 10(8): e0135194. DOI:10.1371/journal.pone.0135194 |
| [8] |
Dyck VA, Hendrichs J, Robinson AS. Sterile insect technique:principles and practice in area-wide integrated pest management[M]. Dordrecht, The Netherlands: Springer, 2005: 3-39. DOI:10.1007/1-4020-4051-2
|
| [9] |
Rendón P, McInnis D, Lance D, et al. Medfly (Diptera:Tephritidae) genetic sexing:Large-scale field comparison of males-only and bisexual sterile fly releases in Guatemala[J]. J Econ Entomol, 2004, 97(5): 1547-1553. DOI:10.1603/0022-0493-97.5.1547 |
| [10] |
Sow A, Sidibé I, Bengaly Z, et al. Irradiated male tsetse from a 40-year-old colony are still competitive in a Riparian forest in Burkina Faso[J]. PLoS One, 2012, 7(5): e37124. DOI:10.1371/journal.pone.0037124 |
| [11] |
Bellini R, Medici A, Puggioli A, et al. Pilot field trials with Aedes albopictus irradiated sterile males in Italian urban areas[J]. J Med Entomol, 2013, 50(2): 317-325. DOI:10.1603/ME12048 |
| [12] |
Balestrino F, Medici A, Candini G, et al. γ ray dosimetry and mating capacity studies in the laboratory on Aedes albopictus males[J]. J Med Entomol, 2010, 47(4): 581-591. DOI:10.1093/jmedent/47.4.581 |
| [13] |
Yamada H, Parker AG, Oliva CF, et al. Χ-ray-induced sterility in Aedes albopictus (Diptera:Culicidae)and male longevity following irradiation[J]. J Med Entomol, 2014, 51(4): 811-816. DOI:10.1603/ME13223 |
| [14] |
Helinski MEH, Knols BGJ. Mating competitiveness of male Anopheles arabiensis mosquitoes irradiated with a partially or fully sterilizing dose in small and large laboratory cages[J]. J Med Entomol, 2008, 45(4): 698-705. DOI:10.1093/jmedent/45.4.698 |
| [15] |
Maïga H, Damiens D, Niang A, et al. Mating competitiveness of sterile male Anopheles coluzzii in large cages[J]. Malar J, 2014, 13(1): 460. DOI:10.1186/1475-2875-13-460 |
| [16] |
Oliva CF, Jacquet M, Gilles J, et al. The sterile insect technique for controlling populations of Aedes albopictus (Diptera:Culicidae) on Reunion island:Mating vigour of sterilized males[J]. PLoS One, 2012, 7(11): e49414. DOI:10.1371/journal.pone.0049414 |
| [17] |
IAEA. Denial of shipment of radioactive material. NS Update 14[EB/OL]. (2010-03)[2018-08-04]. https://www-pub.iaea.org/MTCD/publications/PDF/Newsletters/NSU-14.pdf.
|
| [18] |
FAO/IAEA. To our readers. Insect and Pest Control Newsletter, No. 81[EB/OL]. (2013-07)[2018-08-04]. http://www-naweb.iaea.org/nafa/ipc/public/newsletters-ipc.html.
|
| [19] |
Oliva CF, Maier MJ, Gilles J, et al. Effects of irradiation, presence of females, and sugar supply on the longevity of sterile males Aedes albopictus (Skuse) under semi-field conditions on Reunion Island[J]. Acta Trop, 2013, 125(3): 287-293. DOI:10.1016/j.actatropica.2012.11.010 |
| [20] |
Oliva CF, Damiens D, Vreysen MJB, et al. Reproductive strategies of Aedes albopictus (Diptera:Culicidae) and implications for the sterile insect technique[J]. PLoS One, 2013, 8(11): e78884. DOI:10.1371/journal.pone.0078884 |
| [21] |
Madakacherry O, Lees RS, Gilles JRL. Aedes albopictus (Skuse) males in laboratory and semi-field cages:release ratios and mating competitiveness[J]. Acta Trop, 2014, 132(Suppl): S124-129. DOI:10.1016/j.actatropica.2013.11.020 |
| [22] |
Fried M. Determination of sterile-insect competitiveness[J]. J Econ Entomol, 1971, 64(4): 869-872. DOI:10.1093/jee/64.4.869 |
| [23] |
Zhang DJ, Zheng XY, Xi ZY, et al. Combining the sterile insect technique with the incompatible insect technique:I-impact of Wolbachia infection on the fitness of triple-and double-infected strains of Aedes albopictus[J]. PLoS One, 2015, 10(4): e0121126. DOI:10.1371/journal.pone.0121126 |
 2019, Vol. 30
2019, Vol. 30


