扩展功能
文章信息
- 黄振东, 万晴, 薛志静, 张瑞玲, 张忠
- HUNAG Zhen-dong, WAN Qing, XUE Zhi-jing, ZHANG Rui-ling, ZHANG Zhong
- 德国小蠊肠道可培养非厌氧细菌的分离、鉴定与产消化酶活性分析
- Isolation and identification of culturable aerobic bacteria from the intestines of Blattella germanica and the activity of digestive enzymes produced by these bacteria
- 中国媒介生物学及控制杂志, 2019, 30(4): 409-413
- Chin J Vector Biol & Control, 2019, 30(4): 409-413
- 10.11853/j.issn.1003.8280.2019.04.012
-
文章历史
- 收稿日期: 2018-12-20
- 网络出版时间: 2019-6-20 19:59
2 山东省新发传染病溯源与防控协同创新中心, 山东 泰安 271016
2 Shandong Collaborative Innovation Center for the Origin and Control of Emerging Infectious Diseases, Taishan Medical University
昆虫肠道内生存着大量的微生物,与宿主互利共生[1]。它们可以为宿主提供必须的营养物质,刺激免疫系统和抵抗外来病原微生物[2-6],且昆虫肠道内的一些微生物可以产生消化酶[7],促进食物的消化吸收,如家蚕体内一些细菌可以产淀粉酶、脂肪酶、蛋白酶及纤维素酶,促进家蚕对食物的消化吸收,提高食物营养的利用[8];但同种昆虫在不同条件下生活其肠道菌群结构及功能不相同[9]。德国小蠊(Blattella germanica)是世界性的居家卫生害虫,也是重要媒介昆虫,通过污染食物传播病原体,引起人类感染疾病[10-11]。此外,德国小蠊还是杂食性昆虫,可取食糖类、淀粉、肉类、奶制品等食物,也可取食腐败的食物、人类的痰液和毛发等,其强大的环境适应能力和食物消化能力,可能与其肠道中的共生细菌有关。有研究表明,在不同饮食条件下其肠道菌群组成结构会发生变化[12],但有关德国小蠊肠道细菌组成及其产消化酶活性的研究未见报道。本研究在对德国小蠊肠道细菌进行分离培养的基础上,研究其肠道细菌的产消化酶活性,为探讨肠道细菌在德国小蠊的广泛生态适应和食物适应中的作用奠定基础。
1 材料与方法 1.1 供试虫源供试德国小蠊来自济南市疾病预防控制中心引进种,于2005年在泰山医学院病媒生物与虫媒病实验室饲养至今,饲养条件为温度(26±1)℃,相对湿度(60±10)%,光照周期(L : D)=12 h : 12 h,提供兔饲料作为食料。
1.2 产消化酶细菌的筛选培养基配制 1.2.1 产淀粉酶细菌在营养琼脂培养基(NA培养基)的基础上加入2 g淀粉作为筛选底物,另加0.005%的台盼蓝作为指示剂后,121 ℃,高压灭菌20 min,在超净台里均匀倒入无菌直径为9 cm培养皿内,厚度约4 mm,冷却凝固后,存放于4 ℃冰箱,备用。
1.2.2 产纤维素酶细菌在NA培养基内加入10 g羧甲基纤维素钠作为筛选底物,0.005%刚果红作为指示剂,121 ℃,高压灭菌20 min,在超净台里均匀倒入无菌直径为9 cm培养皿内,厚度约4 mm,冷却凝固后,存放于4 ℃冰箱,备用。
1.2.3 产蛋白酶细菌首先配制蛋白酶筛选培养基,称取酪蛋白20 g,琼脂18 g,加蒸馏水定容至1 000 ml,用NaOH调节pH值至7.0~7.5后,121 ℃,高压灭菌20 min,在超净台里均匀倒入无菌直径为9 cm培养皿内,厚度约4 mm,冷却凝固后,存放于4 ℃冰箱,备用。
1.2.4 产脂肪酶细菌首先配制脂肪酶筛选培养基,在NA培养基中加入12%橄榄油乳化液、0.005%溴甲酚紫,调节pH值至8.0后,121 ℃,高压灭菌20 min,在超净台里均匀倒入无菌直径为9 cm培养皿内,厚度约4 mm,冷却凝固后,存放于4 ℃冰箱,备用。橄榄油乳化液的配制:橄榄油和0.02 g/ml的聚乙烯醇(PVA)以体积比1 : 3的比例混合,60 Hz震荡混匀5~10 min,得乳化液。
1.3 样品制备取5个不同若虫阶段和1个成虫阶段的德国小蠊,其中成虫阶段分雌虫和雄虫,共7种虫态(图 1),每个阶段各设置3组重复,取样前德国小蠊需要饥饿24 h。取样时,1龄和2龄若虫各取3只为1组,置于无菌离心管内,用75%乙醇溶液浸泡10 min后,用无菌水漂洗3次,去除表面细菌,然后再进行研磨取样;其余各阶段的取样,同上进行体表消毒后,在无菌环境下,解剖取其肠道,置于无菌离心管内,再进行研磨取样。

|
| 图 1 不同取样阶段德国小蠊的形态 Figure 1 Morphology of Blattella germanica at different stages of sampling |
| |
取1.3.1中充分研磨的样品,加入100 μl的无菌水混匀,取50 μl混合液稀释成3个不同浓度(10-2、10-4、10-6),各取50 μl均匀涂布在NA培养基上放入培养箱37 ℃培养24 h。待菌生长后,分离纯化得到单个菌株,去除重复菌株。
1.5 德国小蠊肠道细菌的鉴定参照陈丹等[13]细菌DNA提取及鉴定方法将德国小蠊肠道已分离的单菌落,接种到LB液体培养基后置于37 ℃,110 r/min的摇床中培养12 h。然后采用十六烷基三甲基溴化铵法提取各菌株DNA,用27F/1527R细菌通用引物进行PCR扩增,引物序列27F:GAG TTT GAT CCT GGC TCA G,1527R:AGA AAG GAG GTG ATC CAG CC。阳性PCR产物送青岛华大基因公司进行序列测定。测序结果在美国国立生物技术信息中心(NCBI)网站的GenBank上进行BLAST比对分析,一般认为比对结果相似率 > 99%视为同种,95%~99%为同一属,< 95%为同一科。
1.6 德国小蠊肠道产酶菌的筛选将肠道细菌接种在相应的筛选培养基上,每种细菌在不同的筛选平板上接种于3个不同位置,37 ℃培养48 h,观察培养基上是否出现水解圈,测量并记录水解圈的直径(D)和菌落的直径(d),通过D/d的比值来比较各菌产酶能力的大小。蛋白酶、淀粉酶和纤维素酶阳性会出现透明水解圈,脂肪酶阳性培养基上会出现黄色水解圈。
1.7 统计学处理采用SPSS 20.0软件分别对筛选平板上D/d比值进行比较,经单因素方差分析后,当方差齐时用S-N-K多重比较方法;方差不齐时用Dunnett’s T3进行显著性分析,P < 0.05为差异有统计学意义。
2 结果 2.1 德国小蠊肠道菌分离与鉴定在德国小蠊肠道中共分离到可培养细菌12属20种(表 1)。其中肠球菌属(Enterococcus)4种,芽孢杆菌属(Bacillus)和赖氨酸芽孢杆菌属(Lysinibacillus)各3种,柠檬酸杆菌属(Citrobacter)2种,沙雷菌属(Serratia)、根瘤菌属(Rhizobium)、假单胞菌属(Pseudomonas)、摩根菌属(Morganella)、细杆菌属(Microbacterium)、肠杆菌属(Enterobacillus)、金黄杆菌属(Chryseobacterium)和Ventosimonas属各1种。

|
在德国小蠊肠道分离到的细菌中,筛选出产蛋白酶的细菌7种,占菌株总数的36.84%,分别为铜绿假单胞菌(P. aeruginosa)、粘质沙雷菌(S. marcescens)、解淀粉芽孢杆菌(B. amyloliquefaciens)、氧化微杆菌(M. oxydans)、C. massiliae、B. paramycoides和特基拉芽孢杆菌(B. tequilensis);产淀粉酶的细菌有3种,占菌株总数的15.79%,分别为粘质沙雷菌、解淀粉芽孢杆菌和C. massiliae;未筛选到产纤维素酶和产脂肪酶的细菌。其中,粘质沙雷菌、解淀粉芽孢杆菌和C. massiliae可同时产蛋白酶及淀粉酶(图 2)。

|
| 图 2 德国小蠊产蛋白酶和淀粉酶细菌在选择培养基上形成的透明圈 Figure 2 Transparent circles of bacteria from Blattella germanica which produced protease and amylase on a selective medium |
| |
在德国小蠊肠道细菌中,粘质沙雷菌和C. massiliae的产蛋白酶活性较强,氧化微杆菌、解淀粉芽孢杆菌、B. paramycoides、特基拉芽孢杆菌和铜绿假单胞菌较弱,7种菌的产蛋白酶活性差异有统计学意义(F=8.859,P=0.000),见表 2。
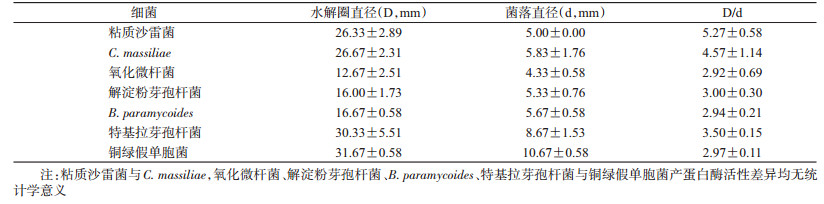
|
在德国小蠊肠道中分离到C. massiliae、解淀粉芽孢杆菌和粘质沙雷菌有产淀粉酶活性,但三者的产淀粉酶活性差异无统计学意义(F=2.920,P=0.130),见表 3。
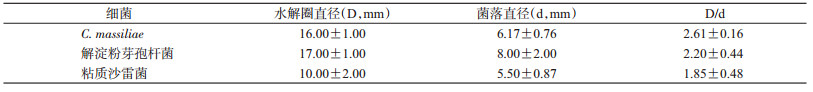
|
昆虫在取食后,其肠道共生的微生物可协助宿主对食物的消化吸收,如大多数植食性昆虫肠道微生物和自身消化系统共同作用,可以把植物中大分子纤维素分解转化为糖类供自身能量需求[14],孙新新等[15]在黄翅大白蚁的后肠中分离筛选出8株细菌,均有降解几丁质酶、内切葡聚糖酶和β-葡萄糖苷酶活性,在白蚁啃食木质纤维素时,可协助其降解消化吸收营养。同时,刘婧等[16]对进食与未进食的家蝇成虫肠道菌的分离鉴定比较,发现两者的肠道菌群在结构和数量上有明显差异,推测食物对昆虫肠道菌群的组成有一定影响。Pérez-Cobas等[12]用不同浓度蛋白饲料饲养德国小蠊,通过16S rRNA测序分析发现,其肠道微生物群的组成在短时间内即受到食物的影响,而组成方面进行重新组合,进一步推测食物可能影响到昆虫肠道微生物的结构组成。
已有研究表明,德国小蠊对食物的喜好顺序为蔗糖 > 奶粉 > 干酪素 > 麦芽糖 > 葡萄糖 > 红糖 > 果糖 > 玉米淀粉 > 炒小麦粉 > 芝麻粉 > 乳糖 > 荞麦粉 > 炒玉米粉 > 鸡精 > 炒黄豆粉[17],说明其对于蛋白类、二糖类和淀粉类食物的喜好程度较高。而本文中饲养的德国小蠊主要喂食兔粮,其中的蛋白成分含量最多(一般 > 15%),筛选到的产蛋白酶细菌种类最多,可能与本实验室长期使用高蛋白的兔粮饲养德国小蠊有关。同时,在德国小蠊肠道中还分离到3种产淀粉酶细菌,虽然兔粮中严格限制淀粉含量,但由于德国小蠊喜食淀粉含量高的食物,在长期进化过程中,这些细菌可能已定植于德国小蠊的肠道内,形成了稳定的共生关系,并继续保持产酶活性。兔粮中的粗脂肪和粗纤维的含量也较高,但这些成分可能直接被德国小蠊的肠道消化酶所分解利用,而无需肠道细菌进行协助。
在分离到的细菌中,粘质沙雷菌、解淀粉芽孢杆菌和C. massiliae可同时产蛋白酶和淀粉酶,且粘质沙雷菌和金黄杆菌的产蛋白酶活性较强,说明二者可能在协助德国小蠊消化蛋白质和淀粉类食物过程中起着更为重要的作用。德国小蠊是一种适应性很强的物种,其个体繁殖快,有护卵行为可能是其中的重要原因,但其肠道细菌在协助其消化食物方面也可能起重要作用,从而协助提高其生态适应性。
| [1] |
Engel P, Moran NA. The gut microbiota of insects-diversity in structure and function[J]. FEMS Microbiol Rev, 2013, 37(5): 699-735. DOI:10.1111/1574-6976.12025 |
| [2] |
Weiss B, Aksoy S. Microbiome influences on insect host vector competence[J]. Trends Parasitol, 2011, 27(11): 514-522. DOI:10.1016/j.pt.2011.05.001 |
| [3] |
Kikuchi Y, Hayatsu M, Hosokawa T, et al. Symbiont-mediated insecticide resistance[J]. Proc Natl Acad Sci USA, 2012, 109(22): 8618-8622. DOI:10.1073/pnas.1200231109 |
| [4] |
Boissière A, Tchioffo MT, Bachar D, et al. Midgut microbiota of the malaria mosquito vector Anopheles gambiae and interactions with Plasmodium falciparum infection[J]. PLoS Pathog, 2012, 8(5): e1002742. DOI:10.1371/journal.ppat.1002742 |
| [5] |
Frago E, Dicke M, Godfray HCJ. Insect symbionts as hidden players in insect-plant interactions[J]. Trends Ecol Evol, 2012, 27(12): 705-711. DOI:10.1016/j.tree.2012.08.013 |
| [6] |
Chu CC, Spencer JL, Curzi MJ, et al. Gut bacteria facilitate adaptation to crop rotation in the western corn rootworm[J]. Proc Natl Acad Sci USA, 2013, 110(29): 11917-11922. DOI:10.1073/pnas.1301886110 |
| [7] |
Watanabe H, Tokuda G. Cellulolytic systems in insects[J]. Annu Rev Entomol, 2010, 55: 609-632. DOI:10.1146/annurev-ento-112408-085319 |
| [8] |
高绘菊, 路国兵, 查传勇, 等. 家蚕肠道产酶菌的分离与筛选[J]. 蚕业科学, 2007, 33(2): 228-233. DOI:10.3969/j.issn.0257-4799.2007.02.011 |
| [9] |
Bing XL, Gerlach J, Loeb G, et al. Nutrient-dependent impact of microbes on Drosophila suzukii development[J]. MBio, 2018, 9(2): e02199-17. DOI:10.1128/mBio.02199-17 |
| [10] |
Gore JC, Schal C. Cockroach allergen biology and mitigation in the indoor environment[J]. Annu Rev Entomol, 2007, 52: 439-463. DOI:10.1146/annurev.ento.52.110405.091313 |
| [11] |
Schal C, Hamilton RL. Integrated suppression of synanthropic cockroaches[J]. Annu Rev Entomol, 1990, 35: 521-551. DOI:10.1146/annurev.en.35.010190.002513 |
| [12] |
Pérez-Cobas AE, Maiques E, Angelova A, et al. Diet shapes the gut microbiota of the omnivorous cockroach Blattella germanica[J]. FEMS Microbiol Ecol, 2015, 91(4): fiv022. DOI:10.1093/femsec/fiv022 |
| [13] |
陈丹, 庄桂芬, 黄振东, 等. 不同养殖场家蝇成虫体表携带细菌的分离与鉴定[J]. 中国人兽共患病学报, 2017, 33(11): 951-955. DOI:10.3969/j.issn.1002-2694.2017.11.001 |
| [14] |
Oppert C, Klingeman WE, Willis JD, et al. Prospecting for cellulolytic activity in insect digestive fluids[J]. Comp Biochem Physiol Part B:Biochem Mol Biol, 2010, 155(2): 145-154. DOI:10.1016/j.cbpb.2009.10.014 |
| [15] |
孙新新, 李净净, 宁娜, 等. 黄翅大白蚁后肠几丁质降解微生物的分离与鉴定[J]. 微生物学通报, 2017, 44(7): 1649-1654. DOI:10.13344/j.microbiol.china.170062 |
| [16] |
刘婧, 陈丹, 庄桂芬, 等. 进食对家蝇成虫肠道共生细菌组成和数量的影响[J]. 中国病原生物学杂志, 2017, 12(3): 238-241. DOI:10.13350/j.cjpb.170310 |
| [17] |
李兴文, 马涛, 王蓬, 等. 德国小蠊和美洲大蠊取食喜好性的实验室观察[J]. 医学动物防制, 2013, 29(4): 400-404. |
 2019, Vol. 30
2019, Vol. 30


