扩展功能
文章信息
- 姚文武, 颜浩, 楼秀玉, 潘军航, 孙逸, 茅海燕, 张严峻
- YAO Wen-wu, YAN Hao, LOU Xiu-yu, PAN Jun-hang, SUN Yi, MAO Hai-yan, ZHANG Yan-jun
- 发热伴血小板减少综合征病毒蛋白Gc原核表达及免疫原性研究
- Prokaryotic expression and immunogenicity of severe fever with thrombocytopenia syndrome virus glycoprotein Gc
- 中国媒介生物学及控制杂志, 2019, 30(4): 383-386
- Chin J Vector Biol & Control, 2019, 30(4): 383-386
- 10.11853/j.issn.1003.8280.2019.04.006
-
文章历史
- 收稿日期: 2019-03-04
- 网络出版时间: 2019-6-20 19:58
发热伴血小板减少综合征(severe fever with thrombocytopenia syndrome,SFTS)是由SFTS病毒(SFTSV)引起的急性蜱媒传染病,该病的主要临床表现为发热、血小板和白细胞减少及多脏器功能损伤等[1]。感染SFTSV后可迅速引起患者肝、肾功能受损,使患者因弥漫性血管内凝血、休克、呼吸衰竭而死亡,病死率可达10%~30%[2]。SFTSV属于布尼亚病毒目(Bunyavirales order)白纤病毒科(family Phenuiviridae)白蛉病毒属(genus Phlebovirus),其基因组由L、M和S 3个单股负链RNA片段组成,其中L片段编码RNA依赖的RNA聚合酶,M片段编码的前体经蛋白酶修饰后形成Gn和Gc包膜蛋白,S片段编码核蛋白(NP)和非结构蛋白(NSs)[3]。目前对SFTSV的流行病学研究和分子生物学诊断技术研究较多,而对其致病机制及病原学特点的研究较少,同时病毒蛋白结构特征及功能需进一步研究[4]。SFTSV包膜蛋白作为病毒主要表面抗原,可能是SFTSV黏附血小板或细胞的关键因素,在病毒感染过程中扮演重要角色。本研究旨在利用大肠埃希菌(Escherichia coli)表达系统实现SFTSV包膜蛋白Gc原核可溶性表达,动物实验验证其免疫原性,为后续SFTSV蛋白结构和功能以及疫苗研究提供基础。
1 材料与方法 1.1 材料BL21(DE3)感受态细胞(北京全式金生物有限公司),限制性内切酶HindIII和BamHI(Thermo,美国),T4 DNA连接酶(Thermo,美国),质粒提取试剂盒(QIAGEN),胶回收试剂盒(QIAGEN),酵母提取物、琼脂粉、蛋白胨、5 ml Histrap Chelating HP亲和层析柱购自GE Healthcare公司,羊抗兔IgG(辣根过氧化物酶HRP标记)抗体(BD公司),pET-His载体(本实验室留存)。
1.2 方法 1.2.1 表达载体构建参照SFTSV HB29病毒株的Gc蛋白编码基因(GenBank:KP202164.1),截取前1 200个碱基(蛋白胞外区碱基)由上海生工生物有限公司合成并插入到载体pET-His中,构建成表达载体pET-His-Gc,同时分别在蛋白Gc的基因序列5′端和3′端引入BamHⅠ和HindⅢ限制性酶切位点,测序确认目的基因的序列准确无误。
1.2.2 蛋白的表达纯化将载体pET-His-Gc加入到BL21(DE3)感受态细胞中,42 ℃热激40 s后快速转移至冰上降温,随后加到500 μl不含任何抗生素LB培养基中,置于37 ℃摇床中培养1 h,收集重组菌涂布于含有氨苄西林钠的LB平板上,37 ℃培养过夜。挑取单克隆菌落进行增菌培养后测序鉴定,鉴定结果无误的单克隆菌液按照1 : 100的比例转接到500 ml液体培养基中,37 ℃培养至A600值为0.6~0.8范围时,加入异丙基硫代半乳糖苷(IPTG)后转移至16 ℃诱导表达。收集诱导表达后的菌体进行超声破碎,离心后取上清液进行AKTA纯化系统纯化,纯化后的蛋白经十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)验证。
1.2.3 Western blot实验纯化后的蛋白经SDS- PAGE电泳分离,转印至硝酸纤维素膜上,3%牛血清白蛋白(BSA)封闭1 h,磷酸盐吐温缓冲液(PBST)清洗3次后,加入anti-His抗体,4 ℃冰箱孵育过夜。次日取出膜清洗后,加入羊抗鼠辣根过氧化物酶标记的IgG抗体(1 : 5 000稀释),37 ℃孵育1 h,漂洗3次后显色。
1.2.4 免疫兔收集血清将纯化鉴定后的蛋白稀释后与等体积弗氏佐剂充分混合,采用3次免疫每次免疫间隔2周的方法,第1次免疫蛋白与完全弗氏佐剂混合,第2次免疫和第3次免疫蛋白与不完全弗氏佐剂混合。免疫动物为4月龄体质量约为2.1 kg的新西兰大白兔,混合后的蛋白进行兔背部皮下多点注射免疫,使最终的免疫剂量为300 μg/只,共计免疫4只。3次免疫1周后心脏采血,离心后取上清液,即Gc蛋白的多克隆抗体。
1.2.5 免疫血清抗体效价测定将纯化后的Gc蛋白用ELISA包被液稀释到10 μg/ml的浓度,以100 μl/孔的量加入到酶联反应孔中,置于4 ℃冰箱中包被过夜。将包被好的酶联板用PBS洗3遍后加入3%的BSA封闭1 h,将倍比稀释好的兔免疫血清加入到酶联反应孔中,37 ℃温箱中孵育1 h,PBST清洗3次后加入辣根过氧化物酶标记的羊抗兔抗体IgG,温箱中孵育1 h,清洗后加入底物和显色液,避光反应10 min后加入H2SO4终止反应,最后在450 nm波长下测定A450。
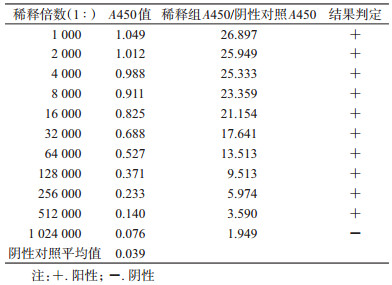
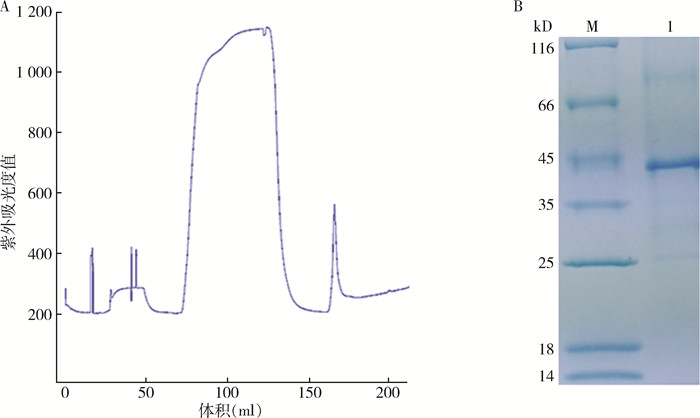
2 结果 2.1 SFTSV Gc蛋白表达纯化结果鉴定通过AKTA纯化系统对大肠埃希菌表达出的Gc蛋白进行纯化,收集AKTA纯化仪上每个紫外吸收峰所对应的蛋白产物,产物通过SDS-PAGE鉴定,结果显示,蛋白的紫外吸收峰图中有单一且较陡峭的峰(图 1A)。SDS-PAGE结果显示在45 kD大小的位置有明显条带,大小和目的蛋白相当(图 1B)。
|
| 注:A.为蛋白纯化时的紫外吸收峰图;B.为SDS-PAGE鉴定结果;M.为蛋白Marker;1.为纯化蛋白 图 1 发热伴血小板减少综合征蛋白纯化鉴定结果 Figure 1 SDS-PAGE assay of purified SFTSV envelope glycoprotein Gc |
| |
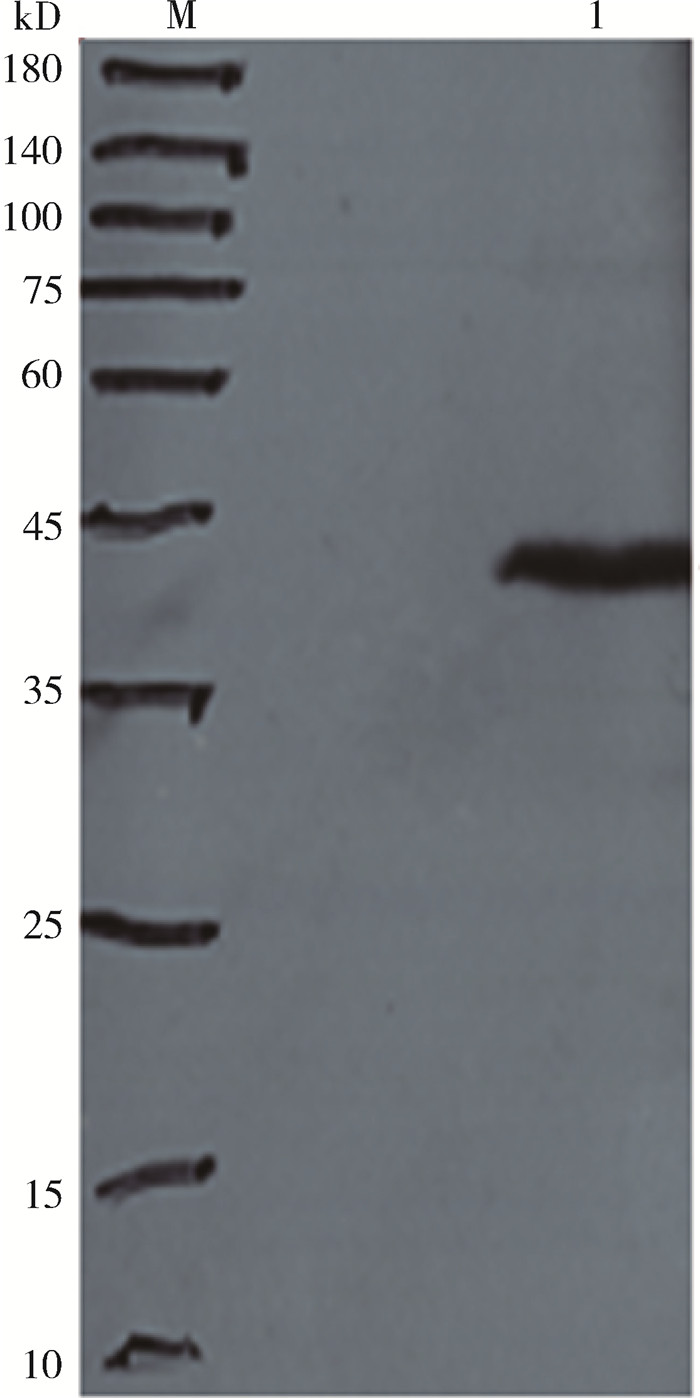
由于重组表达的Gc蛋白加入了6×His组氨酸标签,用anti-His抗体可以特异性结合目的蛋白,Western blot结果显示在45 kD大小的位置显示出条带(图 2)。
|
| 注:M.为蛋白Marker;1.为纯化蛋白 图 2 发热伴血小板减少综合征纯化蛋白的Western blot蛋白印迹结果 Figure 2 The Western blot result of purified SFTSV envelope glycoprotein Gc |
| |
对第3次免疫1周后的动物取血,离心得到的血清进行倍比稀释,采用间接ELISA法测定免疫血清抗体效价。抗体效价的判定标准:当稀释血清的平均A450值>阴性对照平均值×2.1时判定为阳性,反之为阴性。ELISA结果显示,3次免疫新西兰大白兔后,免疫血清的抗体效价可以达到1 : 512 000,说明原核表达得到的Gc蛋白具有较好的免疫原性(表 1)。
SFTSV是引起新发传染病SFTS的病原体,该病起病急、病程长、病死率高。自2009年首次报道以来,相继在中国10多个省份发现和报道,近年来在韩国、日本和美国先后报道了人感染SFTSV病例[5-7]。目前无专门针对SFTSV感染后治疗的特效药物,只能进行对症治疗,治疗和康复的周期较长,严重影响了患者的生活质量。现已证实,布尼亚病毒能诱发产生中和活性抗体,且具有中和活性的单克隆抗体是来自病毒的包膜糖蛋白Gn/Gc[8]。Överby等[9]采用三维结构分析法证实,与SFTSV同属的乌库病毒通过其Gn和Gc包膜蛋白黏附并侵入宿主细胞。SFTSV通过包膜蛋白Gn/Gc与宿主细胞上的受体结合,并通过包膜蛋白Gn/Gc侵入宿主细胞发挥作用,同时通过Gn/Gc诱导机体产生中和抗体,机体产生的中和抗体能够识别Gn/Gc的线性表位阻断SFTSV对宿主细胞的感染能力。
SFTSV包膜蛋白Gn和Gc的研究对于探索SFTSV致病机制以及病毒亚单位疫苗的研究具有重要意义。文献已经报道的包膜蛋白的表达纯化研究中,Gn蛋白的研究较多,而对Gc的研究相对较少。张文帅等[10]将表达Gn和Gc的基因分别分割成3个有重叠的片段进行表达纯化,为进一步深入研究SFTSV包膜蛋白Gn和Gc的结构与功能及精确定位其抗原表位奠定了基础。把基因进行分段表达有利于Gn和Gc蛋白的表达、纯化以及抗原表位的研究,然而分段表达蛋白的构象被破坏,其免疫原性得不到保证且在报道中并未验证分段表达出蛋白的免疫原性。徐菱遥等[11]通过构建SFTSV包膜蛋白Gn的表达载体,运用真核表达系统HEK293T细胞实现了Gn蛋白的表达纯化,免疫小鼠后检测抗体效价,结果显示通过真核表达出的Gn蛋白具有较好的免疫原性,同时证明优化后的质粒更有利于Gn蛋白的表达、分泌以及更好的免疫原性。而报道中并未对Gc蛋白进行研究,所以对于序列优化表达后的Gc蛋白的免疫原性尚未可知。陈蕾等[12]通过SFTSV包膜蛋白Gn免疫新西兰兔和小鼠制备抗体,同时运用双抗体夹心ELISA法成功建立了Gn蛋白的定量检测方法,该方法具有较高的广谱性和特异性,为疫苗生产工艺过程的质量控制奠定了基础。然而本报道中并未同时对Gc蛋白进行类似研究,迫切需要加强研究。
本研究首先通过化学合成的方法合成SFTV包膜蛋白Gc目的基因,通过分子生物学方法成功构建了表达载体pET-His-Gc,经大肠埃希菌原核表达并纯化后,SDS-PAGE和Western blot实验验证,实现了Gc蛋白的高效和可溶性表达。原核表达系统能够高效、简单快速地获得大量目的蛋白,为进一步的蛋白研究提供保障。动物免疫后取血清进行ELISA实验,初步检测Gc蛋白的免疫原性,结果表明化学合成法合成的Gc基因,通过大肠埃希菌表达后能够较好地诱导小鼠的免疫系统产生抗体。本研究为SFTSV蛋白和疫苗的研究提供了基础。
| [1] |
Yu XJ, Liang MF, Zhang SY, et al. Fever with thrombocytopenia associated with a novel bunyavirus in China[J]. N Engl J Med, 2011, 364(16): 1523-1532. DOI:10.1056/NEJMoa1010095 |
| [2] |
Liu Q, He B, Huang SY, et al. Severe fever with thrombocytopenia syndrome, an emerging tick-borne zoonosis[J]. Lancet Infect Dis, 2014, 14(8): 763-772. DOI:10.1016/s1473-3099(14)70718-2 |
| [3] |
施泽纶, 乾虎, 马世良, 等. 新型布尼亚病毒病原学和诊断学进展[J]. 新发传染病电子杂志, 2018, 3(3): 140-142. DOI:10.3877/j.issn.2096-2738.2018.03.005 |
| [4] |
吕沐天, 孙颖, 刘沛, 等. 发热伴血小板减少综合征布尼亚病毒研究进展[J]. 微生物学杂志, 2013, 33(2): 86-88. |
| [5] |
Takahashi T, Maeda K, Suzuki T, et al. The first identification and retrospective study of severe fever with thrombocytopenia syndrome in Japan[J]. J Infect Dis, 2014, 209(6): 816-827. DOI:10.1093/infdis/jit603 |
| [6] |
Shin J, Kwon D, Youn SK, et al. Characteristics and factors associated with death among patients hospitalized for severe fever with thrombocytopenia syndrome, South Korea, 2013[J]. Emerg Infect Dis, 2015, 21(10): 1704-1710. DOI:10.3201/eid2110.141928 |
| [7] |
McMullan LK, Folk SM, Kelly AJ, et al. A new phlebovirus associated with severe febrile illness in Missouri[J]. N Engl J Med, 2012, 367(9): 834-841. DOI:10.1056/NEJMoa1203378 |
| [8] |
Arikawa J, Yao JS, Yoshimatsu K, et al. Protective role of antigenic sites on the envelope protein of Hantaan virus defined by monoclonal antibodies[J]. Arch Virol, 1992, 126(1/4): 271-281. DOI:10.1007/BF01309700 |
| [9] |
Överby AK, Pettersson RF, Grünewald K, et al. Insights into bunyavirus architecture from electron cryotomography of Uukuniemi virus[J]. Proc Natl Acad Sci USA, 2008, 105(7): 2375-2379. DOI:10.1073/pnas.0708738105 |
| [10] |
张文帅, 迟莹, 张黎, 等. 发热伴血小板减少综合征布尼亚病毒Gn和Gc蛋白的分段表达[J]. 江苏预防医学, 2013, 24(1): 4-6. DOI:10.3969/j.issn.1006-9070.2013.01.002 |
| [11] |
徐菱遥, 韩亚萍, 周宜庆, 等. SFTSV糖蛋白Gn重组质粒的构建及其体液免疫原性研究[J]. 南京医科大学学报:自然科学版, 2016, 36(5): 554-558. DOI:10.7655/NYDXBNS20160509 |
| [12] |
陈蕾, 戴新宪, 郝春生, 等. 发热伴血小板减少综合征布尼亚病毒糖蛋白抗原(Gn)定量检测方法的建立及验证[J]. 中国生物制品学杂志, 2017, 30(10): 1066-1072. DOI:10.13200/j.cnki.cjb.001747 |
 2019, Vol. 30
2019, Vol. 30