扩展功能
文章信息
- 刘洪霞, 刘曜, 徐劲秋, 冷培恩
- LIU Hong-xia, LIU Yao, XU Jin-qiu, LENG Pei-en
- 淡色库蚊抗吡丙醚种群与敏感种群谷胱甘肽硫转移酶的生物化学性质
- Biochemical characteristics of glutathione s-transferases from the pyriproxyfen-resistant and susceptible populations of Culex pipiens pallens
- 中国媒介生物学及控制杂志, 2019, 30(3): 292-295
- Chin J Vector Biol & Control, 2019, 30(3): 292-295
- 10.11853/j.issn.1003.8280.2019.03.014
-
文章历史
- 收稿日期: 2019-01-09
- 网络出版时间: 2019-4-23 16:05
淡色库蚊(Culex pipiens pallens)是我国北方常见的优势蚊种,其不仅骚扰人类工作和生活,还刺叮吸血、传播疾病,对人类健康造成严重威胁。目前,淡色库蚊防治以化学防治为主。化学杀虫剂的长期、大量、广泛使用,导致淡色库蚊抗药性日趋严峻,防控难度增大[1-3]。吡丙醚,是一种环境友好、杀虫活性较高、靶标特异性强且不易产生抗性的昆虫生长调节剂,其可在较低浓度下有效抑制昆虫几丁质的合成,目前广泛用于农林业害虫及卫生害虫的防治[4-5]。随着吡丙醚在卫生害虫防治中的大量使用,淡色库蚊、白纹伊蚊(Aedes albopictus)及家蝇(Musca domestica)逐渐对其产生了抗药性,大大降低了控制效果[6-7]。
谷胱甘肽硫转移酶(glutathione s-transferases,GSTs)是昆虫体内三大解毒酶系之一,其对昆虫代谢内源和外源毒性化合物起着重要作用。据报道,GSTs在有机磷、有机氯、拟除虫菊酯类药剂的抗性形成过程中起重要作用[8],但GSTs是否参与昆虫生长调节剂抗性的形成尚无系统研究。笔者以室内筛选淡色库蚊抗吡丙醚种群为研究对象,通过比较分析淡色库蚊抗吡丙醚种群和敏感种群GSTs的生物化学性质,初步探讨淡色库蚊对吡丙醚的生物化学抗性机制,为其抗性治理提供参考依据。
1 材料与方法 1.1 实验昆虫淡色库蚊敏感种群,长期饲养于实验室,期间未接触任何杀虫剂;淡色库蚊抗吡丙醚种群,室内吡丙醚选育12代,抗性倍数达到5.69倍。
1.2 实验试剂及仪器1-氯-2,4-二硝基苯(CDNB)、1,2-二氯-4-硝基苯(DCNB)、毒扁豆碱(eserine)以及考马斯亮蓝G250均购自Sigma公司;磷酸氢二钠、磷酸二氢钠以及丙酮均为国产分析纯。冷冻离心机(BioRad公司),紫外-可见分光光度仪UV-750(上海光学仪器公司),电子天平Sartorius 2004MP(Opton公司),恒温水浴锅(上海科技器材有限公司)。
1.3 方法 1.3.1 GSTs酶液制备挑选大小均一的3龄末4龄初淡色库蚊幼虫,称取一定体质量,4 ℃冰浴中加入磷酸缓冲液(0.04 mol/L,pH 7.0)匀浆,匀浆液在4 ℃、10 000×g离心20 min,取上清液备用。
1.3.2 GSTs活性的测定GSTs比活力的测定方法参照Habig和Jacoby[9]的方法并略加修改。分别以CDNB或DCNB为底物,采用0.9 ml反应体系。反应体系中依次加入0.03 ml谷胱甘肽(GSH)(终浓度1.0 mmol/L)、缓冲液、粗酶液,然后再加入0.03 ml CDNB或DCNB(终浓度1.0 mmol/L),迅速混匀后,在340 nm(CDNB)或345 nm(DCNB)用时间驱动程序自动监测其吸光度(A)值在2 min内的变化,并记录反应速度。实验重复3次。
1.3.3 GSTs底物专一性测定将底物CDNB及DCNB分别稀释成8~10个浓度梯度,测定GSTs在不同底物浓度下的比活力,并分别计算2种底物的米氏常数(Km)及最大反应速度(Vmax)。实验重复3次。
1.3.4 蛋白质含量的测定蛋白质含量测定方法参考Bradford考马斯亮蓝G250法并略加修改[10]。用磷酸缓冲液将含有10~120 μg酶蛋白的溶液稀释至0.5 ml,然后加入2.5 ml考马斯亮蓝溶液,充分混和,静置2 min后,于595 nm测定A值,空白对照加等量的磷酸缓冲液。
1.4 数据处理及统计学分析采用Enzifit软件计算不同底物的Km和Vmax。样本均数的比较采用t检验。P<0.05为差异有统计学意义。
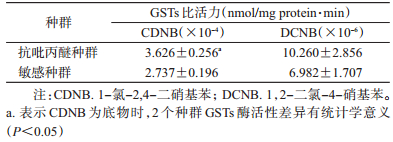
2 结果 2.1 淡色库蚊抗吡丙醚种群和敏感种群GSTs活性底物不同,蚊虫种群GSTs的酶活性也不同。CDNB为底物时,抗性种群GSTs酶活性为3.626×10-4 nmol/mg protein·min,敏感种群酶活性为2.737×10-4 nmol/mg protein·min,二者间差异有统计学意义(t=3.899,P<0.05);DCNB为底物时,抗性种群GSTs酶活性为10.260×10-6 nmol/mg protein·min,敏感种群酶活性为6.982×10-6 nmol/mg protein·min,二者间差异无统计学意义(t=1.149,P>0.05)(表 1),表明GSTs在淡色库蚊吡丙醚抗性形成过程中可能起到解毒代谢作用。
|
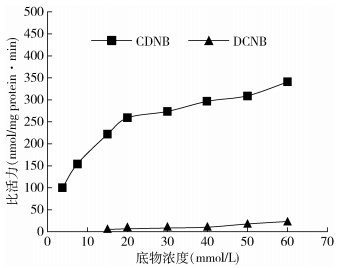
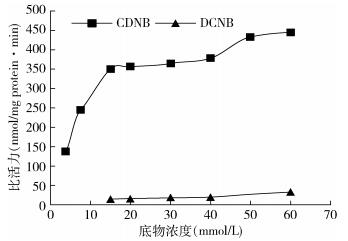
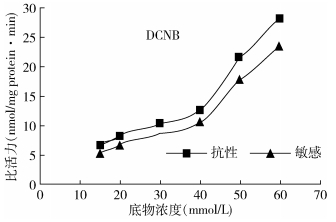
2种淡色库蚊种群GSTs对CDNB和DCNB的水解趋势类似,随着底物浓度的增加,其比活力逐渐升高,GSTs对CDNB的水解活性较高(图 1、2),说明淡色库蚊GSTs的最适底物为CDNB。在一定浓度范围内,相同底物浓度下,抗性种群GSTs比活力略高于敏感种群(图 3、4)。
|
| 注:CDNB.1-氯-2,4-二硝基苯;DCNB.1,2-二氯-4-硝基苯 图 1 敏感种群GSTs对2种底物的水解趋势 Figure 1 Hydrolyzing tendency of GSTs from S strain to two substrates |
| |
|
| 注:CDNB.1-氯-2,4-二硝基苯;DCNB.1,2-二氯-4-硝基苯 图 2 抗吡丙醚种群GSTs对2种底物的水解趋势 Figure 2 Hydrolyzing tendency of GSTs from R strain to two substrates |
| |

|
| 注:CDNB.1-氯-2,4-二硝基苯 图 3 抗吡丙醚种群和敏感种群GSTs对CDNB的水解趋势 Figure 3 Hydrolyzing tendency of GSTs from two stains to CDNB |
| |
|
| 注:DCNB.1,2-二氯-4-硝基苯 图 4 抗吡丙醚种群和敏感种群GSTs对DCNB的水解趋势 Figure 4 Hydrolyzing tendency of GSTs from two strains to DCNB |
| |
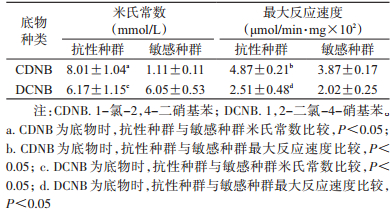
淡色库蚊抗吡丙醚种群GSTs对底物CDNB的Km和Vmax与敏感种群差异有统计学意义(ta=11.415,tb=6.411,P<0.05)(表 2),对底物DCNB的Km和Vmax与敏感种群比较差异无统计学意义(tc=0.134,td=1.280,P>0.05),表明GSTs在吡丙醚抗性形成过程中可能起一定解毒代谢作用。
|
昆虫生长调节剂,作为一类特异性杀虫剂,能阻碍或干扰昆虫个体的正常发育,降低昆虫个体的生活能力,进而导致昆虫死亡[11-12]。因其具有环境友好、靶标特异性强及不易产生抗性的优点,逐渐成为昆虫综合治理的有效手段之一,也是当今开发和利用的重点。目前,以吡丙醚为代表的昆虫生长调节剂被广泛用于卫生害虫的防治,由于其具有不易产生抗性的优点,多年来鲜见有关卫生害虫对吡丙醚产生抗性的报道。由于昆虫对所有杀虫剂均存在产生抗性的风险,因此,近年来有关对吡丙醚产生抗性的蚊虫、家蝇逐渐被国内外报道[13]。本研究以室内淡色库蚊种群为研究对象,通过逐代汰选的方式进行抗性选育,发现连续筛选12代,淡色库蚊对吡丙醚可达5.69倍的抗性,且对溴氰菊酯产生交互抗性[10, 14]。由此得出,长期、连续、大量使用吡丙醚防治卫生害虫,会导致抗性产生;即使未使用吡丙醚,由于其能与其他药剂产生交互抗性,也会导致野外种群对吡丙醚产生抗性。
GSTs是昆虫体内的三大解毒酶系之一,主要以同源二聚体蛋白的形式存在于昆虫体内,根据等电点的不同可以将其分为两类:一类是酸性类,对CDNB有活性,而对DCNB活性很低或无活性;一类是碱性类,对DCNB和几种杀虫剂底物有活性[8]。本研究结果表明,淡色库蚊GSTs对CDNB的活性远大于DCNB,且对DCNB的活性较低,表明淡色库蚊GSTs属于酸性GSTs。研究结果表明,相同底物浓度下,淡色库蚊抗吡丙醚种群GSTs酶活性略高于敏感种群,且2种种群Km和Vmax差异有统计学意义,表明GSTs可能参与淡色库蚊对吡丙醚的解毒代谢。
抗性的形成是多种因素综合作用的结果。了解抗性机制,对其抗性治理具有指导作用,但抗性机制的研究不仅要了解其在酶化学水平的差异,还应了解其基因表达量有无增加及基因有无突变,因此为进一步了解淡色库蚊对吡丙醚的抗性机制还需开展深入研究。
| [1] |
刘洪霞, 冷培恩, 徐仁权, 等. 上海地区蚊虫对常用杀虫剂的抗性及防治对策[J]. 中华卫生杀虫药械, 2009, 15(2): 112-115. |
| [2] |
孟凤霞, 靳建超, 陈云, 等. 我国淡色库蚊/致倦库蚊对常用化学杀虫剂的抗药性[J]. 中国媒介生物学及控制杂志, 2011, 22(6): 517-520, 528. |
| [3] |
Cui F, Raymond M, Qiao CL. Insecticide resistance in vector mosquitoes in China[J]. Pest Manag Sci, 2006, 62(11): 1013-1022. DOI:10.1002/ps.1288 |
| [4] |
王永明, 辛正, 刘慧媛, 等. 5%吡丙醚微乳剂阻止蝇幼虫化蛹及羽化实验观察[J]. 预防医学论坛, 2006, 12(5): 566-568. DOI:10.3969/j.issn.1672-9153.2006.05.031 |
| [5] |
徐仁权, 刘洪霞, 冷培恩, 等. 0.5%吡丙醚颗粒剂对白纹伊蚊控制效果的研究[J]. 中国媒介生物学及控制杂志, 2010, 21(4): 297-299. |
| [6] |
Shah RM, Abbas N, Shad SA, et al. Selection, resistance risk assessment, and reversion toward susceptibility of pyriproxyfen in Musca domestica L.[J]. Parasitol Res, 2015, 114(2): 487-494. DOI:10.1007/s00436-014-4206-0 |
| [7] |
师灿南, 开文龙, 刘起勇, 等. 景洪市登革热媒介伊蚊对吡丙醚的敏感性及其作用特点[J]. 中国媒介生物学及控制杂志, 2017, 28(2): 108-112. DOI:10.11853/j.issn.1003.8280.2017.02.003 |
| [8] |
唐振华, 吴士雄. 昆虫抗药性的遗传与进化[M]. 上海: 上海科学技术文献出版社, 1999: 103.
|
| [9] |
Habig WH, Jacoby WB. Assay for differentiation of glutathione-S-transferase[M]//Jacoby WB. Methods in Enzymology. New York: Academic Press, 1981: 398-405.
|
| [10] |
刘洪霞, 徐劲秋, 刘曜, 等. 淡色库蚊吡丙醚抗性品系和敏感品系羧酸酯酶生化性质差异研究[J]. 中国媒介生物学及控制杂志, 2016, 27(2): 103-106. DOI:10.11853/j.issn.1003.8280.2016.02.003 |
| [11] |
Ishaaya I, Kontsedalov S, Horowitz AR. Biorational insecticides:mechanism and cross-resistance[J]. Arch Insect Biochem Physiol, 2005, 58(4): 192-199. DOI:10.1002/arch.20042 |
| [12] |
Michaelakis A, Porichi AE, Koliopoulos G. Activity of pyriproxyfen, an insect growth regulator, on Culex pipiens (Diptera:Culicidae)[J]. Hellenic Plant Prot J, 2009, 2(1): 41-46. |
| [13] |
刘洪霞, 冷培恩, 徐劲秋, 等. 淡色库蚊对吡丙醚的抗性选育及抗性风险评估[J]. 上海预防医学, 2015, 27(9): 533-536. DOI:10.19428/j.cnki.sjpm.2015.09.004 |
| [14] |
刘洪霞, 冷培恩, 徐劲秋. 抗吡丙醚淡色库蚊对5种常用杀虫剂的交互抗性[J]. 中国媒介生物学及控制杂志, 2015, 26(3): 252-253. DOI:10.11853/j.issn.1003.4692.2015.03.008 |
 2019, Vol. 30
2019, Vol. 30

