扩展功能
文章信息
- 侯娟, 吴瑜燕, 龚震宇, 郭颂, 王金娜
- HOU Juan, WU Yu-yan, GONG Zhen-yu, GUO Song, WANG Jin-na
- 白纹伊蚊和淡色库蚊冷冻麻醉法初探
- A preliminary study of cryoanesthesia of Aedes albopictus and Culex pipiens pallens
- 中国媒介生物学及控制杂志, 2019, 30(2): 163-166
- Chin J Vector Biol & Control, 2019, 30(2): 163-166
- 10.11853/j.issn.1003.8280.2019.02.011
-
文章历史
- 收稿日期: 2018-10-21
- 网络出版时间: 2019-03-01 08:56
蚊虫不仅吸血骚扰人们正常生活、工作,还会传播一系列传染病,其中白纹伊蚊既参与了26种与人类相关病毒的传播,也是浙江省辖区登革热的唯一传播媒介,而淡色库蚊(Culex pipiens pallens)作为浙江省常见的优势蚊种可以传播斑氏丝虫病,因此,蚊虫历来都是媒介生物预防控制中的首要目标之一[1-2]。目前对于蚊虫的防控仍然主要依赖于卫生杀虫剂的使用,而卫生杀虫剂的过量使用会使其产生抗药性影响防治效果,因此在对蚊虫实施具体化学防治措施之前对其开展必要的生物测定十分重要[3-7]。在生物测定过程中,挑选所需蚊虫是基础也是关键,可通过吸蚊管直接吸取实现,也可以通过对蚊虫进行麻醉然后分拣实现。用吸蚊管直接吸取蚊虫具有对蚊虫伤害小的优点,但实际操作中对操作人员技术要求高,且吸蚊效率较低。因此,本文旨在研究蚊虫的冷冻麻醉法,探索合适的冷冻条件和操作流程,在保证蚊虫不受损伤的前提下实现蚊虫的麻醉和分拣,为蚊虫的生物测定提供技术保障。
1 材料与方法 1.1 试虫来源浙江省疾病预防控制中心(CDC)病媒生物饲养室饲养的白纹伊蚊(Aedes albopictus)和淡色库蚊敏感品系,均引自中国CDC传染病预防控制所媒介生物控制室,选取羽化后2~3 d的蚊虫供试。
1.2 饲养条件根据中华人民共和国农业行业标准NY/T 1964.2-2010农药登记用卫生杀虫剂室内实验试虫养殖方法中的要求,饲养室温度(26±2)℃,相对湿度(75±10)%,光照周期(L : D)=12 h : 12 h。蚊虫开始羽化时,饲养笼内放入内盛有8%葡萄糖溶液浸透棉花的培养皿,并每天更换。实验室温度(26±2)℃,相对湿度(65±5)%。
1.3 材料及设备海尔牌医用低温保存箱(DW- 25W198)、温湿度计(THG312)、机械秒表(30′60″)。
1.4 实验方法 1.4.1 温度的校准在冷冻冰柜内放置深圳市欧西亚电子有限公司生产的经过上海市记量测试技术研究院检定的THG312数字温湿度计,将低温保存箱温度控制在(-20±0.5)℃范围内。
1.4.2 白纹伊蚊的冷冻实验取5个大小一致的蚊笼(30 cm×30 cm×30 cm)分别放入即将羽化的白纹伊蚊蚊蛹,每个蚊笼放入40~60只蚊蛹,待其羽化后记录每个蚊笼中雌、雄蚊虫的数量,标为组1~组4和对照组。将组1~组4分别放入冰柜中冷冻5、10、15、和30 s后立即取出放置于室温观察蚊虫击倒和复苏情况,观察时间为30 min。对照组不进行冷冻,待观察后将冷冻后的蚊虫连同对照组一起放进饲养室进行常规饲养,每天10:00观察并记录蚊虫存活情况,直至所有的蚊虫均死亡,期间饲养均用8%葡萄糖水,不对实验组和对照组蚊虫提供血源。
1.4.3 白纹伊蚊冰排实验取6个大小一致的蚊笼,分别放入即将羽化的白纹伊蚊蚊蛹40~60只,待其羽化后控制每个蚊笼中雌、雄蚊虫数量,使每个蚊笼分别保持雌、雄蚊各15只,标为组5~组9和对照组。将组5~组9分别放入冰柜冷冻5 s后立即取出,然后放置于冰排上3、5、10、30和60 min观察复苏情况。对照组不进行冷冻,待观察后将冷冻后的蚊虫连同对照组一起放进饲养室进行常规饲养,每天10:00观察并记录蚊虫存活情况,直至所有的蚊虫均死亡,期间饲养均仅用8%葡萄糖水,不对实验组和对照组蚊虫提供血源。
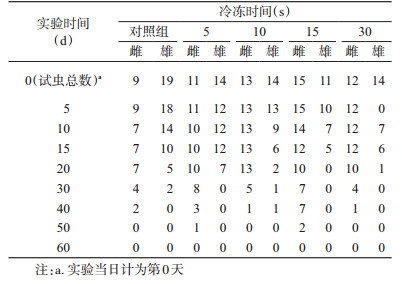
1.4.4 淡色库蚊的冷冻实验取5个大小一致的蚊笼分别放入即将羽化的淡色库蚊蚊蛹,每个蚊笼放入25~35只蚊蛹,待其羽化后记录每个蚊笼中雌、雄蚊虫的数量,标为组10~组13和对照组。将组10~组13分别放入冰柜中冷冻5、10、15、30 s后立即取出,放置于室温观察蚊虫击倒和复苏情况,观察时间为30 min。对照组不进行冷冻,待观察后将冷冻后的蚊虫连同对照组一起放进饲养室进行常规饲养,饲养与观察情况同白纹伊蚊。
1.5 统计学处理采用SPSS 16.0软件进行统计学分析,用生存曲线法计算白纹伊蚊和淡色库蚊不同冷冻时间组的中位生存时间,用log-rank检验比较白纹伊蚊和淡色库蚊不同冷冻时间组间的生存曲线。P<0.05为差异有统计学意义。
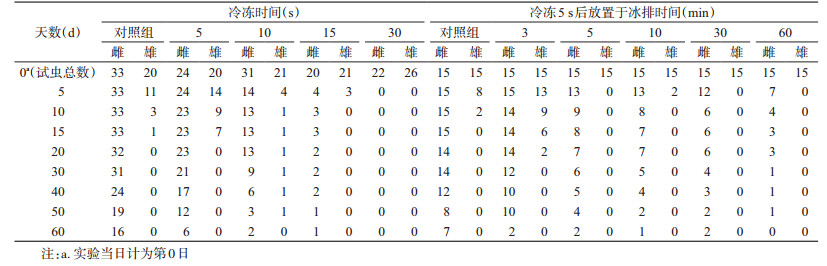
2 结果 2.1 白纹伊蚊冷冻后被击倒与复苏时间根据实验结果,组1~组4的蚊虫击倒率均为100%(44/44、52/52、41/41、48/48),首只复苏时间分别为12、51、144 s和>30 min(均未复苏)。
2.2 白纹伊蚊不同冷冻时间复苏后生存情况将组1~组4经冷冻后和对照组的蚊虫一起放入相同环境条件下进行饲养(组4冷冻后均未复苏),观察不同组蚊虫的生存状况(表 1)。研究发现,组1~组4成蚊冷冻后的中位生存时间分别为29.00、3.93、3.32和0 d;而对照组中位生存时间为38.50 d。不同实验组的中位生存时间差异有统计学意义(χ2=282.185,P<0.01)。分别将不同冷冻时间组与对照组的生存曲线进行比较(log-rank检验),冷冻5 s组与对照组的生存曲线差异无统计学意义(χ2=1.441,P=0.230);冷冻10、15 s组与对照组生存曲线差异有统计学意义(χ2=24.407、38.375,P<0.01)。由表 1可以看出,雌性白纹伊蚊的存活时间普遍长于雄性白纹伊蚊,将不同冷冻组雌蚊生存曲线与对照组雌蚊的生存曲线比较发现,冷冻5 s组雌蚊与对照组雌蚊的生存曲线差异无统计学意义(χ2=1.629,P=0.202);冷冻10、15 s组与对照组生存曲线差异有统计学意义(χ2=22.812、21.614,P<0.01)。
|
冷冻5 s既可将白纹伊蚊全部击倒又不影响蚊虫的生存曲线,因此认为冷冻5 s对白纹伊蚊的麻醉而言较为合理。然而冷冻5 s后首只蚊虫复苏时间仅为12 s,这么短的时间对分拣蚊虫而言具有较大挑战,为此考虑将蚊虫冷冻5 s后取出置于冰排上,观察冰排上放置不同时间后蚊虫的复苏与存活情况。冷冻5 s后放置于冰排上3、5、10、30和60 min的首只蚊虫复苏时间分别为145、147、153、147和150 s,末只蚊虫复苏时间分别为4.58、7.72、12.30、45.10和>90 min。如表 1所示,与未放置冰排的蚊虫结果相似,雌蚊的存活时间普遍长于相同处理状态下的雄蚊,冷冻5 s后放置于冰排3、5、10、30、60 min后的雌蚊与对照组雌蚊的中位生存时间分别为55.63、15.00、12.50、7.92、4.69和54.58 d。将冷冻5 s后放置于冰排不同时间组的雌蚊生存曲线与对照组雌蚊生存曲线进行比较发现,放置3 min组雌蚊与对照组雌蚊的生存曲线差异无统计学意义(χ2=2.463,P=0.117),而放置于冰排5、10、30、60 min组雌蚊与对照组雌蚊生存曲线差异有统计学意义(χ2=15.141、22.518、30.242、43.672,P<0.01)(图 1)。

|
| 图 1 白纹伊蚊雌蚊冷冻5 s后放置于冰排不同时间组的生存曲线 Figure 1 Survival curves of female Aedes albopictus in different time (on ice floe) groups after 5 s freezing |
| |
与白纹伊蚊相同,将淡色库蚊分组分别进行冷冻复苏实验并观察其冷冻后的生存状况(表 2)。根据实验结果,组10~组13冷冻后蚊虫击倒率分别为64.00%(16/25)、85.19%(23/27)、100%(26/26)和100%(26/26),其中组12、组13的首只复苏时间分别为3和138 s。将冷冻后的蚊虫与对照组一同进行饲养,发现组10~组13和对照组的中位生存时间分别为26.25、23.75、20.00、18.57和20.83 d,不同组库蚊冷冻后生存曲线差异无统计学意义(χ2=7.225,P=0.124)。由于组10(冷冻5 s)和组11(冷冻10 s)均未击倒全部的蚊虫,而组12(冷冻15 s)虽然可以击倒全部蚊虫但首只复苏时间过短,无法为实验人员提供充足的操作时间,因此冷冻30 s是麻醉淡色库蚊较为合适的时间。
|
针对成蚊的生物测定,目前国内最常用的选择受试虫体的方法就是吸蚊器直接吸取。吸取蚊虫的吸蚊器有很多种,口吸式吸蚊管直接吸取用的玻璃吸蚊管对材料需求简单、对虫体损伤小,但需要操作人员有较强的吸蚊经验且效率低;电动吸蚊器吸蚊效率高、操作方便,但由于其吸力强,导致吸取过程中不易区分性别且对蚊虫损伤大。因此,本文旨在探索利用冷冻的方法对浙江省常见的2种蚊虫(白纹伊蚊和淡色库蚊)进行麻醉,研究其最佳的冷冻时间和操作流程,在保证蚊虫生存不受影响的前提下预留充足的时间供操作人员分拣所需蚊虫,为蚊虫生物测定提供技术保障。
研究结果显示,在-20 ℃条件下仅需冷冻5 s即可将白纹伊蚊全部击倒,当冷冻30 s后所有蚊虫全部被冻死,复苏率为0,而相同情况下淡色库蚊只有当冷冻15 s时才可将蚊虫全部击倒且首只复苏时间仅为3 s。说明白纹伊蚊对温度较为敏感,与Stireman等[8]的结果类似,这也从侧面解释了白纹伊蚊主要以虫卵而非成虫形式越冬的现象。根据研究结果,冷冻5 s组与对照组生存曲线差异无统计学意义,而冷冻10、15和30 s组生存率均显著低于对照组,因此考虑冷冻5 s为白纹伊蚊冷冻麻醉较为合适的时间。但冷冻5 s组的首只复苏时间仅为12 s,无法供操作人员完成蚊虫的分拣工作,因此我们将白纹伊蚊冷冻5 s后放置于冰排上以期延长首只蚊虫复苏时间,为操作人员争取足够的操作时间。进一步的实验结果表明,放置于冰排3 min的白纹伊蚊首只复苏时间为145 s,其雌蚊生存曲线与对照组雌蚊差异无统计学意义(χ2=2.463,P=0.117),而放置于冰排3、5、10、30和60 min的雌蚊生存曲线均显著低于对照组,认为白纹伊蚊在-20 ℃条件下冷冻5 s再紧接着放置在冰排上3 min是较为合适的麻醉方法。对淡色库蚊的研究表明,在能将淡色库蚊全部击倒的同时又不影响其后续生存的前提下,同时保证操作人员的操作时间,认为在-20 ℃条件下对其冷冻30 s是麻醉淡色库蚊较为合适的时间。本次研究中还发现,无论是白纹伊蚊还是淡色库蚊,雌蚊的生存时间均长于雄蚊,与段恒璐等[9]研究结果类似。
本次研究说明,冷冻法麻醉蚊虫具有操作简便,对蚊虫伤害小,对操作人员技术要求不高的优点,缺陷是本文仅研究了-20 ℃条件下的冷冻过程,对其他的温度结果不一定适用。
| [1] |
郭颂, 凌锋, 王金娜, 等. 浙江省不同地理株白纹伊蚊mtDNA-COⅠ基因多态性研究[J]. 中国人兽共患病学报, 2016, 32(2): 133-136, 147. DOI:10.3969/j.issn.1002-2694.2016.02.007 |
| [2] |
Kampango A, Abílio AP. The Asian tiger hunts in Maputo city:the first confirmed report of Aedes (Stegomyia) albopictus (Skuse, 1895) in Mozambique[J]. Parasit Vectors, 2016, 9(1): 76. DOI:10.1186/s13071-016-1361-4 |
| [3] |
陈华, 刘平, 周云, 等. 绵阳市城区白纹伊蚊对常用杀虫剂的敏感性调查[J]. 中国媒介生物学及控制杂志, 2016, 27(5): 508-509. DOI:10.11853/j.issn.1003.8280.2016.05.025 |
| [4] |
王飞, 蒋璐, 陆珏磊, 等. 上海市虹口区白纹伊蚊幼虫对常用杀虫剂的抗性调查[J]. 中华卫生杀虫药械, 2016, 22(5): 513-514. |
| [5] |
刘阳, 刘强, 梁焯南, 等. 深圳市白纹伊蚊对常用杀虫剂的抗药性研究[J]. 中华卫生杀虫药械, 2016, 22(3): 234-236. |
| [6] |
王义冠, 师灿南, 林国松, 等. 广东省潮州市白纹伊蚊对常用杀虫剂的抗药性[J]. 中国媒介生物学及控制杂志, 2016, 27(3): 228-231. DOI:10.11853/j.issn.1003.8280.2016.03.004 |
| [7] |
孙养信, 吕文, 霍丽霞, 等. 陕西省白纹伊蚊抗药性研究和防制策略[J]. 中国媒介生物学及控制杂志, 2013, 24(1): 47-49. |
| [8] |
Stireman JO Ⅲ, Dyer LA, Janzen DH, et al. Climatic unpredictability and parasitism of caterpillars:implications of global warming[J]. Proc Natl Acad Sci USA, 2005, 102(48): 17384-17387. DOI:10.1073/pnas.0508839102 |
| [9] |
段恒璐, 杨军, 王义冠, 等. 不同温度下白纹伊蚊成蚊生存时间比较研究[J]. 中国媒介生物学及控制杂志, 2017, 28(3): 205-208. DOI:10.11853/j.issn.1003.8280.2017.03.003 |
 2019, Vol. 30
2019, Vol. 30

