扩展功能
文章信息
- 兰学梅, 徐家宝, 姜进勇
- LAN Xue-mei, XU Jia-bao, JIANG Jin-yong
- 云南省瑞丽市白纹伊蚊对拟除虫菊酯类杀虫剂抗性种群的电压门控钠离子通道基因突变分析
- An analysis of voltage-gated sodium channel gene mutation in Aedes albopictus resistant populations against pyrethroid insecticides in Ruili, Yunnan province, China
- 中国媒介生物学及控制杂志, 2019, 30(2): 158-162
- Chin J Vector Biol & Control, 2019, 30(2): 158-162
- 10.11853/j.issn.1003.8280.2019.02.010
-
文章历史
- 收稿日期: 2018-12-06
- 网络出版时间: 2019-03-01 08:56
2 浙江中医药大学, 浙江 杭州 310053
2 Zhejiang Chinese Medical University
登革热(dengue fever,DF)是由登革热病毒Ⅰ~Ⅳ型引起,经伊蚊传播的一种急性传染病,埃及伊蚊(Aedes aegypti)和白纹伊蚊(Ae. albopictus)是其重要的传播媒介[1-2]。登革热已遍布全球整个热带和亚热带地区,超过125个国家成为登革热地方性流行疫区[3]。我国广东[4]、云南[5]、福建[6]和海南[7]省均暴发过登革热疫情,流行形势日趋严重。云南省瑞丽市存在白纹伊蚊和埃及伊蚊2种登革热传播媒介[8]。近年来,我国提出“一带一路”倡议,我国瑞丽市与缅甸边境贸易日趋频繁,流动人口激增,加之缅甸常年有登革热流行[9]。因此,2013年以来瑞丽市每年均发生登革热疫情暴发[10-11],它已经成为当地主要的蚊媒传染病,严重影响着居民健康。
登革热无特效治疗药物,也无疫苗预防[12]。拟除虫菊酯类(菊酯类)杀虫剂具有高效低毒的特点[13],在瑞丽市疫情处置过程中,长期、大量地使用菊酯类杀虫剂进行灭蚊控制,白纹伊蚊已对菊酯类杀虫剂产生抗药性[14]。已证实击倒抗性(knockdown resistance,kdr)是引起蚊虫对拟除虫菊酯类杀虫剂产生抗药性的机制之一[15],但瑞丽市白纹伊蚊对菊酯类杀虫剂产生抗药性的机制是否为kdr尚不清楚。因此,为摸清瑞丽市白纹伊蚊对菊酯类杀虫剂产生抗药性的原因,进一步探讨其抗性与kdr基因突变的相关性,本研究收集了瑞丽市白纹伊蚊成蚊对氯菊酯、溴氰菊酯和顺式氯氰菊酯抗药性生物测定的蚊虫样本和江苏株白纹伊蚊实验室敏感品系种群,检测和分析其kdr基因突变情况。
1 材料与方法 1.1 蚊虫来源2016年6-9月在云南省瑞丽市城区(东、南、西、北、中)的5个片区,采集白纹伊蚊幼虫和蛹,经形态学鉴定后[16],实验室内饲养繁殖至子一代(F1)。随即进行白纹伊蚊对0.75%氯菊酯、0.10%溴氰菊酯和8.00%顺式氯氰菊酯的抗药性测定,24 h后分别收集死亡和存活样本,并置于无水乙醇溶液中保存。药膜和敏感白纹伊蚊种群(江苏,JS-SUS)皆由中国疾病预防控制中心传染病预防控制所提供。
1.2 kdr基因扩增及测序完成生物学测定的抗性种群(瑞丽)和敏感种群(JS-SUS)白纹伊蚊,单管单只收集,并按照试剂盒说明书,提取单蚊基因组DNA。根据白纹伊蚊(Accession No. AY663384)神经细胞膜上的电压门控钠离子通道(voltage-gated sodium channel,VGSC)基因部分序列,参照文献[17-18]合成3对引物,见表 1。提取的每份单蚊DNA样本,分别使用3对引物扩增VGSC domains Ⅱ~Ⅳ基因部分序列。引物aegSCF20和aegSCR21,用于扩增domains Ⅱ区部分基因序列,主要检测S989、I1011、L1014、V1016等位点的突变情况;引物aegSCF7和aegSCR7,用于扩增domains Ⅲ区部分基因序列,检测I1532、F1534位点基因突变情况;引物albSCF6和albSCR8,用于扩增domains Ⅳ区部分基因序列,主要检测D1763等位点的突变情况。上述PCR产物,domainsⅡ采用aegSCF3进行正向测序;domains Ⅲ采用aegSCR8进行反向测序;domains Ⅳ采用albSCF7进行正向测序。
各引物的PCR反应体系相同:包含2×Taq预混液12.5 μl,10 μmol/L正、反向引物各2.0 μl,DNA模板2.0 μl,加双蒸灭菌水至25.0 μl。反应条件为:95 ℃ 2 min;94 ℃ 30 s,59 ℃ 30 s,72 ℃ 1 min,35个循环;72 ℃延伸7 min。扩增产物经1.5%琼脂糖凝胶电泳检测后,送广州(深圳)华大基因有限公司,应用四色荧光标记的双脱氧末端终止法,以正、反向引物测序。
1.3 统计学处理使用MEGA 5.02和BioEdit软件对测得VGSC(domains Ⅱ、domainsⅢ和domains Ⅳ)基因部分序列进行峰图分析和比对,观察各位点的突变情况,确定等位基因类型和基因型,分别统计和计算各样本的kdr基因型频率。运用SPSS 20.0统计软件进行统计学分析,采用χ2检验,分析kdr基因突变与生物测定的白纹伊蚊敏感表型和抗性表型的相关性,检验水准α=0.05。
2 结果 2.1 kdr基因的等位基因和基因型147份瑞丽白纹伊蚊抗性种群和20份白纹伊蚊敏感种群(JS- SUS)的DNA样本扩增后,共获得500条kdr基因部分片段,domains Ⅱ~Ⅳ区序列分别为166、167和167条。在GenBank上进行BLAST比对,与白纹伊蚊VGSC基因(Ae. albopictus,accession no.AY663384)的domains Ⅱ、domains Ⅲ和domains Ⅳ编码区的部分序列一致性达99.00%,证实所得序列为白纹伊蚊kdr基因部分片段,其长度分别为480、740和280 bp。
20份白纹伊蚊敏感种群(JS-SUS)的DNA样本,扩增后共获得60条kdr基因部分片段,进行序列比对分析,所有相关位点上均未发生基因突变情况。147份瑞丽白纹伊蚊抗性种群DNA样本扩增后,共获得440条kdr基因部分片段,进行序列比对分析,结果提示,domains Ⅱ的S989、I1011、L1014、V1016等位点均未发生基因突变情况。domains Ⅲ和domains Ⅳ的I1532、F1534和D1763位点存在突变。同时存在F1534S和I1532T突变的样本仅1份。
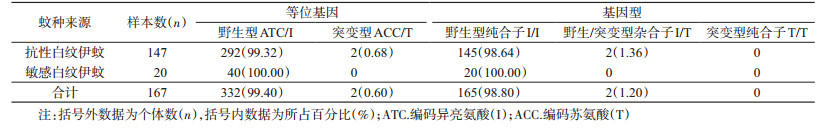
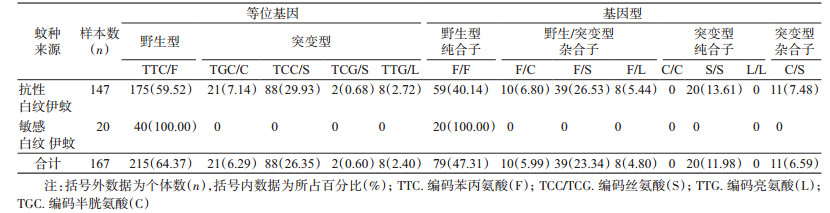
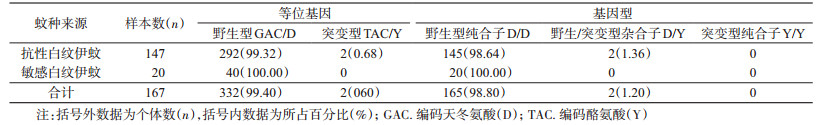
进一步分析得出,1532位点共有2种等位基因,即野生型ATC/I和突变型ACC/T,频率分别为99.32%(292/294)和0.68%(2/294);3种基因型,即野生型纯合子I/I、野生/突变型杂合子I/T和突变型纯合子T/T,频率分别为98.64%(145/147)、1.36%(2/147)和0(0/147);1534位点共有5种等位基因,即野生型TTC/F,突变型TCC/S、TCG/S、TTG/L和TGC/C,频率分别为59.53%(175/294)、29.93%(88/294)、0.68%(2/294)、2.72%(8/294)和7.14%(21/294);6种基因型,即野生型纯合子F/F、野生型/突变型杂合子F/C、F/S、F/L、突变型纯合子S/S和突变型杂合子C/S,频率分别为40.14%(59/147)、6.80%(10/147)、26.53%(39/147)、5.44%(8/147)、13.61%(20/147)和7.48%(11/147);1763位点共有2种等位基因,即野生型GAC/D和突变型TAC/Y,频率分别为99.32%(292/294)和0.68%(2/294);3种基因型,即野生型纯合子D/D、野生型/突变型杂合子D/Y和突变型纯合子Y/Y,频率分别为98.64%(145/147)、1.36%(2/147)和0(0/147),见表 2~4。
|
|
|
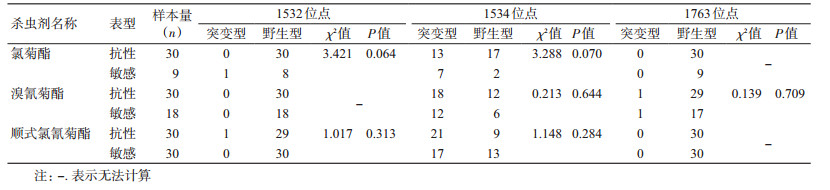
对瑞丽市白纹伊蚊野生种群进行氯菊酯、溴氰菊酯和顺式氯氰菊酯抗药性测定后,实验存活个体定义为抗性表型,实验死亡个体定义为敏感表型。采用χ2检验,对氯菊酯抗性和敏感表型样本的1532、1534和1763位点的kdr基因型进行分别比较,结果提示,对于1532和1534位点,接触氯菊酯抗性和敏感表型样本的kdr基因型差异无统计学意义(χ2=3.421,P=0.064;χ2=3.288,P=0.070),1763位点不存在抗性和敏感表型的突变基因型。
采用χ2检验,对溴氰菊酯抗性和敏感表型样本的1532、1534和1763位点的kdr基因型进行分别比较,结果提示,对于1534和1763位点,接触溴氰菊酯抗性和敏感表型样本的kdr基因型差异无统计学意义(χ2=0.213,P=0.644;χ2=0.139,P=0.709),1532位点不存在抗性和敏感表型的突变基因型。
采用χ2检验,对顺式氯氰菊酯抗性和敏感表型样本的1532、1534和1763位点的kdr基因型进行分别比较,结果提示,对于1532和1534位点,接触顺式氯氰菊酯抗性和敏感表型样本的kdr基因型差异无统计学意义(χ2= 1.017,P=0.313;χ2=1.148,P=0.284),1763位点不存在抗性和敏感表型的突变基因型,见表 5。
|
蚊虫抗药性的机制包括代谢抗性、靶标抗性、表皮抗性和行为抗性[19]。kdr主要由钠通道靶标部位的敏感性降低而引起蚊虫对滴滴涕和拟除虫菊酯类杀虫剂的抗性。自1996年发现家蝇kdr抗性与para型钠通道基因(Vssc1)的突变有关后,至今已在其他13种昆虫的para直向同源钠通道基因序列中共发现20个突变[20]。
本研究对菊酯类杀虫剂均产生不同程度抗性的云南省瑞丽市白纹伊蚊种群进行kdr基因检测,发现1532、1534和1763位点存在突变。其中,1532、1534和1763位点的突变率分别为1.36%(2/147)、59.86%(88/147)和1.36%(2/147),突变率以1534位点为最高,Xu等[21]在中国广州和深圳市的白纹伊蚊中发现了F1534S和F1534L基因突变;另外,师灿南[22]证实景洪市白纹伊蚊也存在I1532T、F1534S和F1534L 3种突变,Chen等[23]在海口市白纹伊蚊中同样发现了F1534S突变,本次研究结果与上述研究结果基本一致。D1763Y为国内首次报告,但仅发现2个样本存在突变,突变率相对较低,需进一步研究证实。研究中还发现1个样本同时存在F1534S和I1532T突变,说明瑞丽市伊蚊的kdr基因突变以单一位点突变为主。
从不同杀虫剂抗性表型和敏感表型不同位点kdr基因型比较结果提示,抗性表型和敏感表型不同位点kdr基因型无差异。可由此推测,F1534C和F1534S在抗性产生的机制中起一定的主导作用。本研究证实云南省瑞丽市对菊酯类杀虫剂产生抗性的白纹伊蚊种群中,发现有1532、1534和1763位点存在突变,其中以1534位点的突变为主,并首次报告在白纹伊蚊中发现了1763位点突变,仅1份样本同时存在F1534S和I1532T突变,突变以单一突变为主。该研究进一步证实了kdr机制是云南省瑞丽市白纹伊蚊对菊酯类杀虫剂产生抗性的机制之一。
| [1] |
安继尧, 严格, 张学文, 等. 白纹伊蚊:登革热的重要媒介[J]. 医学动物防制, 2003, 17(8): 449-452. DOI:10.3969/j.issn.1003-6245.2003.08.001 |
| [2] |
Black IV WC, Bennett KE, Gorrochótegui-Escalante N, et al. Flavivirus susceptibility in Aedes aegypti[J]. Arch Med Res, 2002, 33(4): 379-388. DOI:10.1016/S0188-4409(02)00373-9 |
| [3] |
王永亮, 钱成, 郭运生, 等. 全球登革热流行势态及其影响评述[J]. 口岸卫生控制, 2018, 23(4): 20-26. DOI:10.3969/j.issn.1008-5777.2018.04.006 |
| [4] |
林钟宇, 潘华峰, 王正, 等. 2014年广东登革热流行趋势与防控对策[J]. 卫生软科学, 2015, 29(9): 590-592. |
| [5] |
刘华兴, 王江宁, 弥鹏飞, 等. 西双版纳州2013年登革热流行病学特征分析[J]. 卫生软科学, 2014, 28(6): 399-402. |
| [6] |
潘欢欢, 李锋平. 2007-2016年福建泉州市登革热流行特征分析[J]. 公共卫生与预防医学, 2017, 28(5): 30-32. |
| [7] |
王传滋, 陈文洲. 海南省登革热历年流行概况[J]. 海南医学, 1992, 3(8): 1-4. |
| [8] |
郑宇婷, 杨明东, 周克梅. 云南省边境地区2016年登革热媒介监测结果分析[J]. 中国媒介生物学及控制杂志, 2018, 29(2): 157-160. DOI:10.11853/j.issn.1003.8280.2018.02.010 |
| [9] |
Kyaw AK, Ngwe Tun MM, Moi ML, et al. Clinical, virological and epidemiological characterization of dengue outbreak in Myanmar, 2015[J]. Epidemiol Infect, 2017, 145(9): 1886-1897. DOI:10.1017/S0950268817000735 |
| [10] |
刘永华, 尹小雄, 杨召兰, 等. 云南省瑞丽市2013年登革热暴发的流行病学分析[J]. 中国媒介生物学及控制杂志, 2014, 25(6): 524-526. DOI:10.11853/j.issn.1003.4692.2014.06.010 |
| [11] |
韩继周, 尹正留, 刘永华. 2014年瑞丽市登革热疫情流行特征分析[J]. 中国卫生产业, 2015(15): 186-188. DOI:10.16659/j.cnki.1672-5654.2015.15.070 |
| [12] |
王建羽, 兰学梅, 杨锐, 等. 云南省耿马县埃及伊蚊对6种常用卫生杀虫剂的抗药性研究[J]. 中国媒介生物学及控制杂志, 2017, 28(5): 444-446. DOI:10.11853/j.issn.1003.8280.2017.05.008 |
| [13] |
高景鹏, 陈翰明, 马雅军. 我国白纹伊蚊对3种拟除虫菊酯类杀虫剂抗性检测诊断剂量的建立[J]. 昆虫学报, 2018, 61(1): 18-24. DOI:10.16380/j.kcxb.2018.01.003 |
| [14] |
兰学梅, 郑宇婷, 董朝良, 等. 云南省瑞丽市埃及伊蚊和白纹伊蚊对常用杀虫剂的抗药性调查[J]. 中国媒介生物学及控制杂志, 2017, 28(6): 572-575. DOI:10.11853/j.issn.1003.8280.2017.06.014 |
| [15] |
王晓花, 陈辉莹, 杨新艳, 等. 海口市白纹伊蚊对菊酯类杀虫剂的抗药性及击倒抗性基因突变分析[J]. 第二军医大学学报, 2015, 36(8): 832-838. DOI:10.3724/SP.J.1008.2015.00832 |
| [16] |
董学书, 周红宁, 龚正达. 云南蚊类志(下卷)[M]. 昆明: 云南科技出版社, 2010: 80-82.
|
| [17] |
Saavedra Rodriguez K, Urdaneta Marquez L, Rajatileka S, et al. A mutation in the voltage gated sodium channel gene associated with pyrethroid resistance in Latin American Aedes aegypti[J]. Insect Mol Biol, 2007, 16(6): 785-798. DOI:10.1111/j.1365-2583.2007.00774.x |
| [18] |
Kasai S, Ng LC, Lam-Phua SG, et al. First detection of a putative knockdown resistance gene in major mosquito vector, Aedes albopictus[J]. Jpn J Infect Dis, 2011, 64(3): 217-221. |
| [19] |
Zhu F, Lavine L, O'Neal S, et al. Insecticide resistance and management strategies in urban ecosystems[J]. Insects, 2016, 7(1): 2. DOI:10.3390/insects7010002 |
| [20] |
唐振华, 袁建忠, 庄佩君, 等. 昆虫钠通道的结构和与击倒抗性有关的基因突变[J]. 昆虫学报, 2004, 47(6): 830-836. DOI:10.3321/j.issn:0454-6296.2004.06.022 |
| [21] |
Xu JB, Bonizzoni M, Zhong DB, et al. Multi-country survey revealed prevalent and novel F1534S mutation in voltage-gated sodium channel (VGSC) gene in Aedes albopictus[J]. PLoS Negl Trop Dis, 2016, 10(5): e0004696. DOI:10.1371/journal.pntd.0004696 |
| [22] |
师灿南.景洪市登革热媒介伊蚊对常用杀虫剂的抗药性及机制初步研究[D].北京: 中国疾病预防控制中心, 2017. http://cdmd.cnki.com.cn/Article/CDMD-84501-1017219823.htm
|
| [23] |
Chen HY, Li KL, Wang XH, et al. First identification of kdr allele F1534S in VGSC gene and its association with resistance to pyrethroid insecticides in Aedes albopictus populations from Haikou city, Hainan Island, China[J]. Infect Dis Poverty, 2016, 5: 31. DOI:10.1186/s40249-016-0125-x |
 2019, Vol. 30
2019, Vol. 30



