扩展功能
文章信息
- 车雷, 张国斌, 高丹, 赵梁, 王晓丽
- CHE Lei, ZHANG Guo-bin, GAO Dan, ZHAO Liang, WANG Xiao-li
- 沈阳市鼠携带汉坦病毒G2片段基因分型及序列特征分析
- Genotyping and sequence analysis of G2 segment of hantavirus carried by rats in Shenyang, China
- 中国媒介生物学及控制杂志, 2019, 30(1): 91-94
- Chin J Vector Biol & Control, 2019, 30(1): 91-94
- 10.11853/j.issn.1003.8280.2019.01.022
-
文章历史
- 收稿日期: 2018-09-25
- 网络出版时间: 2018-12-06 20:18
肾综合征出血热(HFRS)主要是通过鼠类携带汉坦病毒(HV)传播给人类的一种自然疫源性疾病。HV属于布尼亚病毒科汉坦病毒属,为分节段的单股负链RNA病毒,病毒的基因组分大(L)、中(M)、小(S)3个片段,3个基因片段的核酸变异以M基因片段的变异最显著,M片段编码病毒糖蛋白G1和G2的前体蛋白,M基因片段的变异会导致HV在细胞融合、结合病毒受体、血凝活性、包膜糖蛋白的表达以及糖基化等方面发生改变,从而影响HV的致病性[1]。沈阳市作为HFRS的重点疫区[2],此前未对宿主动物鼠类所携带HV基因序列进行研究分析。本研究通过对HV G2基因片段进行分型和核苷酸序列分析,确定沈阳市HFRS宿主动物鼠类所携带HV的基因型别,分析HV的变异情况,为调整HFRS防制策略提供科学依据。
1 材料与方法 1.1 标本的采集和筛检2017年春秋季采用夹夜法在居民区及野外分别捕捉家鼠及野鼠,将分类鉴定的鼠无菌解剖,取完整鼠肺,放入冷冻塑料管内,编号,封口,放入液氮罐内保存。采用间接免疫荧光试验(IFA)筛选出HFRS抗原阳性的鼠肺。
1.2 RNA的提取采用TRIZOL法提取鼠肺RNA。每1~2 g鼠肺组织加入Hanks液至1 ml,进行研磨。取250 μl研磨液加入750 μl Trizol液体混匀,室温静置5 min。加入200 μl三氯甲烷,振荡器剧烈振荡15 s,室温放置10 min,离心半径为9.2 cm,4 ℃ 12 000 r/min离心15 min。将上层无色水相液体转移至一个干净的1.5 ml Eppendorf管内,加入500 μl异丙醇,室温放置10 min,离心半径9.2 cm,4 ℃ 12 000 r/min离心10 min沉淀RNA。弃上清液,用75%乙醇溶液1 ml洗沉淀,混匀后4 ℃7 500 r/min离心5 min(离心半径9.2 cm),弃上清液,加入25 μl DEPC水。Trizol试剂液购自Life Technologies公司。
1.3 巢式RT-PCR扩增分两轮进行。第1轮反应体系使用Promega一步法RT-PCR试剂盒(A1250),5×Buffer 10 μl、25 mmol/L MgSO4 4 μl、10 mmol/L dNTPs 1μl、正、反向外套引物(MOF、MOR)各1 μl、AMV 1 μl、Tfl 1 μl、RNA酶抑制剂0.5 μl、ddH2O 25.5 μl、模板RNA 5 μl,第1轮反应条件:42 ℃ 45 min,94 ℃ 4 min,94 ℃ 30 s,52 ℃ 30 s,72 ℃ 30 s,35个循环;72 ℃ 10 min。第2轮反应体系使用Promega PCR反应试剂盒(M7132),Mix 25 μl、正、反向内套引物(HTNMF、HTNMR;SEOMF、SEOMR)各2 μl、ddH2O 17 μl、第1轮PCR产物4 μl,第2轮反应条件:94 ℃ 2 min,94 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,35个循环,72 ℃ 10 min。引物由Invitrogen公司合成。实验用引物见表 1。
扩增产物用1%~2%琼脂糖凝胶电泳鉴定。若条带的相对分子质量与预期片段大小相同,则表明为特异性扩增产物。扩增产物由沈阳汇佰生物科技有限公司进行序列测序。
1.5 核苷酸序列分析应用DNAStar软件包对核苷酸序列进行同源性比较,构建系统进化树,其中引用序列均来自GenBank。
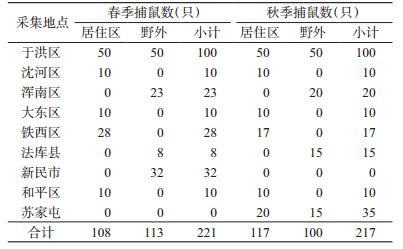
2 结果 2.1 阳性标本筛检选取沈阳市HFRS发病率较高的地区,于2017年春季(4-5月)和秋季(10-11月)分别在野外及居民区采用夹夜法捕获438只鼠并获取鼠肺,捕获鼠数及捕获地区见表 2。家鼠和野鼠的优势鼠种分别为褐家鼠(Rattus norvegicus)和黑线姬鼠(Apodemus agrarius)。采用IFA筛选出HFRS抗原阳性的鼠肺17份,均为褐家鼠鼠肺。
17份阳性鼠肺标本有10份标本扩增出长度为418 bp的特异性条带,符合汉城型(SEO)HV的阳性对照长度,阳性率为58.82%。
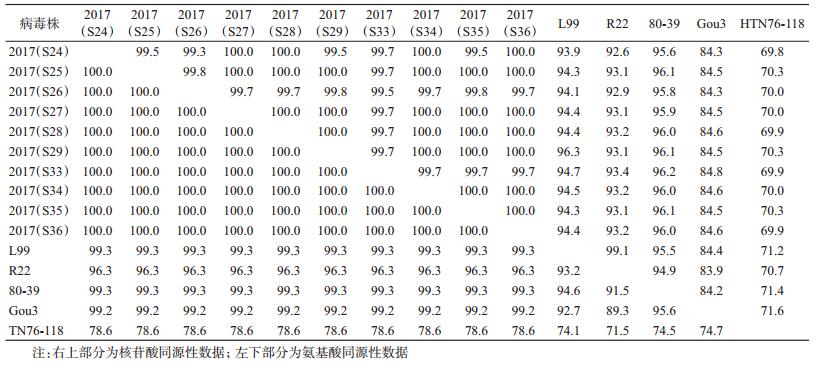
2.3 G2片段核苷酸同源性比较将所得10份PCR扩增产物进行核苷酸序列测定,用DNAStar软件包对测序的10个目的基因及来自GenBank中的国内已测序列毒株及国际上的部分标准毒株进行核苷酸序列比对和同源性比较,结果见表 3。
调查结果显示,10份SEO型HV之间核苷酸同源性高达99.3%~100%。分别与80-39株(韩国,1980)、R22株(河南,1981)、L99株(江西,1984)、Gou3株(浙江,1981)及HTN76-118株(韩国,1978)的相应核苷酸序列进行同源性比较,同源性分别为95.6%~96.2%、92.6%~93.4%、93.9%~94.7%、84.3%~84.8%和69.8%~70.3%。
应用DNAStar软件进行推导所编码氨基酸序列同源性,10份SEO型HV之间氨基酸同源性高达100%,分别与80-39株、R22株、L99株、Gou3株及HTN76-118株的相应氨基酸序列进行同源性比较,同源性分别为99.3%、96.3%、99.3%、99.2%和78.6%。氨基酸序列与80-39株比较仅有1个赖氨酸(R)被精氨酸(K)取代,但此位点氨基酸在其他来自GenBank中已测得的SEO型毒株上均为精氨酸(K)。
2.4 构建系统进化树根据G2片段用DNAStar软件包构建系统进化树。结果显示,10份SEO型HV亲缘关系同样十分接近,与80-39株、R22株和L99株亲缘关系接近,与80-39株亲缘关系最近,与HTN76-118株较远,见图 1。

|
| 图 1 汉坦病毒G2区核苷酸系统进化树 |
| |
20世纪80年代初我国首次分离出HV,此后通过病原学证实我国存在SEO型和汉滩型(HTN)两种HV型别[3],鼠类等啮齿动物是HFRS的主要传染源。经血清学和分子生物学相关研究证实,褐家鼠主要携带SEO型HV,黑线姬鼠主要携带HTN型HV。有学者研究认为[4],HV与宿主动物之间可能存在着一种长期依赖、互相影响、共同进化的关系,HV之间的种系关系反映了宿主动物间的种系关系[5]。本次实验扩增出的10份标本所携带病毒均为SEO型,说明沈阳市HFRS疫区鼠间疫情所感染的HV以SEO型为主,与秦彩明等[6]报道一致。本次虽未检测出HTN型,但董雪等[7]曾在沈阳市新民地区捕获的黑线姬鼠鼠肺中分离出1株HTN型HV,且本次采集样本量有限,故不能排除该型病毒在本地区宿主动物间的存在。
HV属于分节段的RNA病毒,由于缺少校正酶,故易发生变异[8]。HV 3个基因片段的核酸变异以M基因片段的变异最显著,被认为是决定HV毒力和致病性的主要因素[9]。不同型别HV的M片段核苷酸序列有明显差异,是研究HV基因变异和分型的主要区域[10]。M片段基因编码的包膜糖蛋白G1和G2是型特异性抗原,具有独立性的中和抗原位点,可刺激机体产生特异性抗体,主要是中和抗体,其对感染动物或HFRS患者具有保护作用[11]。选择目前较为公认的PCR方法对M片段G2基因进行研究,直接对鼠肺标本进行RT-PCR扩增[12],得到G2基因片段,经过核酸提取、扩增和测序拼接,不存在病毒分离、培养过程中对病毒的选择作用,使结果更接近于病毒在自然界中的原貌,从而能够获得有关不同毒株之间差异的丰富信息,为进一步的研究提供线索。
通过RT-PCR和序列分析的结果显示,沈阳市HFRS疫源地鼠间疫情以SEO型HV为主。RT-PCR检测出的10份阳性标本均为SEO型,位于系统进化树的同一进化枝上。与80-39株、R22株、L99株、Guo3株及HTN76-118株进行核苷酸序列比对,与80-39株同源性最高,与HTN76-118株同源性最低。其中80-39株、R22株、L99株、Guo3株为SEO型毒株,HTN76-118株为HTN型毒株,进一步证明阳性标本均为SEO型毒株。推导氨基酸同源性10份标本之间为100%,与80-39株氨基酸同源性为99.3%。氨基酸序列与80-39株比较仅有1个赖氨酸(R)被精氨酸(K)取代,但此位点氨基酸在其他来自GenBank中已测得的SEO型毒株上均为精氨酸(K)。系统进化树也显示与80-39株最接近。80-39株是在韩国分离发现的毒株,因此,沈阳市鼠类携带HV G2基因片段与韩国HV同源性更高。HV糖蛋白中天冬酰胺连接的糖基化位点和半胱氨酸残基均未发生改变,可能影响糖蛋白空间构象的潜在糖基化位点及酪氨酸残基基本上未发生变异。HV糖蛋白抗原位点保持了天然空间结构[13-14],可推测沈阳地区鼠类携带HV G2基因片段高度同源,无明显变异,遗传物质相对稳定。
| [1] |
Parrington MA, Lee PW, Kang CY. Molecular characterization of the Prospect Hill virus M RNA segment:a comparison with the MRNA segments of other hantaviruses[J]. J Gen Virol, 1991, 72: 1845-1854. DOI:10.1099/0022-1317-72-8-1845 |
| [2] |
车雷, 殷洪博, 刘峥华, 等. 沈阳市2004-2013年肾综合征出血热疫情监测分析[J]. 中国媒介生物学及控制杂志, 2014, 25(6): 566-568. DOI:10.11853/j.issn.1003.4692.2014.06.022 |
| [3] |
宋干. 流行性出血热防治手册[M]. 2版. 北京: 人民卫生出版社, 1998: 31-32.
|
| [4] |
黄鹏, 杨章女, 刘源, 等. 东南沿海地区1980-2015年汉坦病毒分子特征及流行病学分析[J]. 中国媒介生物学及控制杂志, 2017, 28(4): 354-358. DOI:10.11853/j.issn.1003.8280.2017.04.012 |
| [5] |
Hughes AL, Friedman R. Evolutionary diversification of protein-coding genes of hantaviruses[J]. Mol Biol Evol, 2000, 17(10): 1558-1568. DOI:10.1093/oxfordjournals.molbev.a026254 |
| [6] |
秦彩明, 刘芸, 姚文清, 等. 辽宁省鼠类感染肾综合征出血热的病原学及分子生物学检测比较[J]. 中国人兽共患病学报, 2010, 26(6): 528-531. DOI:10.3969/j.issn.1002-2694.2010.06.005 |
| [7] |
董雪, 李欣, 赵常智, 等. 沈阳市一株汉坦病毒的分离及其系统进化的分析[J]. 中国卫生检验杂志, 2007, 17(10): 1763-1765. DOI:10.3969/j.issn.1004-8685.2007.10.014 |
| [8] |
曲虹, 杨占秋. 汉坦病毒基因变异研究进展[J]. 病毒学报, 2000, 16(3): 279-281. DOI:10.3321/j.issn:1000-8721.2000.03.020 |
| [9] |
王炳花, 王志玉. 汉坦病毒包膜糖蛋白的研究进展[J]. 国际病毒学杂志, 2008, 15(3): 65-68. DOI:10.3760/cma.j.issn.1673-4092.2008.03.001 |
| [10] |
Hu TS, Fan QS, Hu XB, et al. Molecular and serological evidence for Seoul virus in rats (Rattus norvegicus) in Zhangmu, Tibet, China[J]. Arch Virol, 2015, 160(5): 1353-1357. DOI:10.1007/s00705-015-2391-5 |
| [11] |
周济华, 张海林. 汉坦病毒分型及致病性的研究进展[J]. 国际病毒学杂志, 2008, 25(2): 37-42. DOI:10.3760/cma.j.issn.1673-4092.2008.02.002 |
| [12] |
刘师文, 徐刚, 龚甜, 等. 2012-2015年江西省啮齿动物间流行的汉坦病毒基因型和基因亚型分析[J]. 现代预防医学, 2018, 45(6): 1090-1094, 1113. |
| [13] |
陈晓湘, 杨占秋, 刘建军, 等. 汉坦病毒湖北株M片段G1编码区基因变异研究[J]. 武汉大学学报:医学版, 2001, 22(4): 289-292. DOI:10.3969/j.issn.1671-8852.2001.04.001 |
| [14] |
王世文, 解燕乡, 杭长寿. 汉坦病毒感染的血清学分型研究进展[J]. 中国公共卫生, 2002, 18(12): 1524-1526. DOI:10.11847/zgggws2002-18-12-67 |
 2019, Vol. 30
2019, Vol. 30