扩展功能
文章信息
- 王博, 毛玲玲, 王子江, 李鑫, 于维君, 宋歌, 王周超, 孙英伟
- WANG Bo, MAO Ling-ling, WANG Zi-jiang, LI Xin, YU Wei-jun, SONG Ge, WANG Zhou-chao, SUN Ying-wei
- 辽宁省2017年5例输入性卵形疟疾的实验室诊断
- Imported oval malaria in Liaoning province, China, in 2017: a laboratory diagnosis of 5 cases
- 中国媒介生物学及控制杂志, 2019, 30(1): 80-83
- Chin J Vector Biol & Control, 2019, 30(1): 80-83
- 10.11853/j.issn.1003.8280.2019.01.019
-
文章历史
- 收稿日期: 2018-09-30
- 网络出版时间: 2018-12-07 14:07
疟疾是全球范围内最为严重的感染性疾病之一[1],辽宁省虽然目前没有本地感染病例报告,但输入性卵形疟疾病例却呈逐年增长趋势。辽宁省目前进入疟疾消除阶段,快速、准确地做出疟疾鉴别诊断十分重要。本研究采用吉氏染色镜检、疟疾快速诊断试验(rapid diagnosis test,RDT)和巢式多重PCR 3种方法同时对5例卵形疟疾患者进行检验检测,并对其18S rRNA基因序列进行分析和同源性比对。
1 材料与方法 1.1 样本来源样本由患者所在的地市级疾病预防控制中心(CDC)采集患者外周血3~5 ml,制作标准疟疾患者有薄、厚血膜的血涂片2张,-20 ℃保存,送至辽宁省CDC检测。
1.2 主要仪器和试剂疟疾RDT试剂盒来自美国Ray Biotech公司。核酸提取商品化试剂盒由德国Qiagen公司提供。聚合酶扩增试剂为TaKaRa Ex Taq聚合酶(R001A),10×Loading Buffer(CA5101A),PCR仪T Gradient 96(Biometra,德国),稳压稳流电泳仪DYY-8B(北京六一仪器厂),凝胶成像系统为Universal Hood Ⅱ(BIO-RAD,Amreica),琼脂糖为西班牙品牌SIGMA VETEC,电子天平METTLER TOLEPO AL104。
1.3 检测方法 1.3.1 吉氏染色镜检采集患者含有EDTA的抗凝血制作标准血涂片,将其干燥、固定后使用吉氏染色,在油镜视野(×1000)下观察疟原虫的具体形态并鉴定其虫种。
1.3.2 疟疾RDT针对患者静脉血进行检测,取5 μl全血垂直加入检测试剂条加样孔A内,然后在样孔B上方垂直滴加4滴裂解液,15 min内判读结果。
1.3.3 巢式PCR检测吸取200 μl全血,用QIAGEN商品化核酸提取试剂盒按照说明书操作提取100 μl核酸样本,-20 ℃保存。按文献[2-4]合成能够扩增针对疟原虫18S rRNA目的基因的序列引物(表 1),引物由生工生物工程(上海)有限公司合成。①反应体系:10×Buffer缓冲液2.5 μl,dNTP(2.5 mmol/L)2 μl,Taq聚合酶(5 U/μl)0.125 μl,正向、反向引物(10 μmol/L)各1 μl,模板2 μl,用ddH2O补足至25 μl。②反应条件:94 ℃预变性3 min,94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸60 s,共扩增34个循环;72 ℃延伸5 min。第1轮为疟原虫的属引物,第2轮为恶性疟原虫(Plasmodium falciparum)、间日疟原虫(P. vivax)、三日疟原虫(P. malariae)和卵形疟原虫(P. ovale)4种型别的特异性引物,将第1轮PCR产物2 μl作为扩增第2轮PCR的模板。第2轮所需的反应体系和扩增条件与第1轮相同,用1%琼脂糖凝胶电泳来鉴定扩增产物,在凝胶成像系统中紫外灯照射条件可见清晰的条带。将测序后的阳性产物序列在GenBank基因库中进行BLAST比对和同源性分析,检测结果显示出扩增片段与预期结果一致。
5例卵形疟疾患者均为男性,年龄32~59岁,平均47岁。患者均有国外工作史,3例来自安哥拉,1例来自刚果,1例来自喀麦隆,见表 2。患者的临床表现为交替性的寒战、发热、出汗和贫血,根据各型别疟原虫的潜伏期有所不同,临床诊断疟疾时间一般为1个月左右。
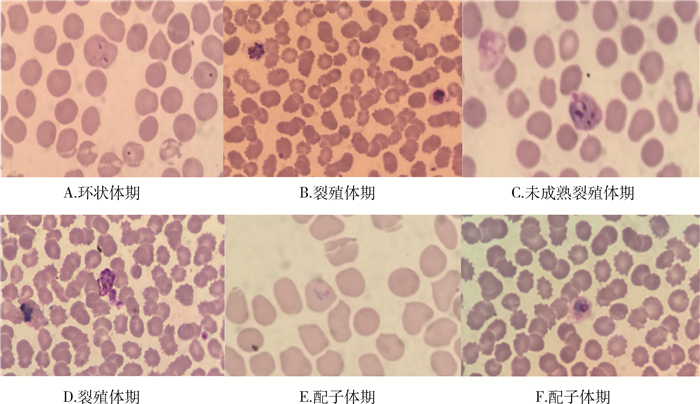
5例患者外周中的血涂片在显微镜下观察疟原虫形态如图 1所示,受感染的红细胞为椭圆形、梭形或泪滴形等多形态性,受染细胞略胀大,边缘呈伞矢状或齿轮状,边缘不规整。滋养体阶段的细胞核粗大且呈紫红色,胞浆紧实;裂殖体阶段受染细胞呈圆形或卵圆形,细胞核呈分裂状,成熟的裂殖体一般含有6~12个裂殖子,多为8个,较大形似菊花样,疟色素集中在中央或一侧,配子体阶段细胞呈圆形或椭圆形,细胞核1个,常位于虫体的边缘或中央。环状体大小约为红细胞直径的1/3,环纤细。
|
| 图 1 卵形疟原虫形态(吉氏染色,×1 000) |
| |
5例患者中有1例在当地市级CDC镜检为间日疟原虫,经省级CDC一级镜检专家复检,血片更正为卵形疟原虫。
2.3 疟疾RDT结果血样检测结果在T2检测带和C控制带出现2条色带,为除恶性疟原虫外的其他型别。
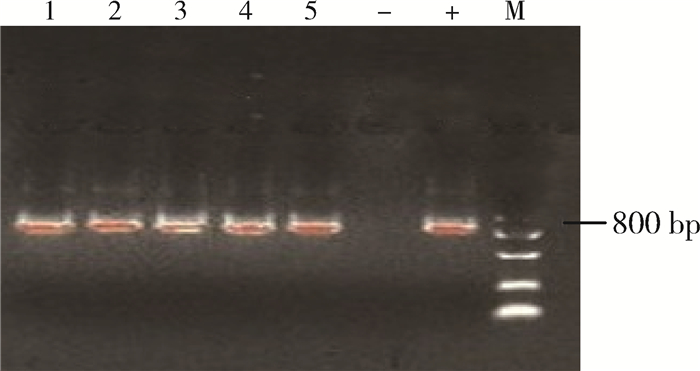
2.4 巢式PCR检测结果电泳结果显示,PCR扩增产物仅在卵形疟原虫引物800 bp左右处出现与阳性对照条带一致的单一明亮条带,均未在其他引物条件下扩增出相应条带(图 2),仅为卵形疟原虫感染。
|
| 注:M. DNA标志物;1~5. 5例检测样本;+.卵形疟原虫阳性对照;-.阴性对照 图 2 5例卵形疟患者血样的巢式PCR扩增结果 |
| |
在BLAST基因库中比对分析,5份卵形疟的基因序列与GenBank中18S rRNA基因序列同源性均达到99%以上,均为卵形疟原虫。
3 讨论我国曾经是一个蚊虫肆虐,疟疾病例高发的大国,经过数十年的不懈努力,大部分地区的疫情已得到控制。辽宁省根据自身的特点采取了“三根治、一预防、积极灭蚊”的综合性防疟措施,疟疾的防治工作取得了阶段性进展,近些年疟疾发病率始终保持在1/10万以下[5],但辽宁省疟疾消除的防控形势依然十分严峻,一方面每年仍有大量务工人员输出境外,特别是非洲等疟疾流行国家,另一方面丹东市紧邻朝鲜,随着双边经济贸易和旅游业的快速发展,两国人员往来不断增多,而朝鲜疟疾流行情况不明,导致辽宁省发生输入性病例的可能性大大增加,如2015年丹东市报告2例输入性间日疟继发病例[6]。
卵形疟疾主要分布于非洲西部、东南亚和南亚等国家的热带地区,因其发病率低、临床症状较轻等特点一直未引起足够重视[7]。卵形疟原虫是5种主要感染人体疟原虫中较为少见的疟原虫种[8]。我国疟疾疫情统计显示,国内已经多年无卵形疟疾本地感染病例,境外输入性病例也比较少见[9-10]。本次检出的5例卵形疟疾患者均来自于非洲中西部国家,其中1例血涂片初次镜检结果鉴定为间日疟,经省级最终审核鉴定更正为卵形疟疾。在疟疾实验室诊断方法中,血涂片镜检虽然作为病原学诊断方法被世界卫生组织认定为“金标准”,而且操作环境简单,基层单位就可以开展,但在实际检测中卵形疟原虫在形态上与间日疟仅有很小差别,极易出现型别判别错误,需要拥有丰富阅片经验的镜检员,这就导致了显微镜检查疟原虫并进行定型的局限性。卵形疟原虫受染的红细胞相对于间日疟不明显,胞浆没有间日疟那样松散,而且红细胞边缘不规整是区分卵形疟和间日疟的鉴别要点。
RDT技术因其方便、快捷已在疟疾的实验室诊断和研究中得到广泛应用[11]。5例卵形疟患者RDT结果均为T1检测带阴性,T2检测带和质控带显示阳性,结果仅提示为除恶性疟以外的其他型别感染。虽然RDT检测简单、便捷,但由于卵形疟没有单独的检测试剂,所得结果仅能提示有除恶性疟外的其他型别疟疾感染的可能,不能作为诊断依据,最终的实验室诊断结果必须综合血涂片镜检,巢式多重PCR检测结果分析判断。由于PCR技术可以特异性的检测微量的靶向核酸序列,根据疟原虫的特异性引物能够快速的区分恶性疟、间日疟、三日疟和卵形疟原虫,并且可以同时检测近百个检测样本,这就大大缩短了临床上的确诊时间,为患者争取了更多的治疗时间,更好的指导临床大夫用药。随着分子生物学在鉴定疟原虫领域的广泛应用,摆脱了传统的疟原虫吉氏染色镜检技术的局限性,提高了疟疾实验室诊断的灵敏性和准确性。本实验研究通过利用巢式PCR扩增疟原虫18S rRNA基因和DNA测序比对分析,能够非常快速区分卵形疟原虫与其他类型疟原虫,在很大程度上弥补了涂片镜检法因主观性等原因造成误诊和漏诊[12]。
综上所述,实验室要加强实验人员的疟疾镜检能力的培训和分子生物学在疟原虫领域的推广,巢式PCR的检测可以提高疟疾诊断的敏感性,对于减少卵形疟的误诊十分必要。
| [1] |
李硕, 张云辉, 王永怡, 等. 2016年全球传染病热点回顾[J]. 传染病信息, 2017, 30(1): 1-7. DOI:10.3969/j.issn.1007-8134.2017.01.003 |
| [2] |
Snounou G, Viriyakosol S, Zhu XP, et al. High sensitivity of detection of human malaria parasites by the use of nested polymerase chain reaction[J]. Mol Biochem Parasitol, 1993, 61(2): 315-320. DOI:10.1016/0166-6851(93)90077-B |
| [3] |
Snounou G, Viriyakosol S, Jarra W, et al. Identification of the four human malaria parasite species in field samples by the polymerase chain reaction and detection of a high prevalence of mixed infections[J]. Mol Biochem Parasitol, 1993, 58(2): 283-292. DOI:10.1016/0166-6851(93)90050-8 |
| [4] |
Singh B, Bobogare A, Cox-Singh J, et al. A genus-and species-specific nested polymerase chain reaction malaria detection assay for epidemiologic studies[J]. Am J Trop Med Hyg, 1999, 60(4): 687-692. DOI:10.4269/ajtmh.1999.60.687 |
| [5] |
滕聪, 雷露, 孙英伟, 等. 2008-2013年辽宁省疟疾流行病学分析[J]. 中国血吸虫病防治杂志, 2014, 26(2): 200-202. |
| [6] |
孙英伟, 于丹梅, 陈君, 等. 辽宁省丹东市两例间日疟病例报告疫情分析[J]. 中国公共卫生, 2017, 33(2): 314-316. DOI:10.11847/zgggws2017-33-02-38 |
| [7] |
Groger M, Fischer HS, Veletzky L, et al. A systematic review of the clinical presentation, treatment and relapse characteristics of human Plasmodium ovale malaria[J]. Malaria J, 2017, 16: 112. DOI:10.1186/s12936-017-1759-2 |
| [8] |
王磊, 王非, 齐志群, 等. 62例输入性疟疾病原学特点分析[J]. 传染病信息, 2016, 29(3): 170-172. DOI:10.3969/j.issn.1007-8134.2016.03.012 |
| [9] |
夏志贵, 丰俊, 周水森. 2012年全国疟疾疫情分析[J]. 中国寄生虫学与寄生虫病杂志, 2013, 31(6): 413-418. |
| [10] |
周瑞敏, 张红卫, 邓艳, 等. 2例输入性卵形疟的实验室检测[J]. 中国寄生虫学与寄生虫病杂志, 2013, 31(2): 127-130. |
| [11] |
Nzeyimana I, Henry MC, Dossou-Yovo J, et al. The epidemiology of malaria in the southwestern forests of the Ivory Coast (Tai region)[J]. Bull Soc Pathol Exot, 2002, 95(2): 89-94. |
| [12] |
徐超, 魏庆宽, 李瑾, 等. 套式聚合酶链式反应在疟原虫检测和分型中的应用研究[J]. 中华诊断学电子杂志, 2013, 1(1): 17-21. DOI:10.3877/cma.j.issn.2095-655X.2013.01.004 |
 2019, Vol. 30
2019, Vol. 30