扩展功能
文章信息
- 杨会娜, 陆靖, 谭文彬
- YANG Hui-na, LU Jing, TAN Wen-bin
- 致倦库蚊抗性种群和敏感品系中转铁蛋白基因表达量的分析
- An analysis of transferrin gene expression in resistant population and susceptible population of Culex pipiens quinquefasciatus
- 中国媒介生物学及控制杂志, 2019, 30(1): 50-55
- Chin J Vector Biol & Control, 2019, 30(1): 50-55
- 10.11853/j.issn.1003.8280.2019.01.011
-
文章历史
- 收稿日期: 2018-09-03
- 网络出版时间: 2018-12-6 20:18
2 济宁市第一人民医院, 山东 济宁 272011;
3 济宁医学院基础医学院, 山东 济宁 272067
2 Jining First People's Hospital;
3 Academy of Basic Medicine, Jining Medical University
蚊虫是多种虫媒传播疾病的传播媒介, 淡色库蚊(Culex pipiens pallens)和致倦库蚊(Cx. pipiens quinquefasciatus)是淋巴丝虫病和流行性乙型脑炎(乙脑)的主要传播媒介, 这2种库蚊同属于尖音库蚊复合组, 淡色库蚊主要分布在我国北方地区, 致倦库蚊主要分布在我国南方地区。虫媒传播疾病严重威胁着人类健康, 切断传播途径是我国蚊媒传染病防治的重要环节, 使用杀虫剂杀灭蚊虫是蚊虫防治的主要手段。而杀虫剂中的拟除虫菊酯类(氯氰菊酯)由于诸多优点被长期大量应用, 其蚊虫抗药性问题日益突出, 成为全世界病媒生物防制工作的突出问题[1], 研究其抗药性机制刻不容缓。研究表明, 蚊虫抗药性产生机制主要归纳为与靶标基因相关的靶标抗性、与代谢酶类相关的代谢抗性以及行为抗性和表皮抗性[2], 代谢抗性单独或与靶标抗性联合作用造成的杀虫剂抗性已在多种科学期刊中报道[3-5]。近年来关于蚊虫抗药性机制的研究多集中在抗性基因的发现, Ibrahim等[6]报道对拟除虫菊酯产生抗性的按蚊(Anopheles)体内CYP6P9a、CYP6P9b高表达, 提示为抗性相关基因, Riveron等[7]报道CYP6M7在抗性种群按蚊中表达较CYP6P9a、CYP6P9b高。Toé等[8]报道CYP4G16、CYP6P1、CYP9J5、CYP6Z3、CYP9M1和CYP6P4在西非对拟除菊酯抗性的Anopheles coluzzi体内高表达, Riveron等[9]证明CYP6P9a和CYP6P9b是过表达最高的基因。自Fang等[10]扩增全长基因CpCPLCG5以来, 越来越多的学者发现不同昆虫体内表皮蛋白CPLCG5基因在抗性种群昆虫体内高表达, 可以作为抗性相关基因[11-14]。谭文彬等[15-16]研究发现铁离子应答元件结合蛋白1(IRE-BP1)基因在白纹伊蚊(Ae. albopictus)、中华按蚊(An. sinensis)和淡色库蚊溴氰菊酯抗性种群和敏感品系中的表达量存在差异。陆靖等[17]报道铁蛋白基因在淡色库蚊氯氰菊酯抗性种群中表达增高, 可以作为蚊虫防治中的靶标基因。抗性基因的发现为蚊虫抗药性机制的研究提供了新思路, 本文基于前人的研究选取致倦库蚊为研究对象, 分析致倦库蚊抗氯氰菊酯种群中转铁蛋白表达量的变化, 对蚊虫抗药性机制的研究具有重要意义。
1 材料与方法 1.1 实验蚊虫致倦库蚊敏感品系为山东省寄生虫病防治研究所保种, 饲养温度为(25±2)℃, 相对湿度为(80±5)%, 饲养光照周期(L:D)=12 h:12 h, 产卵传代以鼠血喂养, 致倦库蚊幼虫对氯氰菊酯的半数致死浓度(LC50)约为0.06 mg/L; 致倦库蚊抗性种群由山东省寄生虫病防治研究所提供, 其LC50约为8.50 mg/L。
1.2 主要试剂和实验仪器TRIzol法总RNA提取所需试剂、反转录所需试剂、普通PCR扩增所用试剂、荧光定量PCR所需试剂均购自南京诺唯赞生物科技有限公司; 琼脂糖凝聚电泳所需试剂购自康为世纪生物科技有限公司; PCR产物切胶回收、纯化所需试剂虾碱性磷酸酶、核酸外切酶Ⅰ、牛肠碱性磷酸酶购自Applied Biosystems公司; 台式高速冷冻离心机购自德国Sigma公司; Fusion FX凝胶成像系统购自北京五洲东方科技发展有限公司; ABI 3130XL DNA测序仪购自上海和学国际贸易有限公司; 荧光定量PCR仪(BIOER Line Gene 9600)购自南京生兴生物技术有限公司。
1.3 主要方法 1.3.1 提取RNA扩增基因片段采用TRIzol法分别提取致倦库蚊敏感品系及抗氯氰菊酯种群4龄幼虫的RNA, 将提取的RNA进行琼脂糖凝胶电泳, 检测提取RNA的完整性。设计引物, 反转录合成cDNA第1链:25℃ 5 min, 50℃ 45 min, 85℃ 5 min; 普通PCR扩增转铁蛋白基因片段, 正向引物:5'-TAC GGT GGT GCG GCT-3', 反向引物:5'-AGT TCC GAT GCC GTT CTG-3', 退火温度为55℃, 产物长度为377 bp。设置PCR反应条件, 热盖温度112℃、预变性94℃ 5 min; 设置循环:变性温度94℃ 30 s、退火温度52℃ 30 s, 延伸温度72℃ 60 s, 35个循环; 彻底延伸温度为72℃ 7 min。反应产物通过琼脂糖凝聚电泳检测基因扩增情况。
1.3.2 纯化测序及序列比对PCR产物切胶回收、纯化测序, 测序结果进行序列比对。
1.3.3 qPCR进行定量分析根据测序结果重新设计荧光定量PCR引物, 并根据致倦库蚊内参基因β-actin的基因序列设计引物, 作为参照基因进行荧光定量PCR。转铁蛋白正向引物5'-TGA CCT CTG GAG ACC CAG TT-3', 反向引物5'-GAG CTT GGC CTA ACC AAA CA-3'。内参β-actin正向引物5'-AGG ACT CGT ACG TCG GTG AC-3', 5'-TGG TGC CAG ATC TTC TCT CCA T-3'。反转录合成cDNA第1链:建立20 μl反应体系, 设置反应条件(25、50、85℃分别反应5、15、5 min); qPCR:建立20 μl反应体系, 布板后设置反应条件(变性反应:95℃ 30 s; 循环反应:95、60℃分别反应10、30 s, 40个循环; 融解反应:95、60、95℃分别反应15、60、15 s)。
1.4 统计学处理将荧光定量PCR所得原始数据导入Excel 2007表格建立数据库, 利用SPSS 17.0软件进行数据分析, 首先F检验判断两样本方差齐性, 若两总体转铁蛋白表达量总体方差不等, 可采取两样本总体方差相等时的两独立样本均数的t检验。P < 0.05为差异有统计学意义。
2 结果 2.1 RNA提取致倦库蚊4龄幼虫RNA提取条带清晰完整, RNA提取成功可以进行后续实验, (图 1)。

|
| 图 1 致倦库蚊RNA电泳结果 Figure 1 RNA electrophoresis of Culex pipiens quinquefasciatus |
| |
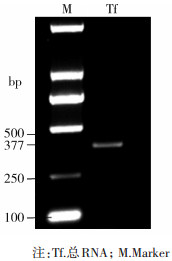
获得的PCR产物长度为377 bp, 见图 2。
|
| 图 2 致倦库蚊转铁蛋白部分基因扩增产物电泳结果 Figure 2 Electrophoresis of qRT-PCR products of the transferrin gene in Culex pipiens quinquefasciatus |
| |
致倦库蚊转铁蛋白基因部分片段测序峰见图 3。

|
| 图 3 致倦库蚊转铁蛋白基因扩增产物测序片段 Figure 3 Sequencing of qRT-PCR products of the transferrin gene in Culex pipiens quinquefasciatus |
| |
利用DNAStar.Lasergene V 7.1软件进行序列拼接, 得到致倦库蚊转铁蛋白基因部分基因如下:TCA GTT CCG ATG CCG TTC TGC TTA TCA TTA CAT GAC CTC TGG AGA CCC AGT TCA AAT AAC AAA CCG CCT TGG CCT TCA GTG GTT TGG TGA AAG GGC AAA ACA GGG CAA AAT CTG ATG GGT TGT GCT GTT TGG TTA GGC CAA GCT CGT TTC CTA CGG TAG GCA GAA ATT ATG TAT TGT TCT CGC TCT TTA AAG AAG TCA TTT AAA TTT TAC CTT TAA ACT TTT TAT ACG TTT CAT AGC TAA TAA ATG CTA CAT CTC CAT TTC CTT CGA GCA AAC AAC GCA TTG CAC CTT CTT CAC CGT TGT AAA CAT CGG AGC ATT TCG ATT GCA AGT GCC AAT TGC ACG ATC GCG AAG AGA AAT AGC TGG AAA TGT CAG TAC ATT CGT CGA TCA AAT GAG TGT GGT TCA TCA ACG ACT CAA ACA CTG ACA AAT AAG CCG CAC CAC CGT AA。
2.3.3 致倦库蚊转铁蛋白测序结果分析通过美国国立生物技术信息中心(NCBI)网站上的核酸序列同源性检测系统对该段序列进行比对, 同源性比对显示该段序列与基因库中致倦库蚊XM001863377.1的同源性达99%, 与淡色库蚊HM370559.1同源性达97%, 见图 4。

|
| 图 4 致倦库蚊转铁蛋白部分基因序列在NCBI中的比对结果 Figure 4 Alignment of transferrin gene sequences of Culex pipiens quinquefasciatus in NCBI |
| |
根据设计的引物扩增目的基因长度为122 bp。利用公式2(Rt-Et)=2(Rn-En)计算, △Ct敏=Tf敏-β敏=15.21-20.53=-5.32, △Ct抗=Tf抗-β抗=18.41-19.10=-0.69, △Ct=△Ct抗-△Ct敏=4.63, 2-△Ct=0.04。利用SPSS 17.0软件F检验判断2个样本方差齐性, 2个样本转铁蛋白表达差异无统计学意义(F=3.054, P>0.100), 还不能认为2个总体转铁蛋白表达量的总体方差不等, 故2个样本采取总体方差相等时的2个独立样本均数的t检验。结果显示, 致倦库蚊抗性种群和敏感品系转铁蛋白表达量差异有统计学意义(t=10.390, P < 0.001), 推断致倦库蚊抗性种群和敏感品系中转铁蛋白基因表达量不同, 抗性种群中转铁蛋白表达量降低。
3 讨论转铁蛋白是一种可以与铁结合的糖蛋白, 对体内铁的运输和细胞的生长、分化、增殖起着重要作用[18]。铁调节蛋白(IRPs)通过与位于转铁蛋白受体(TfR) mRNA 3'端的非翻译区的铁反应元件(IRE)结合, 稳定TfR mRNA的表达, 以此参与转铁蛋白的表达调控[19-20]。Reif[21]研究发现, 铁代谢影响生物体的各项生理功能, 铁过量可以导致慢性中毒, 铁缺乏对IRP/IRE结合活性产生影响。Thomson等[22]研究发现, 细胞内缺铁时IRP/IRE结合活性增强, 稳定转铁蛋白受体(TfR) mRNA的翻译, 使细胞铁摄入增加。而当细胞内铁过量时, IRP与IRE的结合活性丧失。Reif[21]通过研究发现, 杀虫剂可以通过单电子氧化还原反应促进铁的释放, 过量的铁可引起机体病变死亡。由此推断, 氯氰菊酯也可能是通过这一机制促进铁蛋白中铁的释放, 使细胞内铁浓度增加, 从而IRE/IRPS活性降低, 稳定TfR mRNA翻译的能力减弱, 使转铁蛋白基因表达降低。
本研究选择的致倦库蚊抗性种群由氯氰菊酯逐代汰选而来, 氯氰菊酯作为拟除虫菊酯类杀虫剂的一种, 是目前应用较为普遍的杀虫剂, 其蚊虫抗药性问题严重影响了杀虫效力。拟除虫菊酯类杀虫剂其作用机制主要通过干扰蚊虫正常神经功能, 起到杀灭蚊虫的作用。经测序后进行同源性比对, 扩增的致倦库蚊转铁蛋白基因片段与基因库中致倦库蚊(XM 001863377.1)的同源性达99%, 与淡色库蚊(HM370559.1)的同源性达97%, 也证实了致倦库蚊和淡色库蚊同属于尖音库蚊复合组这一事实。
经荧光定量PCR分析, 转铁蛋白基因在致倦库蚊抗性种群中表达量低于致倦库蚊敏感品系, 提示该基因在蚊虫抗性机制中存在一定作用。本研究首次验证转铁蛋白在致倦库蚊氯氰菊酯抗性种群中低表达, 提示该基因可以作为蚊虫抗药性的抗性基因, 对致倦库蚊传播疾病的防治具有一定的应用价值。
| [1] |
Reid MC, McKenzie FE. The contribution of agricultural insecticide use to increasing insecticide resistance in African malaria vectors[J]. Malar J, 2016, 15(1): 107. DOI:10.1186/s12936-016-1162-4 |
| [2] |
Zhu F, Lavine L, O'Neal S, et al. Insecticide resistance and management strategies in urban ecosystems[J]. Insects, 2016, 7(1): 2. DOI:10.3390/insects7010002 |
| [3] |
Abdalla H, Wilding CS, Nardini L, et al. Insecticide resistance in Anopheles arabiensis in Sudan:temporal trends and underlying mechanisms[J]. Parasit Vectors, 2014, 7: 213. DOI:10.1186/1756-3305-7-213 |
| [4] |
Liao C, Upadhyay A, Liang J, et al. 3, 4-Dihydroxyphenylacetaldehyde synthase and cuticle formation in insects[J]. Dev Comp Immunol, 2018, 83: 44-50. DOI:10.1016/j.dci.2017.11.007 |
| [5] |
Sun XL, Guo JX, Ye WY, et al. Cuticle genes CpCPR63 and CpCPR47 may confer resistance to deltamethrin in Culex pipiens pallens[J]. Parasitol Res, 2017, 116(8): 2175-2179. DOI:10.1007/s00436-017-5521-z |
| [6] |
Ibrahim SS, Riveron JM, Bibby J, et al. Allelic variation of cytochrome P450s drives resistance to bednet insecticides in a major malaria vector[J]. PLoS Genet, 2015, 11(10): e1005618. DOI:10.1371/journal.pgen.1005618 |
| [7] |
Riveron JM, Ibrahim SS, Chanda E, et al. The highly polymorphic CYP6M7 cytochrome P450 gene partners with the directionally selected CYP6P9a and CYP6P9b genes to expand the pyrethroid resistance front in the malaria vector Anopheles funestus in Africa[J]. BMC Genomics, 2014, 15(1): 817. DOI:10.1186/1471-2164-15-817 |
| [8] |
Toé KH, N'Falé S, Dabiré RK, et al. The recent escalation in strength of pyrethroid resistance in Anopheles coluzzi in West Africa is linked to increased expression of multiple gene families[J]. BMC Genomics, 2015, 16(1): 146. DOI:10.1186/s12864-015-1342-6 |
| [9] |
Riveron JM, Irving H, Ndula M, et al. Directionally selected cytochrome P450 alleles are driving the spread of pyrethroid resistance in the major malaria vector Anopheles funestus[J]. Proc Natl Acad Sci USA, 2013, 110(1): 252-257. DOI:10.1073/pnas.1216705110 |
| [10] |
Fang FJ, Wang WJ, Zhang DH, et al. The cuticle proteins:a putative role for deltamethrin resistance in Culex pipiens pallens[J]. Parasitol Res, 2015, 114(12): 4421-4429. DOI:10.1007/s00436-015-4683-9 |
| [11] |
Huang Y, Guo Q, Sun XL, et al. Culex pipiens pallens cuticular protein CPLCG5 participates in pyrethroid resistance by forming a rigid matrix[J]. Parasit Vectors, 2018, 11(1): 6. DOI:10.1186/s13071-017-2567-9 |
| [12] |
Vannini L, Reed TW, Willis JH. Temporal and spatial expression of cuticular proteins of Anopheles gambiae implicated in insecticide resistance or differentiation of M/S incipient species[J]. Parasit Vectors, 2014, 7: 24. DOI:10.1186/1756-3305-7-24 |
| [13] |
Zhou D, Duan BY, Sun Y, et al. Preliminary characterization of putative structural cuticular proteins in the malaria vector Anopheles sinensis[J]. Pest Manag Sci, 2017, 73(12): 2519-2528. DOI:10.1002/ps.4649 |
| [14] |
Liang Y, Gao XW. The cuticle protein gene MPCP4 of Myzus persicae (homoptera:aphididae) plays a critical role in Cucumber mosaic virus acquisition[J]. J Econ Entomol, 2017, 110(3): 848-853. DOI:10.1093/jee/tox025 |
| [15] |
谭文彬, 王霄, 袁常秀, 等. 3种品系白纹伊蚊IRE-BP1基因表达差异的比较[J]. 国外医学医学地理分册, 2012, 33(4): 230-232. DOI:10.3969/j.issn.1001-8883.2012.04.003 |
| [16] |
谭文彬, 王霄, 袁常秀, 等. IRE-BP1基因在3种淡色库蚊体内表达量的比较分析[J]. 中国热带医学, 2012, 12(4): 421-422, 426. DOI:10.13604/j.cnki.46-1064/r.2012.04.015 |
| [17] |
陆靖, 史琦琪, 程鹏, 等. 淡色库蚊抗性种群和敏感品系中铁蛋白基因表达量的分析[J]. 中国媒介生物学及控制杂志, 2018, 29(2): 134-137, 142. DOI:10.11853/j.issn.1003.8280.2018.02.005 |
| [18] |
Aisen P, Listowsky I. Iron transport and storage proteins[J]. Ann Rev Biochem, 1980, 49: 357-393. DOI:10.1146/annurev.bi.49.070180.002041 |
| [19] |
Tong WH, Rouault TA. Functions of mitochondrial ISCU and cytosolic ISCU in mammalian iron-sulfur cluster biogenesis and iron homeostasis[J]. Cell Metab, 2006, 3(3): 199-210. DOI:10.1016/j.cmet.2006.02.003 |
| [20] |
Li KT, Tong WH, Hughes RM, et al. Roles of the mammalian cytosolic cysteine desulfurase, ISCS, and scaffold protein, ISCU, in iron-sulfur cluster assembly[J]. J Biol Chem, 2006, 281(18): 12344-12351. DOI:10.1074/jbc.M600582200 |
| [21] |
Reif DW. Ferritin as a source of iron for oxidative damage[J]. Free Radic Biol Med, 1992, 12(5): 417-427. DOI:10.1016/0891-5849(92)90091-T |
| [22] |
Thomson AM, Rogers JT, Leedman PJ. Iron-regulatory proteins, iron-responsive elements and ferritin mRNA translation[J]. Int J Biochem Cell Biol, 1999, 31(10): 1139-1152. DOI:10.1016/S1357-2725(99)00080-1 |
 2019, Vol. 30
2019, Vol. 30


