扩展功能
文章信息
- 马菲雅, 梅琳, 张雅芬, 王慧煜, 刘佳佳, 韩雪清
- MA Fei-ya, MEI Lin, ZHANG Ya-fen, WANG Hui-yu, LIU Jia-jia, HAN Xue-qing
- 黑龙江及吉林省边境口岸与境外全沟硬蜱线粒体细胞色素C氧化酶亚基Ι基因序列的比较研究
- A comparative analysis of the sequence of cytochrome C oxidase subunit I gene in Ixodes persulcatus from Heilongjiang and Jilin ports and foreign countries
- 中国媒介生物学及控制杂志, 2019, 30(1): 47-49,55
- Chin J Vector Biol & Control, 2019, 30(1): 47-49,55
- 10.11853/j.issn.1003.8280.2019.01.010
-
文章历史
- 收稿日期: 2018-08-25
- 网络出版时间: 2018-12-6 20:43
2 中国计量大学生命科学学院, 浙江 杭州 310018
2 China Jiliang University, College of Life and Sciences
目前世界上蜱类有3科18属897种。其中中国已描述有效定名蜱类有2科10属119种, 我国已记录的硬蜱科约100种, 软蜱科10种[1]。全沟硬蜱(Ixodes persulcatus)是典型的森林蜱种, 是一种专性吸血、可长期存活的三宿主寄生动物。它作为硬蜱科的主要种类, 在全球分布广泛, 范围横跨欧亚大陆。20世纪90年代以前, 全沟硬蜱在我国黑龙江、吉林、辽宁、甘肃、山西省、新疆维吾尔自治区(新疆)、西藏自治区(西藏)均有分布, 随着气候变暖、人类活动等原因, 蜱种群分布面积扩大, 蜱传病原体增多[2]。它可以携带多种病原体并且传染给人和动物, 造成多种病毒病和细菌病的发生[3]。目前, 我国已经被证实由全沟硬蜱传播的疾病有森林脑炎、莱姆病、人埃立克次体病[4-6]。近几年的研究表明, 全沟硬蜱的种群分布范围更有扩大的趋势[7]。
在传播病原体的过程中, 蜱类的生物学特性在蜱媒病的流行特征中起决定性作用, 近年来遗传多样性研究越来越受到关注。然而目前我国对边境口岸地区的全沟硬蜱缺乏分子特征的研究, 用分子生物学方法对我国边境口岸的全沟硬蜱基因进行溯源和对比分析非常重要。因此, 基于全沟硬蜱的自然地理分布, 研究我国以及其他国家全沟硬蜱的系统发育关系及遗传结构, 有利于了解全沟硬蜱在我国的遗传特点和发展趋势, 从而对蜱传播的人、畜共患病的防控提供理论基础和依据。本研究依据细胞色素C氧化酶亚基Ⅰ (COⅠ)基因分析了我国黑龙江、吉林省边境口岸全沟硬蜱的同源性及种群遗传距离, 并且与国外已报道的全沟硬蜱COⅠ基因序列进行对比分析, 从生物系统发育的角度分析其发展趋势及可能性。
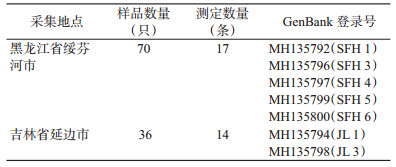
1 材料与方法 1.1 实验材料自2013年6月至2016年8月在黑龙江省绥芬河口岸和吉林省延边口岸采集全沟硬蜱106只, 采集的蜱放入采集管内带回实验室, 随后选取31只进行COⅠ基因序列扩增并将相关序列登记在GenBank中。具体采集及序列号信息见表 1。
Bio-Rad核酸电泳仪、Bio-Rad凝胶成像分析仪, 美国伯乐公司生产; ABI Veriti96 PCR仪, 美国ABI公司生产:Christ Mill-Q纯水系统, 德国Christ公司生产。
1.3 基因扩增及测序样品置于1.5 ml离心管中, 使用DNA快速提取试剂盒(美国Omega公司)并按照说明书提取基因总DNA, 于-20℃保存样品备用。PCR COⅠ正向引物:5'-GGA ACA ATA TAT TTA ATT TTT GG-3'和COⅠ反向引物:5'-ATC TAT CCC TAC TGT AAA TAT ATG-3'。以提取的DNA为模板, 扩增COⅠ基因片段。扩增体系共20 μl:正、反向引物各0.8 μl, Tap PCR Master Mix 10 μl, ddH2O 8 μl, DNA 0.4 μl。PCR反应条件:预变性96℃ 10 min, 变性96℃ 30 s, 退火56℃ 30 s, 延伸68℃ 1 min, 延伸72℃ 10 min。扩增产物经过纯化后由北京六合华大基因科技有限公司测序。
1.4 数据分析用CLC Genomics Workbench软件对格式进行转换并对序列方向进行修正, 然后在美国国立生物技术信息中心(NCBI)进行BLAST同源性对比并选择相应的参考株。用MEGA 6.0软件采用Maximum-Likelihood(ML)法构建系统发育进化树, 进行1 000次自举检验。通过MEGA 6.0软件计算地理种群间的遗传距离, 并且分析和计算序列的保守位点、变异位点、简约信息位点以及碱基组成。
2 结果 2.1 序列特征分析共采集全沟硬蜱106只, 样品采集信息见表 1。蜱样本COⅠ基因PCR产物获得的序列共计31条, 基因序列碱基长为630 bp。全沟硬蜱的A、T、C、G碱基平均含量分别为29.4%、37.9%、18.3%和14.4%, A+T碱基含量为67.3%, 保守位点为468个, 变异位点为162个, 简约信息位点为68个。
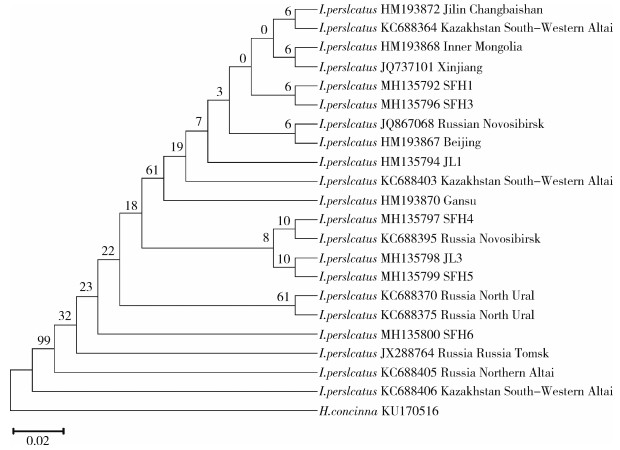
2.2 同源性分析通过与GenBank中已登录的邻近国家(包括俄罗斯的新西伯利亚、阿尔泰、乌拉尔、托木斯克地区以及哈萨克斯坦的阿尔泰边境地区)全沟硬蜱的COⅠ基因序列进行对比, 发现我国黑龙江省绥芬河口岸和吉林省延边口岸全沟硬蜱COⅠ基因序列与俄罗斯的阿尔泰株KC688405、新西伯利亚株KC688395以及乌拉尔株KC688370的同源性均为100%;与托木斯克株JX288764的同源性为99%。与哈萨克斯坦阿尔泰边境地区的参考株KC688406和KC688364株相比, 同源性分别为99%和100%。此外, 与国内其他省份分离的全沟硬蜱COⅠ序列对比分析结果见图 1, 与HM193868内蒙古株、HM193867北京株同源性均为100%, 与JQ737101新疆株同源性为99%, 与HM193870甘肃株同源性为97%。
|
| 图 1 基于COⅠ基因的ML系统发育树 Figure 1 Phylogenetic tree inferred by the ML method based on the COⅠ gene |
| |
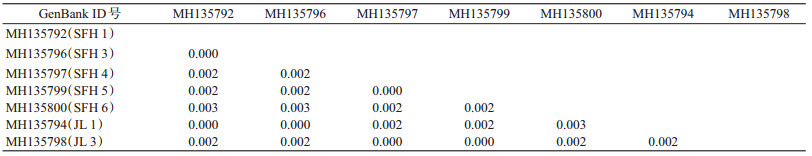
除构建系统发育树分析同源性之外, 还对绥芬河及延边口岸2个地理种群全沟硬蜱的COⅠ基因序列进行了遗传距离分析。根据Kimura双参数模型(K2-P模型)得出各种内的遗传距离(表 2)。通过对全沟硬蜱COⅠ基因遗传距离的分析可以看出, 黑龙江省绥芬河口岸的几株全沟硬蜱COⅠ序列遗传距离均≤ 0.003。黑龙江省绥芬河株与吉林省延边株的遗传距离也均≤ 0.003, 而延边株MH135794和MH135798的遗传距离仅为0.002。由此可见, 黑龙江省绥芬河口岸和吉林省延边口岸全沟硬蜱地理种群种间遗传距离相差较小。
|
黑龙江省绥芬河口岸和吉林省延边口岸是我国北部重要的边境口岸, 与哈萨克斯坦、俄罗斯、韩国、蒙古等国家在地理上较邻近, 因此, 分析邻近国家边境口岸和我国边境口岸全沟硬蜱的分子特征非常重要。
俄罗斯边境的乌拉尔地区位于俄罗斯欧洲部分与亚洲连接处, 而阿尔泰地区与哈萨克斯坦、中国、俄罗斯3国相接壤。由分析结果可以看出, 黑龙江省绥芬河口岸和吉林省延边口岸地区的COⅠ基因序列与俄罗斯多个地区(新西伯利亚、阿尔泰、乌拉尔、托木斯克)同源性高达99%~100%, 而与哈萨克斯坦阿尔泰边境地区的全沟硬蜱COⅠ序列也极高, 表明中国与这2个国家的全沟硬蜱基因交流非常频繁, 很有可能通过中国的内蒙古和新疆等地与国内其他地区的全沟硬蜱进行基因交流和种群迁移。而此次在绥芬河和延边口岸采集到的全沟硬蜱与上述国家全沟硬蜱COⅠ基因同源性极高的原因可能有:(1)近几年我国北部边境口岸进出口贸易不断扩大, 尤其是国外大量动物皮毛的进口, 使其携带的包括全沟硬蜱在内的各种媒介生物随着交通工具的运输传入我国境内。(2)我国新疆及内蒙古等地有多处湿地自然保护区, 成为候鸟迁徙路线(南亚路线、印巴路线、北非路线)的枢纽位置, 是鸟类迁徙的主要驿站[8], 从而为全沟硬蜱迁移到我国东北地区提供极其便利的条件。(3)近年来我国北部地区呈现春季气温长期偏高(平均气温升高0~1℃)[9], 降雨量增多的趋势, 这为全沟硬蜱的生存和繁殖提供了良好条件。然而其他一些邻近国家的全沟硬蜱COⅠ序列在NCBI中可查信息极少, 所以还需足够的数据以供更深入的分析。
全沟硬蜱能传播森林脑炎、莱姆病、西伯利亚蜱传斑疹伤寒等疾病。目前在俄罗斯全国范围内, 莱姆病是最主要的蜱传疾病; 在阿尔泰地区的蜱类中, 近期已发现未被充分研究的立克次体等病原体[10], 预示着我国边境口岸地区全沟硬蜱可能携带森林脑炎病毒、立克次体、螺旋体或一些新型病原体, 尤其是在蜱活动高峰期的5-6月可能会对动物或居民造成感染, 必须做好严格的防控措施以防疾病的暴发。
| [1] |
杨晓军, 陈泽, 刘敬泽. 蜱类系统学研究进展[J]. 昆虫学报, 2007, 50(9): 941-949. DOI:10.3321/j.issn:0454-6296.2007.09.012 |
| [2] |
De La Fuente J, Estrada-Peña A. Ticks and tick-borne pathogens on the rise[J]. Ticks Tick Borne Dis, 2012, 3(3): 115-116. DOI:10.1016/j.ttbdis.2012.03.001 |
| [3] |
Korenberg EI, Shcherbakov SV, Bannova GG, et al. The infectiousness of Ixodes persulcatus ticks with the causative agents of Lyme disease and tick-borne encephalitis simultaneously[J]. Parazitologiia, 1990, 24(2): 102-105. |
| [4] |
许士奇.全沟硬蜱种群生态及蜱传病原体研究[D].石家庄: 河北师范大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10094-1015354707.htm
|
| [5] |
马宏宇.东北地区蜱携带新型病毒的发现及鉴定[D].长春: 吉林农业大学, 2017. https://www.ixueshu.com/document/2c795a7e7a64a48dfb6bcab26de09545.html
|
| [6] |
潘玉平, 杨吉飞, 牛庆丽, 等. 黑龙江省全沟硬蜱携带伯氏疏螺旋体广义种和斑点热群立克次体的研究[J]. 中国兽医科学, 2017, 47(1): 31-37. DOI:10.16656/j.issn.1673-4696.2017.01.005 |
| [7] |
秦少青. 全沟硬蜱及相关疾病[J]. 畜牧兽医科技信息, 2010(10): 15-16. DOI:10.3969/J.ISSN.1671-6027.2010.10.008 |
| [8] |
Hubálek Z. An annotated checklist of pathogenic microorganisms associated with migratory birds[J]. J Wildl Dis, 2004, 40(4): 639-659. DOI:10.7589/0090-3558-40.4.639 |
| [9] |
董李丽, 李清泉, 丁一汇. 全球变暖背景下我国春季气温的时空变化特征[J]. 气象, 2015, 41(10): 1177-1189. DOI:10.7519/j.issn.1000-0526.2015.10.001 |
| [10] |
Dedkov VG, Simonova EG, Beshlebova OV, et al. The burden of tick-borne diseases in the Altai region of Russia[J]. Ticks Tick Borne Dis, 2017, 8(5): 787-794. DOI:10.1016/j.ttbdis.2017.06.004 |
 2019, Vol. 30
2019, Vol. 30