扩展功能
文章信息
- 王海峰, 周松, 刘合智, 刘晓伟, 杨顺林, 杜国义, 史献明
- WANG Hai-feng, ZHOU Song, LIU He-zhi, LIU Xiao-wei, YANG Shun-lin, DU Guo-yi, SHI Xian-ming
- 河北省康保县2017年分离的3株鼠疫菌株基因分型及流行病学分析
- Genotypes and epidemiological characteristics of three Yersinia pestis strains isolated from Kangbao county in Hebei province, in 2017
- 中国媒介生物学及控制杂志, 2019, 30(1): 40-42
- Chin J Vector Biol & Control, 2019, 30(1): 40-42
- 10.11853/j.issn.1003.8280.2019.01.008
-
文章历史
- 收稿日期: 2018-09-20
- 网络出版时间: 2018-12-6 20:17
河北省鼠疫自然疫源地位于张家口市康保县境内(144°45'E, 42°04'N), 疫源地面积约1 000 km2, 北部与内蒙古的白旗、太仆寺旗以及化德县相邻, 历史上曾发生过4次动物间鼠疫流行, 分离菌株273株, 经鉴定菌株生态型属鄂尔多斯高原型, 是内蒙古长爪沙鼠(Meriones unguiculatus)鼠疫疫源地的延伸[1]。经过2006-2016年长达11年的静息期后, 2017年再次发生动物间鼠疫, 共分离到3株鼠疫耶尔森菌(鼠疫菌)。对菌株进行基因分型可以分析菌株的遗传特征, 追溯疫情发生的流行病学线索。近年来建立了多种鼠疫菌的基因分型方法, 其中差异区段(different region, DFR)是较为常用的方法之一[2]。本研究通过对2017年分离的鼠疫菌进行DFR基因分型, 与以往分离的菌株基因型比较, 探讨此次动物间鼠疫疫情的流行特征。
1 材料与方法 1.1 菌株来源2017年分离自河北省康保县的3株鼠疫菌, 1株分离自长爪沙鼠, 2株分离自黑线仓鼠(Cricetulus barabensis)。
1.2 仪器及试剂PCR扩增仪(杭州博日科技有限公司), 高速台式离心机(Eppendorf 5424), 水平电泳仪(北京市六一仪器厂), 凝胶成像仪(上海基因有限公司)。DNA提取试剂盒购自Qiagen公司, PCR扩增试剂购自北京全式金生物技术有限公司, DL500 Marker购自大连宝生物工程有限公司, 100 bp Marker购自北京赛百盛基因技术有限公司, 琼脂糖购自西班牙Biowest, 阳性对照由青海省地方病防治所赠送。
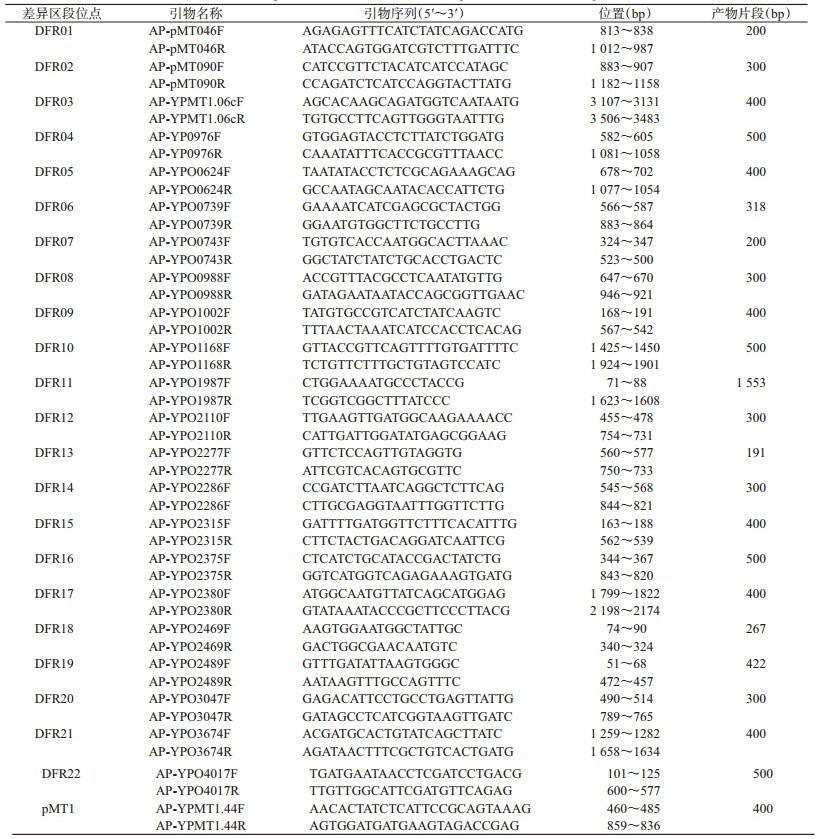
1.3 引物所有引物序列均来自参考文献[3], 由生工生物工程(上海)有限公司合成, 见表 1。
① 水煮法:将分离的鼠疫菌接种于赫氏培养基, 28℃培养48 h后刮取菌苔于加有600 μl TE缓冲液的Eppendorf管中, 100℃水浴20 min, 离心半径8.4 cm, 12 000 r/min离心10 min, 收集上清液。抽取100 μl上清液, 涂布于赫氏培养基平板中, 28℃培养48 h进行无菌实验, 无菌生长则进行下一步分子生物学实验, 有菌生长则重新提取DNA。②试剂盒提取法:按说明书进行操作。将提取的DNA用去离子水稀释10倍后制备成PCR扩增用的模板。
1.4.2 PCR反应体系和条件① 反应体系:去离子水将提取的鼠疫菌DNA模板10倍稀释, 采用25 μl反应体系, 其中SuperMix混合液12.5 μl, 正、反向引物各1.0 μl, 模板1.0 μl, 补水至25.0 μl; ②反应条件:引物DFR1~17, DFR20~22, pMT1的扩增条件为94℃预变性3 min, 94℃变性30 s, 60℃退火30 s, 72℃延伸1 min, 30个循环。72℃延伸5 min。引物DFR18和DFR19的退火条件为56℃ 30 s, 其他条件同上。
1.4.3 电泳分析扩增产物用1.5%琼脂糖凝胶电泳, 阳性对照采用62004和82009的混合物, 阴性对照用去离子水。电泳条件为120V, 30~60 min。
1.4.4 结果判读在凝胶成像仪下读取结果, 阳性对照扩增出全部条带时结果有效, 标本出现目标条带者判为出现目标, 并与阳性对照一致的记为"1", 未出现目标条带者记为"0"。对模糊不清的条带重复实验进行验证。
2 结果3株鼠疫菌出现的目标条带为DFR02~05、DFR08~11、DFR14、DFR19~22、pMT1;均缺少DFR01、DFR06、DFR07、DFR12、DFR13和DFR15~18。通过与参考文献中鼠疫菌DFR位点的分布和基因型结果比对[4], 确定这3株鼠疫菌的基因型为G20, 不同于以往分离菌株的G17型, 见表 2。

|
河北省鼠疫疫源地属于内蒙古长爪沙鼠鼠疫疫源地的延伸, 分离菌株的生态型均属鄂尔多斯高原型[5]。流行地区主要集中在与内蒙古自治区白旗、太仆寺旗以及化德县相邻的康保县北部, 以康保牧场为主要疫点, 照阳河镇和北沙城为散在疫点, 集中的流行区域和相同的流行环境使得前4次分离的所有菌株均属于同一个基因型G17[6]。而2017年动物鼠疫流行地区与内蒙古自治区化德县仅有约500 m的距离, 分离的菌株经鉴定, 其DFR基因型为G20, 这也与文献报道化德县分离菌株的基因型一致[7], 可见同一块疫源地, 流行地区和环境不同, 菌株的生态型虽然相同, 基因型却可能不同, 表明菌株基因分型在疫情的追根溯源中更有优势, 更能反映疫情的流行病学特征。
3.2 不同基因型DFR位点缺失比较基因缺失是细菌基因组进化的主要策略之一, DFR的获得与缺失受制于自然选择压力, 推动了鼠疫菌基因组的简约进化[7-8], G20相比于内蒙古长爪沙鼠鼠疫疫源地主要基因型G11, 缺失了DFR12和DFR18, 相比于之前河北省分离的菌株基因型G17, 缺失了DFR12, DFR12编码噬菌体蛋白, DFR18编码保守的功能未知蛋白[9]。可见在鼠疫菌中正经历着微进化过程。
3.3 流行特征此次河北省鼠疫疫源地康保县境内分离的G20基因型鼠疫菌株与化德县分离的菌株基因型一致, 而不同于以往河北省分离的鼠疫菌株G17型, 是鼠疫菌在河北省境内发生了基因缺失导致基因型改变还是由于流行地区紧邻化德县, 使得两地的基因型一致, 有待进一步分离菌株进行研究。
| [1] |
刘合智, 刘满福, 李玉贵. 河北省鼠疫自然疫源地内自然染疫蚤的研究[J]. 中国媒介生物学及控制杂志, 2005, 16(3): 206-208. DOI:10.3969/j.issn.1003-4692.2005.03.017 |
| [2] |
周冬生, 韩延平, 宋亚军, 等. 鼠疫耶尔森菌基因组进化与生态位适应研究[J]. 解放军医学杂志, 2004, 29(3): 204-210. DOI:10.3321/j.issn:0577-7402.2004.03.005 |
| [3] |
崔玉军, 宋亚军, 杨瑞馥. 鼠疫耶尔森氏菌的进化研究:从系统发育学到系统发育基因组学[J]. 中国科学:生命科学, 2013, 43(1): 23-30. |
| [4] |
杨晓艳, 魏柏青, 靳娟, 等. 中国鼠疫耶尔森菌差异区段分型及其地理分布特征[J]. 中华流行病学杂志, 2014, 35(8): 943-948. DOI:10.3760/cma.j.issn.0254-6450.2014.08.015 |
| [5] |
俞东征. 鼠疫动物流行病学[M]. 北京: 科学出版社, 2009: 276.
|
| [6] |
王海峰, 刘合智, 白雪薇, 等. 河北省116株鼠疫耶尔森菌差异片段基因分型及流行病学分析[J]. 中国媒介生物学及控制杂志, 2016, 27(5): 470-473. DOI:10.11853/j.issn.1003.8280.2016.05.012 |
| [7] |
李建云, 武正华, 胡艳红, 等. 2016年内蒙古长爪沙鼠疫源地化德县鼠疫菌的生态及DFR分型[J]. 医学动物防制, 2017, 33(4): 378-380. |
| [8] |
杨瑞馥, 黄培堂. 鼠疫耶尔森菌比较和进化基因组学研究[J]. 解放军医学杂志, 2004, 29(3): 189-191. DOI:10.3321/j.issn:0577-7402.2004.03.001 |
| [9] |
Li YJ, Dai EH, Cui YJ, et al. Different region analysis for genotyping Yersinia pestis isolates from China[J]. PLoS One, 2008, 3(5): e2166. DOI:10.1371/journal.pone.0002166 |
 2019, Vol. 30
2019, Vol. 30