扩展功能
文章信息
- 吴海生, 吴海莲, 杨晓艳, 李存香, 熊浩明, 何建, 李翔, 徐小青, 代瑞霞, 张青雯
- WU Hai-sheng, WU Hai-lian, YANG Xiao-yan, LI Cun-xiang, XIONG Hao-ming, HE Jian, LI Xiang, XU Xiao-qing, DAI Rui-xia, ZHANG Qing-wen
- 青海省海北藏族自治州鼠疫耶尔森菌病原学分析及流行病学意义
- An etiological study and epidemiological significance of Yersinia pestis in Haibei Tibetan Autonomous Prefecture, Qinghai province, China
- 中国媒介生物学及控制杂志, 2019, 30(1): 35-39
- Chin J Vector Biol & Control, 2019, 30(1): 35-39
- 10.11853/j.issn.1003.8280.2019.01.007
-
文章历史
- 收稿日期: 2018-10-08
- 网络出版时间: 2018-12-6 20:18
海北藏族自治州(海北州)位于青海省境东北部, 在我国最大的咸水湖青海湖北岸, 面积3.47万km2, 境内平均海拔3 100 m, 年平均气温-0.7℃, 年降水量在300~600 mm之间, 年蒸发量1 192 mm, 属于典型的高原大陆性气候。青海省33个鼠疫疫源县中就包括海北州的门源、祁连、刚察和海晏4个县[1]。祁连县在1959年被首次证实为鼠疫自然疫源地, 旱獭是该疫源地的主要宿主动物[2]。根据疫史资料和监测数据统计, 1958-2014年, 祁连县共发生鼠疫疫情79起, 其中人间鼠疫发生17起。从检出鼠疫耶尔森菌(鼠疫菌)年份上分析, 祁连县的鼠疫流行可能从静息期进入了活跃期[3], 所以防控形势依然严峻。刚察、门源和海晏县在20世纪50-80年代鼠疫流行也比较迅猛, 期间多次检出鼠疫菌, 鼠疫监测工作不容忽视。为此, 作者对1956-2011年海北州分离的鼠疫菌株进行病原学分析, 为该地区制订科学的鼠疫防控策略提供依据。
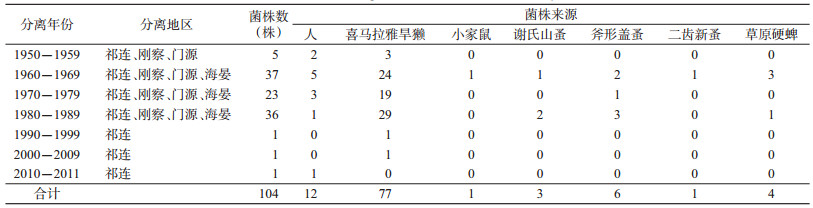
1 材料与方法 1.1 材料以1956-2011年海北州内不同宿主和媒介昆虫体内分离的104株鼠疫菌株作为实验对象。其中, 分离自喜马拉雅旱獭(Marmota himalayana)77株, 谢氏山蚤(Oropsylla silantiewi)3株, 斧形盖蚤(Callopsylla dolabris)6株, 二齿新蚤(Neopsylla bidentatiformis)1株, 人尸11株, 患者1株, 小家鼠(Mus musculus)1株, 草原硬蜱(Ixodes crenulatus)4株, 均由青海省地方病预防控制所鼠疫菌专业实验室提供。实验动物[实验动物使用许可证号:SYXK(青)2016-0001]由青海省地方病预防控制所实验动物中心提供, 是标准化的昆明系小白鼠, 体质量为18~20 g。经青海省地方病预防控制所实验动物伦理委员会批准, 本实验符合伦理要求。104株鼠疫菌的宿主、媒介及地区分布详见表 1。
对104株鼠疫菌株进行生化糖醇类试验、毒力因子检测、毒力判定、质粒分析及鼠疫菌差异区段(different region, DFR)分型等研究。
1.2.1 生化糖醇类试验普通琼脂培养基28℃培养被试菌株24 h, 用1%蛋白胨水将被试菌株制备成2×1013个菌/ml的菌悬液, 分别接种于标注阿胶糖、鼠李糖、麦芽糖、蜜二糖、甘油、脱氮培养基中, 混匀后放置于37℃温箱中连续观察7 d, 然后在室温条件下再连续观察7 d, 逐日观察发酵情况。以鼠疫菌标准强毒株141和假结核菌PTB5为阳性和阴性对照。分型依据及判定方法见文献[4]。
1.2.2 毒力因子检测用抗鼠疫血清培养基检测荚膜抗原(F1), 草酸镁培养基检测毒力抗原因子(VW), 氯化血红素培养基检测色素沉着因子(Pgm), 鼠疫杆菌素Ⅰ(PstⅠ)培养基检测PstⅠ。以鼠疫菌标准株141和假结核菌PTB5分别为阳性和阴性对照。结果判定方法见文献[4]。
1.2.3 毒力判定随机选取67株鼠疫菌, 将每株菌的37℃ 24 h培养物用无菌生理盐水制备成菌悬液, 标准比浊管法比浊后稀释为2×101、2×102、2×103、2×104、2×105、2×106、2×107个菌/ml的菌悬液, 分别取0.5 ml皮下注射于小白鼠鼠鼷部, 每组注射5只, 分笼饲养观察14 d。小白鼠死亡后解剖, 取淋巴、肝、脾、肺、心组织切面压印进行细菌培养, 以培养分离出鼠疫菌为特异性死亡, 并计算半数致死量(LD50)。毒力测定方法及判定标准参见文献[4]。
1.2.4 质粒分析质粒DNA相对分子质量(Mr)的测定采用标准质粒对照法, 参照文献[5]。
1.2.5 鼠疫菌DNA的提取DNA提取采用经典的苯酚-氯仿混合抽提法, 参照文献[6]。
1.2.6 细菌DFR分型利用23对DFR(DFR01~DFR23)分型引物及质粒验证引物(pMT1), 同时检索包含900余株鼠疫菌自然分离菌株的DFR分型数据库[6], 按照文献[7]的方法, 对被试菌株DNA进行PCR扩增。以82009、620024菌株DNA的等量混合物为阳性对照, 同时设置阴性对照, 引物序列及结果分析参见文献[5]。根据DFR分型结果, 确定鼠疫菌的基因组型。
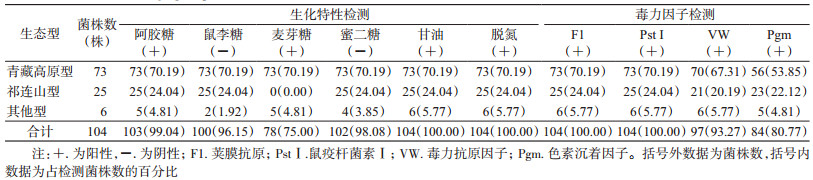
2 结果 2.1 鼠疫菌株生化特性104株鼠疫菌, 均有分解阿胶糖和甘油的能力, 脱氮反应也均为阳性, 而对鼠李糖、麦芽糖和蜜二糖的分解性能不一。104株鼠疫菌的生物型均为古典型, 生态型分布中有73株为青藏高原型, 25株为祁连山型, 6株为生态型, 见表 2。与分离地区疫源地的生态型不一致。
|
104株鼠疫菌均能产生F1和PstⅠ; VW阳性菌株占93.27%(97/104), 阴性菌株占6.73%(7/104);Pgm阳性菌株占80.77%(84/104), Pgm混合型菌株占6.73%(7/104), 阴性菌株占12.50%(13/104)。74.04%(77/104)的鼠疫菌4个毒力因子俱全。生态型与分离地区生态型不一致的6株菌, 除1株的Pgm为阴性外, 其余5株的4个毒力因子均为阳性, 见表 2。
2.3 鼠疫菌株毒力判定结果67株菌中有52株的LD50为(1~99)个菌/ml, 14株的LD50为(100~999)个菌/ml, 按鼠疫菌株毒力等级分类[4], 以上66株均属于强毒株; 有1株菌的LD50在(1 000~10 000)个菌/ml之间, 为中等毒力菌株。结果显示, 98.51%(66/67)的菌株为强毒鼠疫菌。
2.4 鼠疫菌株的质粒种类被鉴定的104株鼠疫菌中, 共携带3种质粒, Mr分别为6×106、45×106和52×106。3种质粒组成1种质粒谱:6×106、45×106和52×106。
2.5 鼠疫菌的基因分型共发现有6个基因组型, 分别为8型有75株(包括6株生态型与分离地区生态型不一致中的4株)、44型有20株(包括6株生态型与分离地区生态型不一致中的2株)、5型有6株、6型有1株、7型有1株、11型有1株, 均为青藏高原喜马拉雅旱獭鼠疫自然疫源地所有的基因组型, 见表 3、图 1。

|

|
| 图 1 青海省海北藏族自治州鼠疫菌基因组分型PCR产物电泳结果 Figure 1 Electrophoretogram of PCR-amplified products for genotyping of Yersinia pestis strains in Haibei Tibetan Autonomous Prefecture, Qinghai province |
| |
本研究显示, 1956-2011年在青海省海北州分离的104株鼠疫菌携均带1种质粒谱, 且98.51%为强毒株, 表明该地区分离的鼠疫菌株具有青藏高原喜马拉雅旱獭鼠疫疫源地病原学特征, 鼠疫菌毒力强, 传染性强, 动物间鼠疫一旦波及人间, 引起的人间鼠疫病例即多为重症型(肺型和败血型), 病死率较高[8-12]。
104株鼠疫菌中有6株的生化特性与青海省的3个生态型(青藏高原型、祁连山型和青海田鼠型)菌株不一致, 经过DFR分型分析, 此6株的基因组型均为青藏高原喜马拉雅旱獭鼠疫自然疫源地所有的主要基因组型(8型和44型), 而且所携带的质粒及毒力因子都与其他菌株基本一致, 可能是表型特征分型法自身分辨率低或稳定性不足所致, 有待于进一步积累资料进行研究论证。该地区鼠疫菌株基因组型较为复杂, 有6个基因组型, 分别为8型(75株)、44型(20株)、5型(6株)、6型(1株)、7型(1株)和11型(1株)。根据文献[7]的叙述, 青藏高原喜马拉雅旱獭鼠疫自然疫源地的主要基因组型为5型、8型、19型、32型和44型, 主要分布在青海省海北地区, 本研究结果与文献一致。6型虽然不是青藏高原喜马拉雅旱獭鼠疫自然疫源地的主要基因组型, 但是6型菌株主要存在于青藏高原喜马拉雅旱獭鼠疫自然疫源地[7]。7型和11型为青藏高原喜马拉雅旱獭鼠疫自然疫源地的次要基因组型, 7型是滇西山地齐氏姬鼠大绒鼠鼠疫自然疫源地的主要基因组型, 主要分布在云南省剑川地区; 11型是内蒙古高原长爪沙鼠鼠疫自然疫源地的主要基因组型, 主要分布在内蒙古、宁夏(陶乐、灵武)、陕西(定边)、河北(康保)地区。由此可见, 不同疫源地菌株之间有着多元关系, 这些菌株在不同的生态环境下基因可能发生一系列适应性变化, 形成了与原鼠疫自然疫源地差别很大的基因组型[13]。
追溯鼠疫流行史, 该地区动物鼠疫流行一直处于活跃态势。1956年以来, 全州共发生人间鼠疫疫情26起, 其中祁连县17起, 门源县4起, 刚察县5起, 共死亡25例; 其中人间鼠疫疫情在1956-1982年流行猛烈, 发生人间鼠疫24起, 2004和2011年又发生人间鼠疫疫情2起, 死亡2例。因此该地区的鼠疫防治工作不容松懈。此外, 该地区所辖祁连县与甘肃省肃南县相毗邻, 而肃南、肃北县也是鼠疫自然疫源地, 农牧民有剥食旱獭的习惯, 2014和2017年在甘肃省肃北县发生了2起人间鼠疫, 死亡2例, 因此要加大该地区的鼠疫防控力度, 加强相关部门间协作与区域联防, 避免鼠疫的远距离传播。
近年来, 随着青海省各州、县生态旅游业的不断发展, 来该地的游客数量不断增加, 每年的6-9月旅游旺季也正是鼠疫宿主喜马拉雅旱獭的出蛰期[14]。大量游客进入该地区, 与染疫动物接触机会增加, 外来人员感染鼠疫的风险增加。因此, 除了向当地居民进行鼠疫防治知识宣传外, 更应重视对外来游客的宣传教育工作。
| [1] |
王梅, 唐新元, 王祖郧, 等. 青海省鼠疫疫源地分布特征的研究[J]. 中国媒介生物学及控制杂志, 2015, 26(2): 194-195. DOI:10.11853/j.issn.1003.4692.2015.02.023 |
| [2] |
魏绍振, 焦巴太, 于守鸿. 小儿败血型鼠疫1例报道[J]. 中国地方病学杂志, 2006, 25(5): 477. DOI:10.3760/cma.j.issn.1000-4955.2006.05.034 |
| [3] |
杨晓艳, 靳娟, 何建, 等. 祁连县1958-2014年鼠疫流行病学分析[J]. 医学动物防制, 2016, 32(8): 827-828, 831. |
| [4] |
祁芝珍, 罗志丹巴, 段勇军, 等. 四川省德格县2株疑似喜马拉雅旱獭鼠疫菌株的鉴定[J]. 中国地方病学杂志, 2009, 28(1): 48-53. DOI:10.3760/cma.j.issn.1000-4955.2009.01.013 |
| [5] |
李敏, 于晓涛, 金丽霞, 等. 我国鼠疫菌大质粒的特性及其流行病学意义[J]. 中国地方病学杂志, 1994, 13(4): 223-225. |
| [6] |
Li YJ, Dai EH, Cui YJ, et al. Different region analysis for genotyping Yersinia pestis isolates from China[J]. PLoS One, 2008, 3(5): e2166. DOI:10.1371/journal.pone.0002166 |
| [7] |
杨晓艳, 魏柏青, 靳娟, 等. 中国鼠疫耶尔森菌差异区段分型及其地理分布特征[J]. 中华流行病学杂志, 2014, 35(8): 943-948. DOI:10.3760/cma.j.issn.0254-6450.2014.08.015 |
| [8] |
祁芝珍, 李超, 王丽, 等. 青海省三江源地区鼠疫病原学分析[J]. 中华流行病学杂志, 2009, 30(1): 55-57. DOI:10.3760/cma.j.issn.0254-6450.2009.01.016 |
| [9] |
李梅玉, 王国钧, 于守鸿, 等. 原发性肺鼠疫肺水肿肺大泡1例报告[J]. 中华地方病学杂志, 2011, 30(3): 322. DOI:10.3760/cma.j.issn.1000-4955.2011.03.025 |
| [10] |
崔百忠. 2001-2011年青海省人间鼠疫流行病学分析[J]. 中华地方病学杂志, 2013, 32(5): 520-522. DOI:10.3760/cma.j.issn.2095-4255.2013.05.013 |
| [11] |
戴瑞霞, 杨永海, 于守鸿, 等. 2004年青海省人间鼠疫菌生物学特性及流行病学分析[J]. 中国地方病学杂志, 2006, 25(2): 216. DOI:10.3760/cma.j.issn.1000-4955.2006.02.040 |
| [12] |
陈洪舰, 王虎, 王祖郧. 青海省青藏铁路沿线鼠疫防治思考[J]. 中国媒介生物学及控制杂志, 2010, 21(2): 150-152. |
| [13] |
张涛, 冯志勇. 鼠疫研究与控制措施[J]. 中国媒介生物学及控制杂志, 2008, 19(5): 490-492. DOI:10.3969/j.issn.1003-4692.2008.05.044 |
| [14] |
赵忠智, 魏荣杰, 张爱萍, 等. 青海省海南州2007-2012年鼠疫流行监测分析[J]. 中国媒介生物学及控制杂志, 2014, 25(6): 569-571. DOI:10.11853/j.issn.1003.4692.2014.06.023 |
 2019, Vol. 30
2019, Vol. 30